修回日期: 2010-05-10
接受日期: 2010-05-18
在线出版日期: 2010-06-18
当今, 靶向治疗成为肿瘤治疗模式里越来越重要的因子, 而靶向治疗中研究最多的是关于表皮生长因子受体(epidermal growth factor receptor, EGFR)靶向治疗药物. 随着临床的深入研究, EGFR分子靶向药物的临床应用利弊也成为关注的焦点. 此文就EGFR在结直肠癌靶向治疗中的研究进展作一综述.
引文著录: 王玉, 方明治, 金黑鹰. 表皮生长因子受体靶向治疗结直肠癌的临床进展. 世界华人消化杂志 2010; 18(17): 1804-1809
Revised: May 10, 2010
Accepted: May 18, 2010
Published online: June 18, 2010
Targeted therapy has evolved recently as an important treatment modality for cancer, and the most extensively studied pathways for targeted therapy are those related to the drugs of epidermal growth factor receptor (EGFR). Much attention has been paid to the advantages and disadvantages of these drugs in clinical application. This paper provides a literature review of the recent advances in EGFR-targeted therapy of colorectal cancer.
- Citation: Wang Y, Fang MZ, Jin HY. Recent advances in epidermal growth factor receptor-targeted therapy of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1804-1809
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1804.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1804
结直肠癌是常见的恶性肿瘤之一, 在全世界发病率居第3位, 每年全球大约有100万的新发病例, 有50万人死于结直肠癌. 在我国, 大肠癌的发病率位于全部恶性肿瘤的第4位, 且其发病率上升更为迅速. 大肠癌的治疗是以手术为主, 辅以化疗、放疗的综合治疗. 近年来在结直肠癌分子靶向治疗方面取得了重要的进展, 其表皮生长因子受体(epidermal growth factor receptor, EGFR)靶向治疗也得到了深入研究, 现就该方面进展综述如下.
EGFR是c-(erbB)-1原癌基因编码的170 kDa的跨膜糖蛋白, 属于Erb2B酪氨酸蛋白激酶家族, 由542个氨基酸残基构成的细胞基质酪氨酸激酶(TK)结构域, 和23个氨基酸残基组成的跨膜区, 及621个胞外配体结合部分组成. 是人类表皮因子家族(HER)之一[1]. 其结构分为: 细胞外配体结合区、疏水的跨膜区及含酪氨酸激酶的细胞内区.
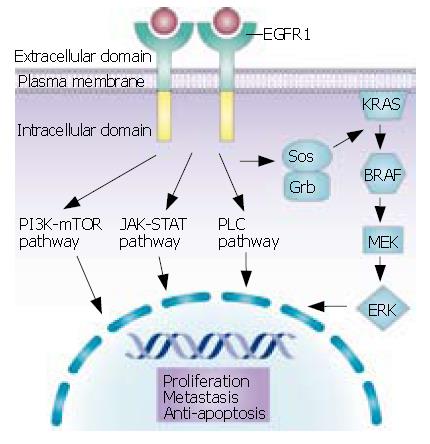
EGFR具有配体依赖性的酪氨酸激酶活性, 内源性配体表皮生长因子(epidermal growth factor, EGF)和转化生长因子-α(transforming growth factor-α, TGF-α)及双向调节因子、B纤维素等都可激活EGFR[2]. 当这些配体与EGFR细胞外区结合后, 在胞外区域形成受体同源二聚体或异源二聚体, 通过跨膜区促进胞内区域二聚化, 激活胞内区域酪氨酸激酶活性, 并进一步激活下游的Ras-Raf-MAPK[3]和PETN-PI3K-AKT等信号通路, 启动下游细胞信号分子完成细胞信号从膜外向膜内的转导过程.
EGFR有两条重要的下游通路, 即Ras-Raf-MAPK和PETN-PI3K-AKT[4]. Ras-Raf-MAPK激酶途径是EGFR下游的主要信号转导通路, 可引起细胞的增殖、转化和迁移等. Ras激活后启动下游多个磷酸化过程, 激活MAPKs(MAP激酶)、ERK1和ERK2(胞外信号调节蛋白激酶). ERK1和ERK2[5]调节与细胞增殖、存活及转化有关的分子的转录. 另一条PETN-PI3K-AKT通路, 主要影响细胞的生存、凋亡、侵袭和迁移等. Akt信号的转导促进不同的转录过程, 介导不同的细胞效应, 如细胞分化、生存或死亡、运动、侵袭、黏附和细胞修复. 此外, 应激激活蛋白激酶通路包括PKC、JAK/STAT[6]也参与了EGFR的信号转导, 这些通路最终将信号传递到细胞核内引起包括细胞分裂、增殖、生存、凋亡、迁移、侵袭、黏附等一系列生物反应(图1).
EGFR抑制剂的抗肿瘤机制[8]主要为: 单克隆抗体在胞外区可通过抑制内源性配体与EGFR的结合, 阻断与受体相关酶的磷酸化, 使受体失去活性, 阻断EGFR介导的细胞信号传导通路, 从而起到抑制肿瘤细胞生长和存活的作用, 或通过诱导凋亡和提高其他药物的细胞毒作用等发挥直接抗肿瘤作用. 其次还具有激发补体介导的细胞杀伤效应(CDC)和抗体依赖的细胞杀伤效应(ADCC)发挥间接抗肿瘤作用. 当前EGFR抑制剂主要有两类: 一类是针对EGFR受体胞外区的单克隆抗体; 另一类是抑制EGFR胞内区酪氨酸激酶的小分子化合物.
西妥昔单抗(cetuximab, C-225; 商品名: Erbitux, 爱必妥)是一种人-鼠嵌合型IgG1单克隆抗体[9], 由小鼠股静脉内抗表皮生长因子(epidermal growth factor, EGF)的抗体与人体重链和轻链恒定区的免疫球蛋白G1组成, 可以通过与受体胞外区结合, 竞争性的阻断受体的相关酶的磷酸, 从而干扰肿瘤生长、侵袭和转移, 达到抗癌目的.
1.2.1 西妥昔单抗一线治疗晚期CRC疗效: 2006年ASCO会议报道的CALGB 80203试验[10], 纳入238例初治的晚期大肠癌患者, 随机分成4组: FOLFOX(LV+5-FU+OXA)组、FOLFOX+西妥昔单抗组、FOLFIRI(LV+5-FU+Iri)组和FOLFIRI+西妥昔单抗组. 结果显示, 各组的有效率(response rate, RR)分别为40%、60%、36%和44%, 表明西妥昔单抗联合化疗组的有效率较单用化疗组高, 分别为38%和52%(P = 0.029), 证实了西妥昔单抗一线治疗晚期大肠癌的作用. 目前, 已有多项Ⅱ期临床试验显示西妥昔单抗无论联合伊立替康(innotecan, Iri, CPT-11)还是奥沙利铂(Oxaliplatin, OXA)为基础的化疗方案一线治疗晚期大肠癌均有较高疗效. 西妥昔单抗联合IFL(Iri+5-FU+LV)方案、AIO(LV+5-FU)方案和FUFOX(5-FU+LV+OXA)方案一线治疗晚期大肠癌的总有效率(overall response rate, ORR)分别为44%[11]、67%[12]、56%[13]. 此外, CELIM研究[14]表明西妥昔单抗联合FOLFIRI和FOLFOX, 可使肝转移瘤的切除率分别为13%和21%. 这为不可手术的晚期大肠癌转变成可手术的大肠癌、提高治愈率提供了一条新的途径. 最近, Kohne等[15]对OPUS试验进行了Meta分析, 337例患者中93%(315例)获得KRAS基因型评价, 其中KRAS野生型179例(57%), 突变型136例(43%). 此外在KRAS野生型患者中175例确定了BRAF基因状态, 其中154例(94%)为野生型, 164例(94%)为突变型. 结果显示: FOLFOX4+西妥昔单抗组与单用FOLFOX4方案组的总缓解率(CR+PR)分别为57.3%和34.0%(P = 0.0027, 优势比(odds ratio, OR) = 2.5512), 疾病无进展时间(progression free survival, PFS)也显著延长(中位PFS: 8.3 mo vs 7.2 mo, 危险比(hazard ration, HR) = 0.567, P = 0.0064), 总生存期(overall survival, OS)较单用FOLFOX4有延长趋势(22.8 mo vs 18.5 mo, P = 0.3854), 且肿瘤最佳缩小比例平均高11.6%. 与此同时, 对BRAF突变型患者的分析显示: 联合组比单纯化疗组的PFS延长(中位PFS: 7.1 mo vs 1.7 mo, P = 0. 3255), 且OS有显著差异(中位OS: 20.7 mo vs 4.4 mo, P = 0.0167). 此试验初期结果显示, 对KRAS突变型患者, 西妥昔单抗联合FOLFOX4和单用FOLFOX4, PFS分别为5.5 mo和8.6 mo(P = 0.019), 有效率为33%和49%(P = 0.166), 且KRAS野生型与突变型的有效率相差近2倍. 以上结果表明: FOLFOX联合西妥昔单抗对KRAS野生型患者能获得良好的疗效, 而BRAF基因突变者也能从西妥昔单抗中获益. 但对于KRAS突变者, 西妥昔单抗不仅无益, 可能有害. 这使得西妥昔单抗的使用更具有选择性和针对性. 此外, Van Cutsem[16]也公布了CRYSTAL试验的最新进展. CRYSTAL试验共入组了1 198例患者, 其1 063例(89%)检测了KRAS表达状态(666例为野生型, 397例为突变型); 研究显示西妥昔单抗联合FOLFIRI方案与单纯FOLFIRI的OS分别为23.5 mo和20.0 mo(HR = 0.796, P = 0.0012), 且PFS为9.9 mo和8.4 mo(HR = 0.696, P<0.0001). KRAS野生型患者肿瘤最佳缩小比例较单纯FOLFIRI组平均提高13.9%. 此外, 该研究也进一步分析了BRAF基因状态对KRAS野生型患者疗效的预测性. 入组的患者中有1 000例确定了BRAF的表达状态, 其中60例(6%)患者BRAF为突变型, 且KRAS野生型患者中BRAF野生型占85%(566例), 突变型占25%(59例). 结果显示KRAS野生型患者中BRAF野生型的预后好于突变型, 但BRAF突变患者仍可从西妥昔单抗治疗中获益. 说明BRAF基因状态并非西妥昔单抗临床用药的预测因子, 而是其治疗的预后因素之一. 此观点和OPUS研究结果相一致. 这两项研究都进一步表明只有KRAS野生型患者才能从西妥昔单抗联合FOLFOX或FOLFIRI方案治疗中获得良好的疗效, 而KRAS突变型患者却无效[17], 也更坚定了检测KRAS基因在转移性结直肠癌(metastatic colorectal cancer, mCRC)治疗中的关键性作用.
1.2.2 西妥昔单抗二线治疗晚期CRC疗效: Cunningham等[18]发表在新英格兰杂志上的BOND-1研究是西妥昔单抗二线治疗CRC的代表性临床试验, 报道对329例EGFR表达阳性、伊立替康为基础方案化疗失败的mCRC患者按2:1的比例随机分为西妥昔单抗+伊立替康联合治疗组(n = 218), 和西妥昔单抗单药治疗组(n = 111). 结果两组的部分缓解率(partial remission, PR)分别为22.9%和10.8%, 疾病稳定率(stable disease, SD)为32.6%和21.6%, 疾病进展时间(time to progression, TTP)为4.1 mo和1.5 mo(P<0.001), 中位生存期为8.6 mo和6.9 mo, 但无统计学意义. 结果提示: 西妥昔单抗联合伊立替康用于晚期mCRC患者的治疗, 可以增强伊立替康的抗肿瘤作用, 减少其耐药性的发生. 据此, 2004-02美国FDA批准西妥昔单抗单用或联合伊立替康作为二线方案治疗晚期大肠癌患者. 此外, Ⅲ期临床EPIC[19]研究入组了1 298例奥沙利铂一线治疗失败、EGFR阳性的mCRC患者. 将其随机分为西妥昔单抗联合伊立替康组和伊立替康单药治疗组. 结果显示, 西妥昔单抗联合伊立替康作为mCRC的二线治疗可以显著延长PFS(4 mo vs 2.6 mo, P<0.01), 提高PR(16.4% vs 4.2%, P<0.01), 且其治疗反应率为单药治疗的4倍, 但平均生存期却未得到延长. 虽然临床试验观察到EGFR的阳性率越高, 抗EGFR治疗的效果越好, 但关于BOND和EPIC试验的详细临床研究并不能证明EGFR的表达水平与治疗反应有明确联系, 且后来由EVEREST[20]等大量试验证实, EGFR表达阳性与否对西妥昔单抗疗效预测并无意义, 也不能作为接受或排除西妥昔单抗治疗的根据, 而KRAS状态与疗效的相关性更强, 是西妥昔单抗疗效预测的独立指标. 据此2010年NCCN《指南》指出: 所有转移性结肠癌患者都应检测KRAS基因状态, 突变患者不应接受含EGFR单抗方案治疗.
1.2.3 西妥昔单抗三线治疗晚期CRC疗效: MABEL试验[21]采纳了1 147例伊立替康治疗失败的晚期结直肠癌患者, 分别采用3个治疗方案: 西妥昔单抗联合伊立替康, 伊立替康用量为A组125 mg/m2每周; B组: 180 mg/m2每2周; C组: 350 mg/m2每3周. 结果显示各方案的PFS相似, 在第12周时PFS为61%; 中位生存期为9.2m. 该试验还发现西妥昔单抗用药前加入皮质激素及抗组织胺药可增加安全性而不影响抗肿瘤效率[22].
帕尼单抗(panitumumab, ABX-EGF, Vectibix)是一个完全人源化的IgG2单克隆抗体[23]. 与西妥昔单抗相比, 帕尼单抗与EGFR具有更高亲和性, 可同时阻断EGF和TGF-α与之结合, 且半衰期更长, 免疫原性低, 治疗前不需预处理.
1.3.1 帕尼单抗一线治疗晚期CRC疗效: 在帕尼单抗的一线治疗方面, Berlin[24]等比较了帕尼单抗+IFL(n = 19)和帕尼单抗+FOLFIRI(n = 24)一线治疗mCRC, 结果显示, 帕尼单抗+IFL组除RR(46% vs 42%)外, 疾病控制率(disease control rate, DCR)(74% vs 79%), 中位PFS(5.6 mo vs 10.9 mo)及中位OS(17 mo vs 22.5 mo), 均低于帕尼单抗+FOLFIRI组, 且3、4级腹泻的发生率明显高于帕尼单抗+FOLFIRI组(58% vs 25%), 说明帕尼单抗联合FOLFIRI方案相对具有优势. 最近报道的PRIME试验[25]将1 183例mCRC患者随机分成两组, 分别接受FOLFIRI+帕尼单抗的联合治疗和FOLFIRI单纯支持治疗. 其中1 096例(93%)检测了KRAS基因表达, 且656(60%)例为野生型KRAS, 440(40%)例为突变型. 结果联合治疗组与单纯支持组中KRAS野生型患者的PFS分别为9.6 mo vs 8.0 mo(HR = 0.80; P = 0.02), RR为55% vs 48%, 而两组的KRAS突变型患者中位PFS为7.3 mo vs 8.8 mo(HR = 1.29; P = 0.02), 但联合治疗组与支持治疗组的突变型KRAS患者之间的PFS、OS和RR对比无差异.
1.3.2 帕尼单抗二线治疗晚期CRC疗效: Amado等[26]报道了一组Ⅲ期临床随机对照研究, 对427例化疗已失败的mCRC患者分别行单纯最佳支持治疗(BSC)和帕尼单抗联合最佳支持治疗, 并检测其KRAS状态. 其中野生型KRAS占57%, 突变型KRAS占43%, 单纯治疗组中野生型和突变型KRAS的mPFS均为7.3 wk, 而联合治疗组的mPFS分别为12.4 wk和7.4 wk. 两种治疗有效率(PR)为0%和17%, SD为12%和34%, 无明显差异. 但联合分析时野生型KRAS的OS长于突变型KRAS, 且野生型的结直肠癌症状和生活质量均优于突变型. 研究提示: 只有野生型KRAS才能从帕尼单抗靶向治疗中获益. 此结论与西妥昔单抗治疗一致[27,28]. 此外, Peters等[29]也报道了Ⅲ期临床研究的最新进展, 此试验共收入1 186例既往化疗(包括5-FU、OXA和Iri)失败的晚期大肠癌患者, 随机分成两组, 分别接受帕尼单抗+FOLFIRI的联合治疗和FOLFIRI单纯支持治疗. 其中1 083(91%)例患者检测了KRAS基因表达, 这其中的597(55%)例为野生型KRAS, 486(45%)例为突变型. 结果显示联合治疗组与单纯支持组相比, 显著延长KRAS野生型患者的PFS(5.9 mo vs 3.9 mo)(HR = 0.73, P = 0.004)和中位OS(14.5 mo vs 12.5 mo)(HR = 0.85; P = 0.12)且RR也显著提高(35% vs 10%). 然而联合治疗组与支持治疗组的突变型KRAS患者之间的PFS、OS和RR对比无差异. 这进一步说明了帕尼单抗联合二线化疗可显著降低KRAS野生型患者的死亡风险和疾病进展风险, 并能提高其总缓解率.
吉非替尼(gefitinib, Iressa)是一种合成的低相对分子质量苯胺喹唑啉化合物, 为针对EGFR酪氨酸激酶的口服小分子抑制剂, 能选择性且可逆性抑制EGFR酪氨酸激酶磷酸化和EGF刺激的细胞增殖.
有学者认为: 吉非替尼在临床及生物学上对mCRC者无效, 但其与多种化疗药物如5-FU、Iri、OXA、Capecitabine的联合治疗却卓有成效. Fisher等[30]报道了一项吉非替尼联合FOLFOX4一线治疗mCRC的Ⅱ期临床试验, 45例mCRC Ⅳ期且从未接受过化疗的患者, 第一周期予以FOLFOX4, 此后的每个周期行FOLFOX4联合口服吉非替尼连续14 d. 结果显示中位OS为20.5 mo, 中位TTP为9.3 mo, 然而3-4级腹泻达67%, 神经毒性占60%, 且由吉非替尼引起的典型性的2级痤疮样皮疹为60%. 这说明吉非替尼联合FOLFOX4一线治疗mCRC虽然增加了RR, 但与单用FOLFOX4相比, 其毒性反应也大大增加.
埃罗替尼(Erlotinib, OSI-774, Tarceva)属于喹唑啉家族复合物, 是一种高特异性、可逆的表皮生长因子受体酪氨酸激酶抑制剂. 他通过抑制EGFR(HER1)自身磷酸化, 从而抑制了下游信号传导与细胞增殖.
Keilholz等在2005年的ASCO会议上报道了埃罗替尼作为二、三线治疗转移性直肠癌的研究, 初步结果8%患者取得PR, 33%患者疾病SD. 另有Townsley等[31]进行的转移性结直肠癌的第二阶段研究中, 给予38例转移性肠癌患者每天口服埃罗替尼150 mg,结果显示19例(61%)有疾病发展(PD), 12例(39%)病情稳定(SD). 中位数时间为123 d.
此外埃罗替尼与多种化疗药物联用能产生更高的缓解率, 但埃罗替尼联合其他化疗药也显示出了更高的毒性. Meyerhardt等[32]的一项关于贝伐单抗联合埃罗替尼一线治疗研究, 对既往未曾治疗的35名mCRC患者予以FOLFOX方案联合贝伐单抗和埃罗替尼进行治疗, 结果显示只有1例证实完全缓解, 其余由于毒性反应过大终止治疗. Messersmith等将埃罗替尼与FOLFIRI方案联合, 实验也因毒性太大最终被迫停止.
尽管早期的BOND-2[33]研究及其他少数临床试验曾提示, 西妥昔单抗和贝伐单抗的联合应用可能进一步提高疗效. 但荷兰Tol开展的CAIRO2[34]研究和美国Hecht等开展的PACCE[35]研究均表明, 靶向EGFR的西妥昔单抗或帕尼单抗+贝伐单抗+化疗(三药联合)治疗的主要研究终点PFS显著短于贝伐单抗+化疗(两药联合), 并且不良反应更大. 多靶点药物的临床研究已经表明, 药物的靶点越多, 不良反应越大. 两项研究中均是三药组的PFS和OS比两药组短, 说明三药联合并不优于两药联合. 这也就否定了两种有效的单克隆抗体(即西妥昔单抗和贝伐单抗)同时加用于化疗的所谓"豪华方案"的疗效性,这在2010年NCCN《指南》中已有明确反映.
虽然我们对EGFR和VEGF的信号转导通路有了一定程度的了解, 但是上述贝伐单抗联合西妥昔单抗或帕尼单抗的临床研究提示我们, 这些信号转导通路中还有很多"未知"有待我们去揭示.
随着肿瘤靶向药物的开发及应用, 越来越多的靶向药物涌入临床, 这在为临床肿瘤医生提供更有效的治疗手段外, 也为之提出了新的问题: 肿瘤的发生发展存在着多靶点、多环节调控过程, 因此是否多靶点抑制就意味着治疗更有效呢?如何选择适合不同靶向治疗的患者、怎样克服靶向药物的耐药性, 靶向治疗药物与化疗药物怎样组合才能达到最佳疗效, 如何利用临床和分子指标选择患者和预测疗效等等问题, 都要求我们通过临床及实验, 不断深入了解靶向药物来一个个攻克. 相信靶向治疗时代的到来必将使肿瘤治疗迎来崭新的明天.
近年来, 建立在分子生物学基础上的靶向治疗, 以其高效性和低毒性的特点成为研究热点并取得了实质性的疗效, 而EGFR是关注最为广泛、研究最为深入、也是最有前途的治疗靶点之一.
王石林, 主任医师, 中国人民解放军空军总医院普通外科.
当今, 靶向治疗成为肿瘤治疗模式里越来越重要的因子, 而靶向治疗中研究最多的是关于表皮生长因子受体(EGFR)靶向治疗药物.
荷兰Tol开展的CAIRO2研究和美国Hecht等开展的PACCE研究均表明, 靶向EGFR的西妥昔单抗或帕尼单抗+贝伐单抗+化疗(三药联合)治疗的主要研究终点PFS显著短于贝伐单抗+化疗(两药联合), 并且不良反应更大.
靶向治疗已成为肿瘤治疗的又一大热点. 相对于手术、放射治疗、化学治疗三大方法更具有特异性, 且与化学治疗比较, 具有非细胞毒性和靶向性, 为肿瘤的治疗提供了另一种可能的有效途径.
文章的科学性、创新性和可读性能较好地反映我国或国际胃肠病学临床和基础研究的先进水平.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Marshall JL. Vascular Endothelial Growth Factor plus Epidermal Growth Factor Receptor Dual Targeted Therapy in Metastatic Colorectal Cancer: Synergy or Antagonism? J Oncol. 2009;2009:937305. [PubMed] |
| 2. | 魏 学明, 顾 国利, 任 力, 熊 梅, 王 石林, 李 德昌. 大肠癌EGFR、HER-2、VEGF表达特点及其对分子靶向治疗的指导意义. 世界华人消化杂志. 2009;17:1836-1841. [DOI] |
| 3. | Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. N Engl J Med. 2008;358:1160-1174. [PubMed] [DOI] |
| 4. | Halilovic E, Solit DB. Therapeutic strategies for inhibiting oncogenic BRAF signaling. Curr Opin Pharmacol. 2008;8:419-426. [PubMed] [DOI] |
| 5. | Messersmith WA, Ahnen DJ. Targeting EGFR in colorectal cancer. N Engl J Med. 2008;359:1834-1836. [PubMed] [DOI] |
| 6. | Zhu Z. Targeted cancer therapies based on antibodies directed against epidermal growth factor receptor: status and perspectives. Acta Pharmacol Sin. 2007;28:1476-1493. [PubMed] [DOI] |
| 7. | Walther A, Johnstone E, Swanton C, Midgley R, Tomlinson I, Kerr D. Genetic prognostic and predictive markers in colorectal cancer. Nat Rev Cancer. 2009;9:489-499. [PubMed] [DOI] |
| 8. | Ng K, Zhu AX. Targeting the epidermal growth factor receptor in metastatic colorectal cancer. Crit Rev Oncol Hematol. 2008;65:8-20. [PubMed] [DOI] |
| 9. | Zhang W, Gordon M, Lenz HJ. Novel approaches to treatment of advanced colorectal cancer with anti-EGFR monoclonal antibodies. Ann Med. 2006;38:545-551. [PubMed] [DOI] |
| 10. | Venook A, Niedzwiecki D, Hollis D, Sutherland S, Goldberg R, Alberts S, Benson A, Wade J, Schilsky R, Mayer R. Phase III study of irinotecan/5FU/LV (FOLFIRI) or oxaliplatin/5FU/LV (FOLFOX) ± cetuximab for patients (pts) with untreated metastatic adenocarcinoma of the colon or rectum (MCRC): CALGB 80203 preliminary results. J Clin Oncol. 2006;24:Abstracts 3509. |
| 12. | Folprecht G, Lutz MP, Schöffski P, Seufferlein T, Nolting A, Pollert P, Köhne CH. Cetuximab and irinotecan/5-fluorouracil/folinic acid is a safe combination for the first-line treatment of patients with epidermal growth factor receptor expressing metastatic colorectal carcinoma. Ann Oncol. 2006;17:450-456. [PubMed] [DOI] |
| 13. | Arnold D, Höhler T, Dittrich C, Lordick F, Seufferlein T, Riemann J, Wöll E, Herrmann T, Zubel A, Schmoll HJ. Cetuximab in combination with weekly 5-fluorouracil/folinic acid and oxaliplatin (FUFOX) in untreated patients with advanced colorectal cancer: a phase Ib/II study of the AIO GI Group. Ann Oncol. 2008;19:1442-1449. [PubMed] [DOI] |
| 14. | Folprecht G, Gruenberger T, Bechstein WO, Raab HR, Lordick F, Hartmann JT, Lang H, Frilling A, Stoehlmacher J, Weitz J. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol. 2010;11:38-47. [PubMed] [DOI] |
| 15. | Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, D'Haens G, Pintér T, Lim R, Bodoky G. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360:1408-1417. [PubMed] [DOI] |
| 16. | Karapetis CS, Khambata-Ford S, Jonker DJ, O'Callaghan CJ, Tu D, Tebbutt NC, Simes RJ, Chalchal H, Shapiro JD, Robitaille S. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008;359:1757-1765. [PubMed] [DOI] |
| 17. | Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, Bets D, Mueser M, Harstrick A, Verslype C. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-345. [PubMed] [DOI] |
| 18. | Sobrero AF, Maurel J, Fehrenbacher L, Scheithauer W, Abubakr YA, Lutz MP, Vega-Villegas ME, Eng C, Steinhauer EU, Prausova J. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:2311-2319. [PubMed] [DOI] |
| 19. | Tejpar S, Peeters M, Humblet Y, Vermorken JB, De Hertogh G, De Roock W, Nippgen J, von Heydebreck A, Stroh C, Van Cutsem E. Relationship of efficacy with KRAS status (wild type versus mutant) in patients with irinotecan-refractory metastatic colorectal cancer (mCRC), treated with irinotecan (q2w) and escalating doses of cetuximab (q1w): The EVEREST experience (preliminary data). J Clin Oncol. 2008;26:Abstract 4001. |
| 20. | Wilke H, Glynne-Jones R, Thaler J, Adenis A, Preusser P, Aguilar EA, Aapro MS, Esser R, Loos AH, Siena S. Cetuximab plus irinotecan in heavily pretreated metastatic colorectal cancer progressing on irinotecan: MABEL Study. J Clin Oncol. 2008;26:5335-5343. [PubMed] [DOI] |
| 21. | Siena S, Glynne-Jones R, Adenis A, Thaler J, Preusser P, Aguilar EA, Aapro MS, Loos AH, Esser R, Wilke H. Reduced incidence of infusion-related reactions in metastatic colorectal cancer during treatment with cetuximab plus irinotecan with combined corticosteroid and antihistamine premedication. Cancer. 2010;116:1827-1837. [PubMed] [DOI] |
| 22. | Giusti RM, Shastri KA, Cohen MH, Keegan P, Pazdur R. FDA drug approval summary: panitumumab (Vectibix). Oncologist. 2007;12:577-583. [PubMed] [DOI] |
| 23. | Berlin J, Posey J, Tchekmedyian S, Hu E, Chan D, Malik I, Yang L, Amado RG, Hecht JR. Panitumumab with irinotecan/leucovorin/5-fluorouracil for first-line treatment of metastatic colorectal cancer. Clin Colorectal Cancer. 2007;6:427-432. [PubMed] [DOI] |
| 24. | Siena S, Cassidy J, Tabernero J, Burkes RL, Barugel ME, Humblet Y, Cunningham D, Xu F, Gansert JL, Douillard J. Randomized phase III study of panitumumab (pmab) with FOLFOX4 compared to FOLFOX4 alone as first-line treatment (tx) for metastatic colorectal cancer (mCRC): PRIME trial. 2010 GI Cancers Symposium. 2010;Abst 283. |
| 25. | Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, Juan T, Sikorski R, Suggs S, Radinsky R. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:1626-1634. [PubMed] [DOI] |
| 26. | De Rosck W, De Schutter J, De Hertogh G, Janssens M, Biesmans B, Personeni N, Geboes K, Verslype C, Van Cutsem E, Tejpar S. KRAS mutations preclude tumor shrinkage of colorectal cancer treated with cetuximab. J Clin Oncol(Meeting Abstracts). 2007;25:18S Abst 4132. |
| 27. | Finocchiaro G, Cappuzzo F, Jänne PA, Bencardino K, Carnaghi C, Franklin WA, Roncalli M, Crinò L, Santoro A, Varella-Garcia M. EGFR, HER2 and Kras as predictive factors for cetuximab sensitivity in colorectal cancer. J Clin Oncol(Meeting Abstracts). 2007;25:18S Abst 4021. |
| 28. | Peeters M, Price TJ, Hotko YS, Cervantes-Ruiperez A, Ducreux M, Andre T, A. Strickland A, Wilson G, Tian Y, Gansert JL. Randomized phase III study of panitumumab (pmab) with FOLFIRI versus FOLFIRI alone as second-line treatment (tx) in patients (pts) with metastatic colorectal cancer (mCRC): Patient-reported outcomes (PRO). 2010 GI Cancers Symposium. 2010;Abst 282. |
| 29. | Fisher GA, Kuo T, Ramsey M, Schwartz E, Rouse RV, Cho CD, Halsey J, Sikic BI. A phase II study of gefitinib, 5-fluorouracil, leucovorin, and oxaliplatin in previously untreated patients with metastatic colorectal cancer. Clin Cancer Res. 2008;14:7074-7079. [PubMed] [DOI] |
| 30. | Townsley CA, Major P, Siu LL, Dancey J, Chen E, Pond GR, Nicklee T, Ho J, Hedley D, Tsao M. Phase II study of erlotinib (OSI-774) in patients with metastatic colorectal cancer. Br J Cancer. 2006;94:1136-1143. [PubMed] [DOI] |
| 31. | Meyerhardt JA, Stuart K, Fuchs CS, Zhu AX, Earle CC, Bhargava P, Blaszkowsky L, Enzinger P, Mayer RJ, Battu S. Phase II study of FOLFOX, bevacizumab and erlotinib as first-line therapy for patients with metastatic colorectal cancer. Ann Oncol. 2007;18:1185-1189. [PubMed] [DOI] |
| 32. | Saltz LB, Lenz HJ, Kindler HL, Hochster HS, Wadler S, Hoff PM, Kemeny NE, Hollywood EM, Gonen M, Quinones M. Randomized phase II trial of cetuximab, bevacizumab, and irinotecan compared with cetuximab and bevacizumab alone in irinotecan-refractory colorectal cancer: the BOND-2 study. J Clin Oncol. 2007;25:4557-4561. [PubMed] [DOI] |
| 33. | Tol J, Koopman M, Rodenburg CJ, Cats A, Creemers GJ, Schrama JG, Erdkamp FL, Vos AH, Mol L, Antonini NF. A randomised phase III study on capecitabine, oxaliplatin and bevacizumab with or without cetuximab in first-line advanced colorectal cancer, the CAIRO2 study of the Dutch Colorectal Cancer Group (DCCG). An interim analysis of toxicity. Ann Oncol. 2008;19:734-738. [PubMed] [DOI] |
| 34. | Hecht JR, Mitchell E, Chidiac T, Scroggin C, Hagenstad C, Spigel D, Marshall J, Cohn A, McCollum D, Stella P. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol. 2009;27:672-680. [PubMed] [DOI] |