修回日期: 2010-04-28
接受日期: 2010-05-10
在线出版日期: 2010-06-18
目的: 探讨环氧化酶-1(COX-1)选择性抑制剂莫苯唑酸对牛脂促进的大鼠结肠癌发生的作用.
方法: SD♂大鼠共108只. 腹腔注射AOM (azoxymethane)后予不同牛脂含量饲料(混合0.12%莫苯唑酸)12 wk, 通过对结肠总ACF及多隐窝ACF(≥4个异常隐窝/病灶)计数, 评估莫苯唑酸对结肠肿瘤形成早期的影响; 腹腔注射生理盐水或AOM后予以10%牛脂饲料(混合0.12%莫苯唑酸)44 wk, 观察莫苯唑酸对肿瘤发病率及数量的影响. BrdU评估肿瘤周围外观正常黏膜的增殖状况, Western blot检测黏膜β-catenin的表达, 探讨莫苯唑酸影响肿瘤发生的可能机制.
结果: 12 wk时, 莫苯唑酸组ACF尤其是多隐窝ACF显著低于对照组(P<0.05).44 wk时莫苯唑酸组肿瘤发病率及平均肿瘤数量分别为66.7%和2.5±2.3, 低于对照组(100%、5.3±1.2)(P<0.05); 莫苯唑酸组隐窝增殖细胞的数量均显示出下降趋势(5±0.82 vs 3.25±0.50; 7.75±0.96 vs 4.75±0.50, 均P<0.05), 且表现出趋向于生理分布的变化. β-catenin表达均低于对照组(P<0.05).
结论: 莫苯唑酸可有效抑制牛脂促进的大鼠结肠癌发生, 这可能与结肠隐窝上皮细胞β-catenin的表达及增殖受到抑制有关.
引文著录: 苗鲁杰, 白石良介, 藤濑剛弘, 柿本隆志, 岩切龙一, 藤本一真, 施瑞华, 李学良. 莫苯唑酸对牛脂促进的大鼠结肠癌发生的影响. 世界华人消化杂志 2010; 18(17): 1767-1772
Revised: April 28, 2010
Accepted: May 10, 2010
Published online: June 18, 2010
AIM: To investigate the effect of mofezolac, a selective cyclooxygenase (COX)-1 inhibitor, on beef tallow-promoted colon carcinogenesis in rats.
METHODS: One hundred and eight male Sprague-Dawley rats were used in this study. One group of rats were injected with azoxymethane (AOM) and fed diets containing different percentages of beef tallow (with or without 0.12% mofezolac) for 12 wk. Total aberrant crypt foci (ACF) and multicrypt ACF were counted to evaluate the effect of mofezolac on early carcinogenesis. Another group of rats were injected with AOM or saline and fed a 10% beef tallow diet (with or without 0.12% mofezolac) for 44 wk to evaluate the effect of mofezolac on tumor incidence and number. To explore the mechanism behind the effect of mofezolac on carcinogenesis, the proliferation of normal-appearing colonic mucosa surrounding the tumor was evaluated by BrdU incorporation assay, and the expression of β-catenin in the normal-appearing colonic mucosa was analyzed by Western blot.
RESULTS: At week 12, the number of ACF in the mofezolac group was significantly lower than that in the control group (P < 0.05). At week 44, tumor incidence and multiplicity were significantly lower in the mofezolac group than in the control group (66.7% vs 100%, and 2.5 ± 2.3 vs 5.3 ± 1.2, respectively; both P < 0.05). Proliferative cells were much fewer in the mofezolac group than in the control group (5 ± 0.82 vs 3.25 ± 0.50; 7.75 ± 0.96 vs 4.75 ± 0.50, both P < 0.05). Besides, the distribution of proliferative cells in saline- and AOM-treated rats was similar to that under physiological condition. Down-regulation of β-catenin expression was also observed in the mofezolac group when compared with the control group.
CONCLUSION: Mofezolac effectively suppresses beef tallow-promoted colon carcinogenesis in rats probably by down-regulating β-catenin expression and inhibiting colonic proliferation.
- Citation: Miao LJ, Shiraishi R, Fujise T, Kakimoto T, Iwakiri R, Fujimoto K, Shi RH, Li XL. Mofezolac suppresses beef tallow-promoted colon carcinogenesis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1767-1772
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1767
结肠癌是世界范围内导致死亡的主要肿瘤之一,在欧美日等发达国家尤为显著[1]. 在我国, 随着饮食结构的变化, 其发病率呈逐年快速上升趋势. 流行病学证实, 高脂饮食(主要为饱和性脂肪酸)与结肠癌发病存在正相关[2-5]. 本实验室先前研究表明, 牛脂饮食可通过Wnt/β-catenin途经提高大鼠结肠癌的发病风险[6]. 考虑到饮食结构转变的困难性, 化学预防或成为降低结肠癌更加现实有效的手段. 流行病学及临床试验证实, 长期摄入非甾体类抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)对结肠癌的发生具有抑制作用[7]. 作为NSAIDs的靶目标, 环氧化酶(cyclooxygenase, COX)在花生四烯酸转化为前列腺素(prostaglandins, PGs)如前列腺素E2(prostaglandin E2, PGE2)中发挥着限速酶的作用, 而后者参与了一系列肿瘤相关活动, 如免疫反应、细胞增殖、血管生成等[8]. 目前普遍认为, COX-2可催化合成前列腺素H2(prostaglandin H2, PGH2), 后者进一步转化为PGE2, 因此COX-2选择性抑制在结肠癌防治中有重要作用[9,10]. 但近年的研究表明, COX-2选择性抑制剂在安全性及有效性发面仍存在很大缺陷[11,12], 限制了其在临床的推广应用. 另一方面, COX-1在机体内广泛表达, 参与了多种生理功能如维持胃黏膜完整性, 维持正常肾功能等[13], 其在肿瘤发生发展方面也具有重要作用[14], 但相关研究较少. 异常隐窝灶(aberrant crypt foci, ACF)通常由单个或聚集成灶的异常隐窝组成. 异常隐窝(aberrant crypt)不同于正常隐窝之处在于: 开口呈锯齿状、裂隙状等多种形状; 上皮层增厚; 细胞核多表现为不典型增生等. ACF在结肠癌发生的早期即可出现. 致癌剂处理后异常隐窝灶中隐窝的数量(crypt/foci)常随时间增长, 且ACF常具有高水平的细胞增殖表现. ACF目前被认为是肿瘤前期或癌变前期损害[15]. 因此ACF在评估肿瘤发病风险中具有较高价值. Apc基因最早发现于家族腺瘤性息肉病(familial adenomatous polyposis, FAP)[16], 约85%散发型结肠癌显示具有Apc基因功能的丢失[17]. 目前普遍认为Apc基因的重要功能在于他可使聚集在细胞质内的β-catenin不稳定化, 进而被降解[18-21], 而后者参与了胚胎发育及肿瘤的发生[18,19]. 本研究旨在观察COX-1选择性抑制剂莫苯唑酸对牛脂饮食大鼠结肠癌发生的作用及对结肠隐窝增殖细胞和β-catenin表达的影响.
清洁级SD大鼠108只, ♂, 周龄6 wk, 购自佐贺大学动物中心, 体质量约200 g, 饲养环境为日本佐贺大学医学部动物中心SPF实验室, 室温24 ℃±2 ℃, 相对湿度55%±5%, 每12 h进行一次亮/暗循环, 饲料、水均不受限. 动物饲料由日本武田生物株式会社提供. 氧化偶氮甲烷(azoxymethane, AOM)购自Sigma日本公司. 细胞增殖检测试剂盒购自英国Amersham公司. 莫苯唑酸由日本田辺三菱制药株式会社赠送. SZH10立体显微镜购自奥林巴斯公司. 兔抗β-catenin单克隆抗体购自美国Cell Signaling公司.
1.2.1 分组及饲养: (1)ACF诱导: 36只大鼠随机分为3组, 即常规饲料组, 10%牛脂组, 20%牛脂组, 每组再分为单纯饲料组(对照组), 单纯饲料+0.12%莫苯唑酸(莫苯唑酸组)2个亚组. 各组大鼠第7, 8周龄时分别腹腔注射AOM 1次, 共2次, 剂量为15 mg/kg. 第1次AOM注射后次日起, 各组予以相应饲料12 wk. (2)肿瘤诱导: 72只大鼠随机分为生理盐水、AOM注射2组, 每组再分为10%牛脂组, 10%牛脂+0.12%莫苯唑酸两个亚组, 注射流程同前, 各组予以相应饲料44 wk.
1.2.2 ACF计数: 实验开始后第12周, 过量麻醉处死ACF诱导大鼠后取出结肠, 沿肠系膜对侧纵轴剪开, 暴露内腔后固定于40 g/L甲醛24 h, 0.2%亚甲蓝甲醛溶液染色5 min, 生理盐水冲洗后SZH10立体显微镜下ACF计数.
1.2.3 肿瘤数量及发病率: 实验第44周时, 过量麻醉处死肿瘤诱导大鼠后取结肠组织, 于40 g/L甲醛固定, 计算肿瘤数量及发病率.
1.2.4 BrdU评估瘤体周围外观正常黏膜的增殖状况: 使用细胞增殖检测试剂盒BrdU结合法, 即第2次注射AOM后第44周时, 大鼠腹腔注射BrdU标记溶液10 mL/kg体质量, 2 h后取大鼠结肠. 标本按照佐贺大学医学部免疫组织化学常规流程处理. 40 g/L甲醛固定, 石蜡包埋并切片. 采用DBA显色、苏木紫复染两步法, 检测结肠隐窝增殖细胞的数量和分布. 分别依次加入一、二抗体[6]. 所有操作均按试剂盒说明书提供的浓度和流程进行.
1.2.5 收集结肠黏膜及提取蛋白: 使用玻片轻而快速的刮取结肠黏膜, PBS液离心清洗2次. 刮取黏膜加入裂解液匀浆后, 1 000 g, 10 min离心, 而后以10 000 g、15 min, 1 000 000 g、1 h的条件分别依次离心上清液, 最终收集的上清液为胞质蛋白[6].
1.2.6 Western blot检测胞质β-catenin的表达: 蛋白上样量40 µg, 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转移至PVDF膜(美国Bio-Rad公司). 5%牛奶PBST液(Tween-20, 美国Sigma公司)4 ℃封闭过夜. 兔抗β-catenin单克隆抗体, 工作浓度为1:500, β-actin为内参, 室温下孵育1 h. 辣根过氧化物酶标记猴抗兔IgG(美国Affinity BioReagent公司)二抗室温孵育1 h, 工作浓度为1:500. ECL(英国Amersham公司)化学发光试剂盒检测杂交信号. 使用Image Gauge VDS图像分析仪测定条带的光密度(日本Fujifilm公司), 以β-catenin/β-actin值代表蛋白的相对表达量.
统计学处理 使用SPSS11.5统计软件, 所得数值均以means±SD表示. 采用独立样本t检验或方差分析LSD法; 发病率以百分比表示, 使用χ2检验分析. P<0.05有统计学意义.
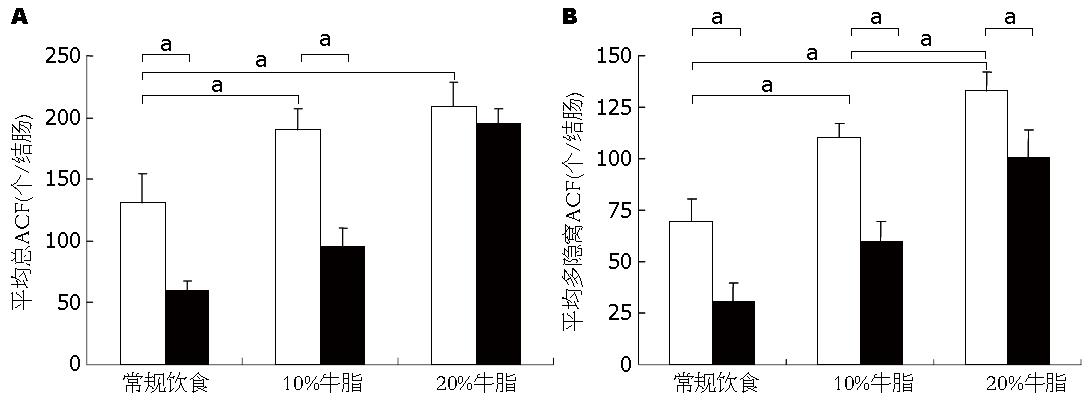
牛油饮食可增加经AOM处理大鼠ACF数量, 多隐窝ACF数量与牛油呈剂量依赖关系, 莫苯唑酸可显著降低ACF的数量(P<0.05, 图1). 对多隐窝ACF, 其抑制作用非常显著(图1B). 44 wk时, 肿瘤仅发生于AOM处理组, 莫苯唑酸组发病率及平均肿瘤数量分别为66.7%、2.5±2.3, 显著低于对照组的100%、5.3±1.2(P<0.05, 表1).
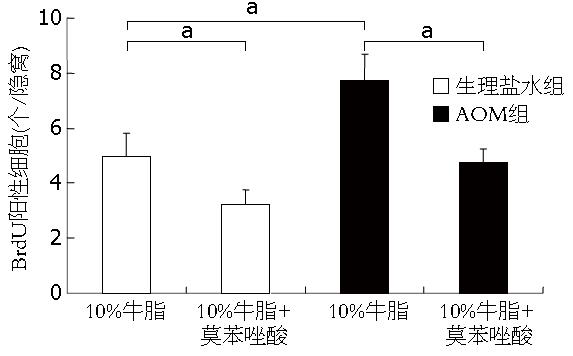
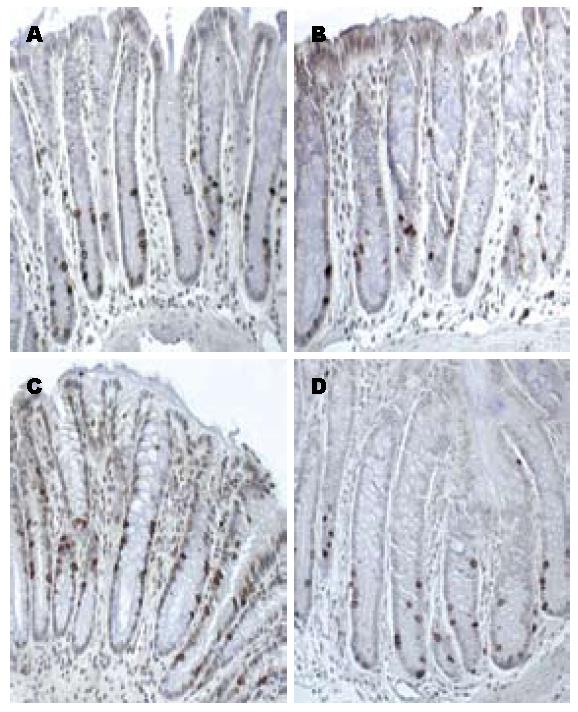
生理盐水组中, 单纯牛油组与莫苯唑酸组BrdU阳性细胞分别为5.00±0.82、3.25±0.50; AOM处理组中, 牛油组与莫苯唑酸组BrdU阳性细胞则分别为7.75±0.96、4.75±0.50(图2). 生理盐水组大鼠BrdU阳性细胞由隐窝底部向开口分布(图3A), AOM处理组多在隐窝中上部广泛分布(图3C); 经莫苯唑酸处理两组BrdU阳性细胞则多限于隐窝的下部与基底部(图3B, D).
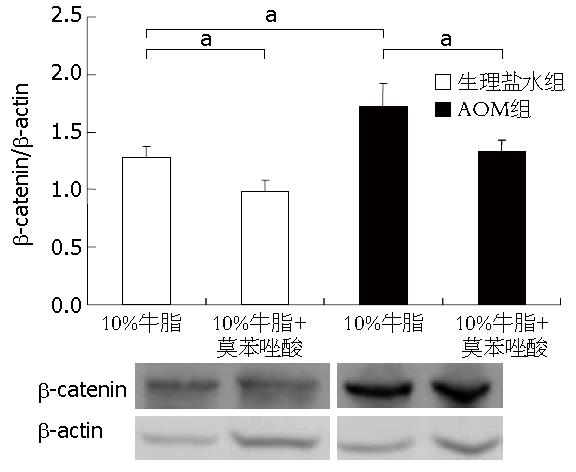
AOM处理可提高β-catenin的表达水平, 莫苯唑酸处理两组β-catenin均低于各自对照组(P<0.05, 图4).
尽管结肠癌具有高发病率和高死亡率的特点, 但由正常结肠隐窝转变为腺瘤、腺癌瘤通常需要10-20年, 因此在结肠癌发生前尚有相当长的窗口期, 这为结肠癌的有效预防提供了条件[22].
我们以往的研究证实, 10%牛脂可增加经AOM处理大鼠的结肠癌发生[6]. COX-1在机体广泛表达, 具有看家基因的功能[13], 目前对其在肿瘤发生中作用的研究尚不多. 有研究表明, 结肠肿瘤组织内PGE2的含量明显高于其周边正常组织, 而COX-1及COX-2共同参与了PGE2的合成[14]. 在Min-/+小鼠模型中, COX-1基因敲除可减少约80%息肉的发生[14]. 这都表明, COX-1在结肠肿瘤发生中可能具有重要作用. 对于COX-1选择性抑制剂如莫苯唑酸能否抑制高脂饮食促进的结肠癌发生, 本实验尚属首次. 本研究中12 wk时, 莫苯唑酸可有效抑制ACF的发生. 44 wk时, 莫苯唑酸可显著降低结肠肿瘤的发病率及数量. 这些数据显示, 莫苯唑酸在此模型中具有良好的肿瘤抑制作用. 有研究表明, n-6多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)及不饱和脂肪酸(saturated fatty acid, SFA)可在结肠癌始发后和/或加速期发挥促肿瘤作用[4,5,23,24]. 我们的数据表明, COX-1在早晚期均参与了结肠癌的发生, 这一结果与目前已有研究一致[14,25].
肿瘤通常具有过度增殖的异常分化细胞的特点. 结肠隐窝细胞增殖失调被认为是结肠癌变的最早事件之一, 如散发型结肠腺瘤[26]. 目前已有研究主要集中在肿瘤组织上, 由于早期病变及肿瘤多由正常黏膜转变而来, 因此, 对瘤体周围正常黏膜的研究可能揭示这一演变过程. 我们先前曾证实, 不同的脂肪酸对结肠隐窝增殖细胞的数量及空间分布具有不同的影响[6]. 本研究中, 长期给予牛油的大鼠, 结肠增殖细胞在隐窝中呈由底部向上散在分布, 而经AOM处理大鼠增殖细胞则多分布于隐窝中部以上. 这显示出牛脂饮食大鼠尤其是AOM处理后其结肠隐窝具有较强的增殖能力. 有研究表明, COX-1在保护结肠干细胞免受γ射线损伤中具有重要作用[27]. 被强致癌剂AOM损伤DNA的干细胞可通过COX-1来源PGE2而存活[28]. 上述两者均可产生基因损伤干细胞, 从而导致结肠癌发生[27,28]. 本实验中, 莫苯唑酸可显著减少增殖细胞数量, 并使其局限于隐窝底部, 这一分布与生理情况下相似[29]. 最近, Wu等[30]的体外实验证实, COX-1抑制剂sc-560可降低结肠细胞增殖使细胞停滞于G0/G1期, 并诱导巨细胞自噬. 可见, 作为COX-1选择性抑制剂, 莫苯唑酸似乎具有减少异常增殖细胞的能力, 从而防止其进一步发展导致结肠癌发生.
β-catenin信号通路在结肠隐窝的自我更新及干细胞转化为各细胞株的过程中有极为重要的作用[18,19]. 其信号失调可见于各种肿瘤患者, 如散发型结肠癌[21]. β-catenin在胞质内聚集后进入细胞核, 进而活化肿瘤相关基因如c-Myc、cyclin D1等, 导致肿瘤发生. 由β-catenin, GSK-3β, Axin及Apc组成的β-catenin降解复合物可在胞质降解β-catenin, 避免其在胞质内聚集并向细胞核内转移[6,21]. 近年来有研究证实, β-catenin降解复合物与COX/PGE2通路有交联性[31], PGE2可通过此复合物阻止β-catenin的降解. 作为COX-1抑制剂, 这可能部分解释莫苯唑酸抑制β-catenin表达的作用.
尽管COX-1选择性抑制剂对结肠癌具有良好的预防作用, 其消化系统不良反应, 如胃溃疡, 胃肠道出血等仍是值得注意的问题. 有文献报道, COX-1基因敲除鼠并没有消化系损伤表现, 甚至寿命更长[14]. 也有报道称在COX-1与COX-2同时抑制的情况下, 胃肠道损伤才会出现[32]. 以本实验中莫苯唑酸的使用剂量, 我们尚未观察到胃肠道损伤表现. 但对此药物的长期安全性尚有待进一步研究.
总之, 长期摄入COX-1选择性抑制莫苯唑酸对牛脂饮食大鼠的结肠肿瘤发生具有良好的抑制作用. 隐窝增殖细胞及β-catenin表达的抑制可能参与了这一过程. 对于高脂饮食人群而言, 莫苯唑酸可能是一种化学预防结肠癌的潜在药物.
结肠癌是目前威胁人类健康的主要肿瘤之一, 在欧美等高饱和脂肪酸饮食习惯国家发病率较高. 多种研究表明, 脂类可通过各种途径对结肠癌发生产生影响. 本课题组先前研究表明, 牛脂饮食可促进化学诱导大鼠结肠癌发生. 牛脂饮食大鼠结肠上皮具有高增殖、低凋亡表现, 肿瘤相关蛋白如Wnt/β-catenin、cyclin D1有高表达. 在中国, 由于饮食习惯向西方国家靠拢, 结肠癌发病率增长迅速. 因此在高脂饮食人群中开展结肠肿瘤化学预防有积极意义.
樊晓明, 主任医师, 复旦大学附属金山医院消化科.
COX-1在机体广泛表达, 具有看家基因的功能, 目前对其在肿瘤发生中作用的研究尚不多.
Niho等报道COX-1抑制剂可显著降低化学诱导大鼠结肠肿瘤的发病率, 数量及体积.
本研究首次提出COX-1抑制剂莫苯唑酸可抑制高脂饮食促进的结肠癌发生, 为在高脂饮食人群中开展结肠癌的化学预防提供了实验依据.
莫苯唑酸在临床上应用多年, 尚未有严重不良反应报告, 具有较好的临床应用前景.
本文对用COX-1选择性抑制剂用于结肠癌的化学预防提供了实验依据, 具有较好的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 2. | Willett WC, Stampfer MJ, Colditz GA, Rosner BA, Speizer FE. Relation of meat, fat, and fiber intake to the risk of colon cancer in a prospective study among women. N Engl J Med. 1990;323:1664-1672. [PubMed] [DOI] |
| 3. | Meyerhardt JA, Niedzwiecki D, Hollis D, Saltz LB, Hu FB, Mayer RJ, Nelson H, Whittom R, Hantel A, Thomas J. Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer. JAMA. 2007;298:754-764. [PubMed] [DOI] |
| 4. | Bird RP, Yao K, Lasko CM, Good CK. Inability of low- or high-fat diet to modulate late stages of colon carcinogenesis in Sprague-Dawley rats. Cancer Res. 1996;56:2896-2899. [PubMed] |
| 5. | Singh J, Hamid R, Reddy BS. Dietary fat and colon cancer: modulation of cyclooxygenase-2 by types and amount of dietary fat during the postinitiation stage of colon carcinogenesis. Cancer Res. 1997;57:3465-3470. [PubMed] |
| 6. | Fujise T, Iwakiri R, Kakimoto T, Shiraishi R, Sakata Y, Wu B, Tsunada S, Ootani A, Fujimoto K. Long-term feeding of various fat diets modulates azoxymethane-induced colon carcinogenesis through Wnt/beta-catenin signaling in rats. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1150-G1156. [PubMed] [DOI] |
| 7. | Flossmann E, Rothwell PM. Effect of aspirin on long-term risk of colorectal cancer: consistent evidence from randomised and observational studies. Lancet. 2007;369:1603-1613. [PubMed] [DOI] |
| 9. | Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell. 1998;93:705-716. [PubMed] [DOI] |
| 10. | Tsujii M, Kawano S, DuBois RN. Cyclooxygenase-2 expression in human colon cancer cells increases metastatic potential. Proc Natl Acad Sci U S A. 1997;94:3336-3340. [PubMed] [DOI] |
| 11. | Baron JA, Sandler RS, Bresalier RS, Lanas A, Morton DG, Riddell R, Iverson ER, Demets DL. Cardiovascular events associated with rofecoxib: final analysis of the APPROVe trial. Lancet. 2008;372:1756-1764. [PubMed] [DOI] |
| 12. | Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA. 2001;286:954-959. [PubMed] [DOI] |
| 13. | Vane JR, Bakhle YS, Botting RM. Cyclooxygenases 1 and 2. Annu Rev Pharmacol Toxicol. 1998;38:97-120. [PubMed] [DOI] |
| 14. | Chulada PC, Thompson MB, Mahler JF, Doyle CM, Gaul BW, Lee C, Tiano HF, Morham SG, Smithies O, Langenbach R. Genetic disruption of Ptgs-1, as well as Ptgs-2, reduces intestinal tumorigenesis in Min mice. Cancer Res. 2000;60:4705-4708. [PubMed] |
| 15. | Takayama T, Katsuki S, Takahashi Y, Ohi M, Nojiri S, Sakamaki S, Kato J, Kogawa K, Miyake H, Niitsu Y. Aberrant crypt foci of the colon as precursors of adenoma and cancer. N Engl J Med. 1998;339:1277-1284. [PubMed] [DOI] |
| 16. | Groden J, Thliveris A, Samowitz W, Carlson M, Gelbert L, Albertsen H, Joslyn G, Stevens J, Spirio L, Robertson M. Identification and characterization of the familial adenomatous polyposis coli gene. Cell. 1991;66:589-600. [PubMed] [DOI] |
| 17. | Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell. 1996;87:159-170. [PubMed] [DOI] |
| 18. | Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006;127:469-480. [PubMed] [DOI] |
| 19. | Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 2008;8:387-398. [PubMed] [DOI] |
| 20. | Morin PJ, Sparks AB, Korinek V, Barker N, Clevers H, Vogelstein B, Kinzler KW. Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC. Science. 1997;275:1787-1790. [PubMed] [DOI] |
| 21. | Su Y, Fu C, Ishikawa S, Stella A, Kojima M, Shitoh K, Schreiber EM, Day BW, Liu B. APC is essential for targeting phosphorylated beta-catenin to the SCFbeta-TrCP ubiquitin ligase. Mol Cell. 2008;32:652-661. [PubMed] [DOI] |
| 22. | Winawer SJ. The multidisciplinary management of gastrointestinal cancer. Colorectal cancer screening. Best Pract Res Clin Gastroenterol. 2007;21:1031-1048. [PubMed] [DOI] |
| 23. | Wu B, Iwakiri R, Ootani A, Tsunada S, Fujise T, Sakata Y, Sakata H, Toda S, Fujimoto K. Dietary corn oil promotes colon cancer by inhibiting mitochondria-dependent apoptosis in azoxymethane-treated rats. Exp Biol Med (Maywood). 2004;229:1017-1025. [PubMed] |
| 24. | Rao CV, Hirose Y, Indranie C, Reddy BS. Modulation of experimental colon tumorigenesis by types and amounts of dietary fatty acids. Cancer Res. 2001;61:1927-1933. [PubMed] |
| 25. | Takeda H, Sonoshita M, Oshima H, Sugihara K, Chulada PC, Langenbach R, Oshima M, Taketo MM. Cooperation of cyclooxygenase 1 and cyclooxygenase 2 in intestinal polyposis. Cancer Res. 2003;63:4872-4877. [PubMed] |
| 26. | Wong WM, Mandir N, Goodlad RA, Wong BC, Garcia SB, Lam SK, Wright NA. Histogenesis of human colorectal adenomas and hyperplastic polyps: the role of cell proliferation and crypt fission. Gut. 2002;50:212-217. [PubMed] [DOI] |
| 27. | Cohn SM, Schloemann S, Tessner T, Seibert K, Stenson WF. Crypt stem cell survival in the mouse intestinal epithelium is regulated by prostaglandins synthesized through cyclooxygenase-1. J Clin Invest. 1997;99:1367-1379. [PubMed] [DOI] |
| 28. | Riehl TE, George RJ, Sturmoski MA, May R, Dieckgraefe B, Anant S, Houchen CW. Azoxymethane protects intestinal stem cells and reduces crypt epithelial mitosis through a COX-1-dependent mechanism. Am J Physiol Gastrointest Liver Physiol. 2006;291:G1062-G1070. [PubMed] [DOI] |
| 29. | Potten CS. Stem cells in gastrointestinal epithelium: numbers, characteristics and death. Philos Trans R Soc Lond B Biol Sci. 1998;353:821-830. [PubMed] [DOI] |
| 30. | Wu WK, Sung JJ, Wu YC, Li HT, Yu L, Li ZJ, Cho CH. Inhibition of cyclooxygenase-1 lowers proliferation and induces macroautophagy in colon cancer cells. Biochem Biophys Res Commun. 2009;382:79-84. [PubMed] [DOI] |
| 31. | Castellone MD, Teramoto H, Williams BO, Druey KM, Gutkind JS. Prostaglandin E2 promotes colon cancer cell growth through a Gs-axin-beta-catenin signaling axis. Science. 2005;310:1504-1510. [PubMed] [DOI] |
| 32. | Tanaka A, Araki H, Komoike Y, Hase S, Takeuchi K. Inhibition of both COX-1 and COX-2 is required for development of gastric damage in response to nonsteroidal antiinflammatory drugs. J Physiol Paris. 2001;95:21-27. [PubMed] [DOI] |