修回日期: 2010-04-29
接受日期: 2010-05-10
在线出版日期: 2010-06-08
目的: 观察体外大鼠骨髓间充质干细胞(BMSCs)共培养对肝星状细胞(HSCs)增殖、凋亡和RohA表达的影响, 探讨BMSCs旁分泌HGF在其中的作用机制.
方法: 贴壁筛选法培养、纯化SD大鼠BMSCs, 传代至第4代使用; 大鼠肝星状细胞(HSC-T6)系及纤维原细胞系冻融后传代使用. 应用6孔塑料细胞培养盒, 每孔使用半透膜(transwell insert)建立上下双层细胞共培养体系, 常规培养. 实验分4组: 空白对照组、阴性对照组、BMSCs实验组、预处理实验组(c-met多克隆抗体预处理). 用四甲基偶氮唑蓝(MTT)法检测HSCs细胞增殖能力; 流式细胞仪检测细胞凋亡; RT-PCR、Western blot检测BMSCs与HSCs共培养后HSCs内RohA mRNA和蛋白的表达. 酶联免疫吸附法(ELISA)检测BMSCs与HSCs共培养上清液中肝细胞生长因子(HGF)浓度.
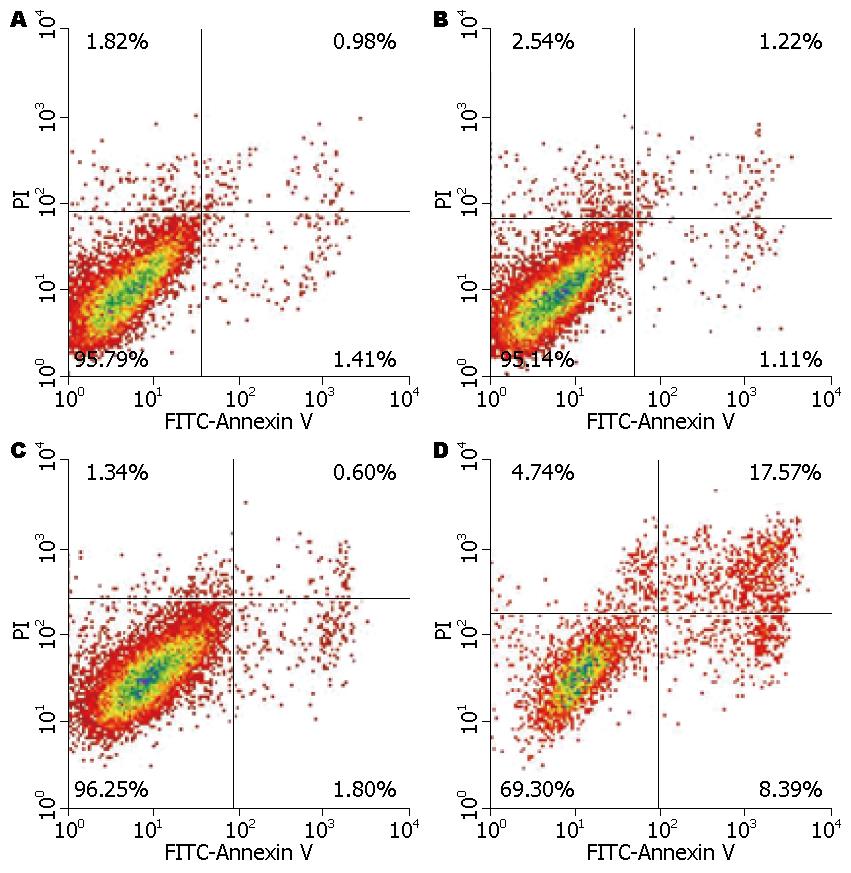
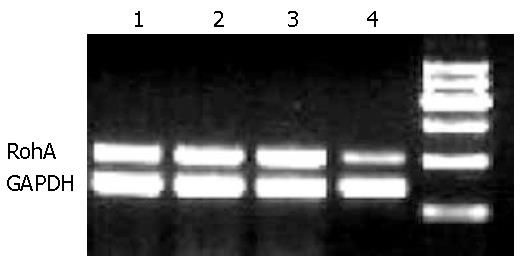
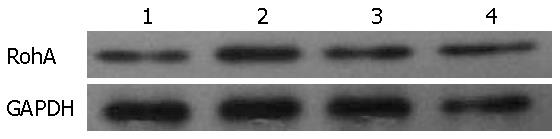
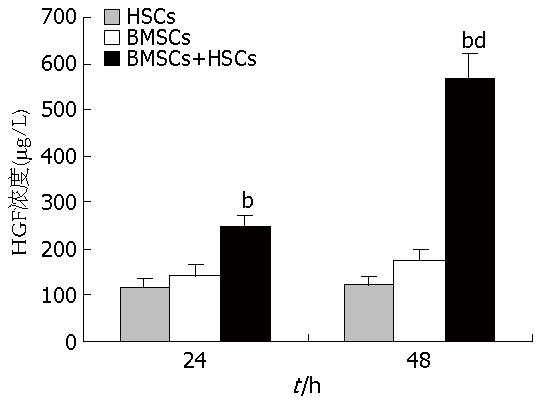
结果: BMSCs对HSCs增殖具有抑制作用, BMSCs与HSCs共培养后24 h、48 h的增殖抑制率分别为12.21%, 35.43%, 与空白对照组、实验对照组和C-met抗体预处理组比较有显著性差异(P<0.01). Annexin-V-FITC/PI双染法检测BMSCs与HSCs共培养48 h后HSCs的凋亡率为25.80%, 与空白对照组、实验对照组与c-met抗体预处理组比较有显著性差异(P<0.01). BMSCs与HSCs共培养48 h, BMSCs组RohA mRNA的表达抑制明显, 且显著低于空白对照组、实验对照组与C-met抗体预处理组, 有显著性差异(P<0.01). BMSCs与HSCs共培养48 h RohA蛋白的表达明显抑制, 且显著低于空白对照组、实验对照组与C-met抗体预处理组, 有显著性差异(P<0.01). ELISA检测BMSCs与HSCs共培养24 h、48 h上清液中HGF浓度分别为250 ng/L与570 ng/L, 明显高于单独BMSCs培养和单独HSCs培养, 有显著性差异(P<0.01).
结论: BMSCs与HSCs共培养能抑制HSCs的增殖, 促进凋亡, 抑制RohA表达, 其机制可能是通过BMSCs旁分泌HGF发挥抑制大鼠HSCs增殖, 促进凋亡的作用.
引文著录: 陈国忠, 姜海行, 陆正峰, 肖健, 梁梓宇, 覃山羽. 骨髓间充质干细胞共培养对肝星状细胞增殖、凋亡和RohA表达的调控. 世界华人消化杂志 2010; 18(16): 1643-1649
Revised: April 29, 2010
Accepted: May 10, 2010
Published online: June 8, 2010
AIM: To observe the regulatory effects of bone marrow mesenchymal stem cells (BMSCs) on cell proliferation and apoptosis and RohA expression in rat hepatic stellate cells (HSCs) and to explore the possible mechanisms involved.
METHODS: BMSCs were isolated from Sprague-Dawley rats, cultured and purified in vitro. Activated HSCs were cultured on plastic plates. A co-culture system was established by culturing BMSCs in the Transwell insert and HSCs on the plastic plates (6 wells). Normal rat fibroblasts, BMSCs and HSCs were cultured alone as controls. A part of cells were pretreated with rabbit polyclonal anti-c-met antibody according to experimental needs. Cell proliferation and apoptosis were determined by MTT assay and flow cytometry, respectively. The expression of RohA mRNA and protein in HSCs was determined by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. Cell supernatants were harvested to determine the concentration of hepatocyte growth factor (HGF) by enzyme-linked immunosorbent assay (ELISA).
RESULTS: BMSCs inhibited the proliferation of HSCs. After 24 h and 48 h of co-culture, the reduced rates of HSC proliferation were 12.21% and 35.43%, respectively. The reduced rates of HSC proliferation in the experimental group were significantly higher than those in the other three groups (all P < 0.01). The apoptosis rate of HSCs at 48 h was 25.80% in the experimental group, significantly higher than those in the other three groups (all P < 0.01). After 48 h of co-culture, BMSCs significantly inhibited the expression of RohA mRNA and protein in HSCs when compared with the other three groups (all P < 0.01). The concentrations of HGF in co-culture supernatants in the experimental group at 24 and 48 h were 250 ng/L and 570 ng/L, respectively, significantly higher than those in the supernatants of BMSCs and HSCs cultured alone (all P < 0.01).
CONCLUSION: BMSCs inhibit proliferation, promote apoptosis and reduce RohA expression in rat activated HSCs perhaps in an HGF paracrine-dependent manner.
- Citation: Chen GZ, Jiang HX, Lu ZF, Xiao J, Liang ZY, Qin SY. Bone marrow mesenchymal stem cells modulate cell proliferation and apoptosis and RohA expression in rat hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2010; 18(16): 1643-1649
- URL: https://www.wjgnet.com/1009-3079/full/v18/i16/1643.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i16.1643
肝纤维化是肝硬化发展的必然阶段, 肝纤维化原认为是不可逆转[1,2], 但近些年的研究表明肝纤维化是可逆的[3,4]. 星状细胞激活后造成胶原纤维和细胞外基质大量增生沉积, 最终导致肝纤维化和肝硬化. 因此肝星状细胞(hepatic stellate cells, HSCs)激活是肝纤维化的中枢事件. 星状细胞的增殖和凋亡受到多种因素的影响, 多个信号通路参与其中[5-8]. 诱导和促进活化的星状细胞凋亡是治疗肝纤维化的关键. 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)有多分化的潜能. 多个研究表明, BMSCs对多种原因引起的肝损伤具有显著修复作用, 可改善甚至逆转肝纤维化[3,9,10], 但其具体的机制还不清楚. 本研究观察BMSCs对HSCs增殖、凋亡和RohA蛋白表达的影响及BMSCs旁分泌肝细胞生长因子(hepatocyte growth factor, HGF)在其中的作用机制.
健康SD大鼠6只, 周龄6-8 wk, 由广西医科大学实验动物中心提供. 肝星状细胞系(HSC-T6)及纤维原细胞系(由中山大学附属肿瘤医院细胞库提供); DMEM-LG培养液(购于美国Gibco公司); 特级胎牛血清(购于美国Hyclone公司); MTT试剂盒(武汉谷歌生物科技有限公司); 肝细胞生长因子ELISA试剂盒(美国R&D system公司); 小鼠抗RohA单克隆抗体(美国Santa Cruz公司); 兔抗c-met多克隆抗体(武汉博士德公司); HRP标记的山羊抗小鼠IgG(美国Santa Cruz公司); TRIzol(美国Invitrogen公司); 逆转录试剂盒(美国MBI公司); ECL发光试剂盒(美国Thermo公司); PVDF膜(美国Millipore公司); Transwell insert半透膜(美国Corning Costar公司).
1.2.1 BMSCs的分离、培养与功能鉴定: 按文献[11,12]方法在无菌条件下分离SD大鼠股骨骨髓细胞, 于37 ℃、饱和湿度、50 mL/L CO2培养箱中培养, 利用BMSCs与其他贴壁细胞的贴壁差异性严格控制传代时胰酶的量和消化时间, 传代纯化BMSCs, 显微镜下观察细胞形态. 取第4代细胞(Passge 4, P4), 2.5 g/L胰酶消化, 调整细胞浓度1×105/cm2接种于50 mL一次性培养瓶中, 备实验用. 取第4代细胞, 置于37 ℃、饱和湿度、50 mL/L CO2培养箱中培养, 每2 d换液1次, 连续培养14 d, 倒置相差显微镜下观察细胞形态.
1.2.2 HSC-T6的培养、传代与活化鉴定: 大鼠HSC-T6系冻融后传代使用. 于L-DMEM培养液(含100 mL/L胎牛血清)、37 ℃, 50 mL/L CO2培养箱中培养, 8 h即可贴壁生长, 2-3 d后细胞80%-90%铺满瓶底即可再次传代, 传至3-4代细胞生长活跃, 增殖明显可用于实验. 采用免疫组织化学法检测α-SMA表达. 倒置相差显微镜下观察活体细胞形态学改变.
1.2.3 纤维原细胞的培养、传代: 纤维原细胞系冻融后传代使用方法同上.
1.2.4 细胞共培养: 参照文献[13,14]方法应用6孔塑料细胞培养盒, 在半透膜(Transwell insert)上层接种BMSCs或纤维原细胞(1×105 cells/well), 在下层接种HSC-T6细胞(1×105 cells/well), 建立上下双层细胞共培养体系, 常规培养. 实验分组: (1)空白对照组: HSCs单独培养(其上层只含培养基); (2)阴性对照组: HSCs与纤维原细胞共培养; (3)实验组: BMSCs与HSCs共培养; (4)c-met预处理组: 兔抗c-met多克隆抗体500 μg/L预先封闭HSCs表面HGF受体6 h后, BMSCs与HSCs共培养. 培养48 h后倒置相差显微镜下动态观察活体细胞形态学改变.
1.2.5 MTT法检测HSCs增殖抑制率: 细胞共培养0、24、48 h后用0.25%胰酶消化贴壁细胞,细胞计数板计数, 调整各时段细胞浓度为1×105/mL, 吹打, 混匀, 取96孔板, 每孔加入100 μL(2 000个细胞), 每时段设3个复孔, 设立空白孔, 加入100 μL无细胞的完全培养基. , 置于37 ℃、50 mL/L CO2温箱中培养48 h后每孔加MTT溶液(5 g/L)20 μL,继续孵育4 h, 终止培养, 弃去培养液, 每孔加二甲基亚砜(DMSO)150 μL, 避光振荡10 min, 使蓝色结晶物充分溶解. 选择490 nm波长测定各孔吸光值, 以仅加入MTT溶液处理的空白孔为对照, 在酶联免疫监测仪上比色测定并记录各孔光吸收值(A值). 细胞生长抑制率 = (1-实验组A值/对照组A值)×100%.
1.2.6 ELISA检测共培养上清液HGF浓度: 除空白孔外, 分别将上清液及不同浓度标准品(100 μL/孔)加入相应孔中, 37 ℃孵箱孵育90 min; 手工洗板5次; 加入生物素化抗体工作液(100 μL/孔), 37 ℃孵箱孵育60 min; 手工洗板4次; 加入酶结合物工作液(100 μL/孔), 37 ℃孵箱孵育30 min; 手工洗板5次; 加入显色剂100 μL/孔, 避光37 ℃孵育15-20 min; 加入终止液100 μL/孔, 混匀, 即刻用酶标仪(取主波长450 nm, 辅助波长630 nm)测量A450值(5 min内).
1.2.7 流式细胞仪检测细胞凋亡: Annexin-V-FITC/PI双染法收集各组HSCs, 计数, 按照Annexin-V-FITC/P细胞凋亡试剂盒说明操作.
1.2.8 HSCs总RNA提取和RT-PCR: 收集48 h时段HSCs计数, 每5×106个细胞加1 mL的TRIzol, 振动机振荡混匀. TRIzol一步抽提法提取总RNA. 按逆转录试剂盒说明进行逆转录, 并根据以下条件进行目的基因的扩增: 95 ℃预变性5 min进入循环, 95 ℃变性45 s, 55 ℃退火45 s, 72 ℃ 1 min, 共35个循环后, 72 ℃延伸5 min, 以GAPDH为内参照. 扩增引物由上海生工生物工程公司合成. RohA的上游引物5'-TGGTGATGGAGCTTGTGGTAAG-3', 下游引物5'-AACATCAGTGTCTGGGTAGGAG-3'; GAPDH上游引物: 5'-GCCAGTAGACTCCACGACAT-3', 下游引物5'-GCAAGTTCAACGGCACAG-3'. 取 6 μL PCR产物及6 μL DNA Marker进行1.7%琼脂糖凝胶电泳, 采用凝胶图像分析仪进行吸光度扫描, 观察条带的灰度强弱, 以RohA基因/GAPDH的灰度比值表示相对目的基因mRNA水平.
1.2.9 HSCs总蛋白提取和Western blot检测: 用细胞裂解液提取48 h时段HSCs总蛋白, 考马斯亮蓝比色法测定蛋白含量, 上样量为80 μg, 蛋白进行15% SDS-PAGE凝胶电泳, PVDF转膜, 非特异性封闭; 加入一抗小鼠抗RohA(1:500稀释), 4 ℃过夜, 加入辣根过氧化物酶标记的二抗进行杂交. ECL发光剂1-5 min, 曝光、显影、定影. 数码成像分析系统软件对结果进行分析, 以RohA蛋白/GAPDH的灰度比值表示相对目的蛋白水平.
统计学处理 数据资料以mean±SD表示应用统计软件SPSS13.0进行分析, 以P<0.05为有统计学差异, P<0.01为有显著性差异.
用MTT法检测了共培养0、24、48 h时间段BMSCs对HSCs细胞增殖的影响, 24、48 h的HSCs增值抑制率分别为12.21%±2.55%、35.43%±6.17%. BMSCs在24 h已抑制大鼠HSCs的增殖, 48 h明显抑制大鼠HSCs的增殖并呈现时间依赖性, 与对照组和c-met抗体预处理组比较有显著性差异(P<0.01, 表1).
BMSCs与HSCs共培养后, 采用流式细胞仪Annexin V-FITC/PI双染法检测BMSCs与HSCs共培养48 h后HSCs的凋亡率(图1), 空白对照组凋亡率为2.30%±0.31%、实验对照组为2.25%±0.18%、BMSCs组为25.80%±3.60%、c-met抗体预处理组为2.40%±0.22%. BMSCs组与c-met预处理组、空白对照组和阴性对照组比较有显著性差异(P<0.01, 图1).
BMSCs与HSCs共培养后HSCs RohA mRNA的表达, 空白对照组为0.98±0.05、实验对照组为0.96±0.03、BMSCs组为0.40±0.03、c-met抗体预处理组为1.01±0.06. BMSCs组共培养48 h时表达量明显低于空白对照组、实验对照组与c-met预处理组, 与上述3组比较有显著性差异(P<0.01, 图2).
BMSCs与HSCs共培养后HSCs RohA蛋白的表达, 空白对照组为1.06±0.13、实验对照组为1.09±0.11、BMSCs组为0.43±0.05、c-met抗体预处理组为1.12±0.15. BMSCs组共培养48 h时表达量明显低于空白对照组、实验对照组与c-met预处理组(图2), BMSCs组与其他3组比较有显著性差异(P<0.01, 图3).
为明确BMSCs旁分泌HGF, 对BMSCs与HSCs共培养、单独BMSCs、单独HSCs共培养体系24、48 h时间段上清液中HGF浓度进行检测, 共培养组HGF浓度明显高于单独BMSCs培养和单独HSCs培养, 有显著性差异(P<0.01); BMSCs与HSCs共培养组48 h与其自身24h时段比较, 有显著性差异(P<0.01, 图4).
HSCs是肝窦周间质细胞, 肝脏慢性损伤时, HSCs受到多种细胞因子[3,8,15], 如转换生长因子β1(transforming growth factor-β1, TGF-β1)等刺激而活化, 增殖加速, 大量合成细胞外基质(extracellular matrix, ECM)并沉积在肝内, 并通过产生基质金属蛋白酶抑制因子, 抑制ECM的降解, 导致肝内ECM合成和降解失去平衡, 最终导致肝纤维化和肝硬化形成. 促进激活的HSCs凋亡是治疗或逆转肝纤维化的重要手段. BMSCs移植治疗肝纤维化目前还处在临床前的研究, 多项研究表明[9,11,16,17], BMSCs移植能抑制肝内细胞炎症, BMSCs转化为肝样细胞, 可改善肝功能, 减轻或逆转肝纤维化, 显示了不错的治疗效果, 但其机制尚不清楚.
大量研究证实肝纤维化过程伴随Rho信号通路的激活与上调, 阻断或抑制Rho-Kinase能有效减缓乃至逆转许多组织的纤维化发展进程[7,18-20]. Rho/ROCK信号通路可作为" 分子开关", 通过多重级联反应、与其他信号通路的" 交谈"并通过其下游通路介导多种信号转导, 产生多种细胞效应. 我们前期研究[16]发现, Rho-ROCK信号转导通路参与CCl4导致的急性肝损伤发生、发展和修复全过程, BMSCs可能通过抑制RohA-ROCK信号转导通路加速受损肝脏修复.
为探讨BMSCs是否能够调控HSCs增殖、凋亡和RohA表达, 我们用活化的肝星状细胞系, 模拟体内肝纤维化的状态. 利用孔径0.4 μm的Transwell仅透过培养液而不能通过细胞的特点, BMSCs与HSCs共培养, 采用1:1比例, 建立BMSCs与HSCs非直接接触的共培养体系. 结果表明在共培养体系中, BMSCs通过非接触抑制HSCs增殖, 促进HSCs凋亡, RohA信号表达明显受到抑制. 鉴于共培养中72 h HSCs死亡率较高, 而我们实验中途不更换新鲜培养基, 原有培养基较难维持细胞72 h生长, 选择48 h时间段实验结果能更好反映实验真实状况, 因此我们实验选取的共培养时间段为48 h, 细胞接种密度调整为1×105, 与Parekkadan等[13]研究相似. 也有研究[6,21]报道共培养时间是72 h, 但接种密度为1×104或2×104. 虽然上述几个研究接种密度和培养时间不同, 但各个研究得出的结果较一致.
BMSCs能分泌多种细胞因子[13,22], 如HGF、神经细胞生长因子(nerve growth factor, NGF)、胰岛素样生长因子1(insulin-like growth factor, IGF-1)、转化生长因子(transforming growth factor, TGF)和白介素、干细胞因子. 活化的HSCs也分泌多种细胞因子[13,23,24]. HGF是由间皮细胞分泌的生长因子, 对细胞的生长、增殖起着重要作用[25,26]在肿瘤增殖、转移中也起着重要作用[27]. HGF对活化的肝星状细胞有抑制、促进凋亡作用[28,29]. HGF功能的发挥, 需要和靶细胞表面的c-met受体结合后才能发挥其作用[30], HGF/c-met信号通路是HGF功能发挥的途径.
BMSCs在共培养体系中对活化的星状细胞有抑制增殖、促进凋亡和下调RohA表达的作用, 我们推测BMSCs旁分泌的HGF发挥了重要作用. 为此我们检测了24、48 h时间段BMSCs和HSCs共培养体系、BMSCs单独培养、HSCs单独培养中上清液中HGF的浓度, 结果表明共培养体系中HGF浓度明显高于后二者, 且在48 h内浓度最高. 有研究表明HGF作用是HSCs凋亡的主要因素[13], 但也有研究[6,31]表明, BMSCs旁分泌的神经细胞生长因子在HSCs凋亡中发挥了重要作用. 为明确共培养体系对肝星状细胞增殖抑制、促进凋亡作用是否有其他因素的作用, c-met多克隆抗体预先封闭HSCs表面c-met受体后再与BMSCs共培养, 48 h后检测HSCs的增殖、凋亡和RohA表达. 结果显示, c-met多克隆抗体封闭HSCs表面c-met受体后, 抑制HGF/c-met信号通路, 取消了BMSCs对HSCs的上述作用. 因此我们认为BMSCs旁分泌的HGF在抑制活化的星状细胞增殖, 促进凋亡、抑制RohA表达中起重要作用.
有研究[32,33]表明HGF/c-met信号通路活化后是通过抑制NF-κB信号通路来促使HSCs凋亡, 其是否和RohA信号通路发生"交谈"或RohA信号通路本身受抑制的结果, 这些均有待进一步研究.
总之, 采用BMSCs与HSCs非接触共培养体系中, HSCs的增殖受到明显抑制, 并促进HSCs的凋亡, RohA表达受到抑制, BMSCs旁分泌的HGF在其中起重要作用, 可能是BMSCs移植治疗急慢性肝损伤模型中疗效产生机制, 是BMSCs抗肝纤维化作用的部分分子机制.
骨髓间充质干细胞(BMSCs)是骨髓内的一种非造血干细胞, 有自我复制和高度增殖的能力, 又有多分化的潜能. 目前研究表明, BMSCs对多种原因引起的肝损伤具有显著修复作用, 可改善甚至逆转肝纤维化, 但其具体的机制还不清楚.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
在BMSCs治疗肝损伤肝纤维化研究中, 研究的热点重点一是BMSCs向肝细胞转化, 二是BMSCs与HSCs之间是如何相互作用. 前者已取得了突破, 后者还未明确, 研究还不多.
Parekkadan等通过Transwell共培养体系, 将BMSCs和HSCs共培养, BMSCs可分泌HGF抑制胶原增殖和沉着, 同时诱导活化的星状细胞凋亡. Shi等研究发现在共培养体系中BMSCs不可逆地抑制星状细胞的增殖, 继而凋亡. 这种效应可能是由BMSCs分泌的NGF和HGF活化JNK信号通路产生的.
本文首次运用Transwell构建非接触共培养体系, 研究BMSCs旁分泌HGF对HSCs的增殖、凋亡及RohA表达的调控作用, 为BMSCs抗肝纤维化作用提供理论依据.
BMSCs与HSCs共培养能抑制HSCs的增殖, 促进凋亡, 抑制RohA表达, 其机制是通过BMSCs旁分泌HGF发挥作用. 可为BMSCs移植治疗肝纤维化提供临床运用的理论依据.
本文立题和研究结果均有一定创新和科学价值.
编辑: 李军亮 电编: 何基才
| 2. | Kershenobich D. [Liver fibrosis and cirrhosis: are they reversible?]. Rev Gastroenterol Mex. 2004;69 Suppl 3:149-151. [PubMed] |
| 3. | Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009;8:283-291. [PubMed] |
| 4. | Gieling RG, Burt AD, Mann DA. Fibrosis and cirrhosis reversibility - molecular mechanisms. Clin Liver Dis. 2008;12:915-937, xi. [PubMed] |
| 5. | Kim WH, Matsumoto K, Bessho K, Nakamura T. Growth inhibition and apoptosis in liver myofibroblasts promoted by hepatocyte growth factor leads to resolution from liver cirrhosis. Am J Pathol. 2005;166:1017-1028. [PubMed] [DOI] |
| 6. | Lin N, Hu K, Chen S, Xie S, Tang Z, Lin J, Xu R. Nerve growth factor-mediated paracrine regulation of hepatic stellate cells by multipotent mesenchymal stromal cells. Life Sci. 2009;85:291-295. [PubMed] [DOI] |
| 7. | Shi J, Wei L. Rho kinase in the regulation of cell death and survival. Arch Immunol Ther Exp (Warsz). 2007;55:61-75. [PubMed] [DOI] |
| 8. | Zhou Y, Zheng S, Lin J, Zhang QJ, Chen A. The interruption of the PDGF and EGF signaling pathways by curcumin stimulates gene expression of PPARgamma in rat activated hepatic stellate cell in vitro. Lab Invest. 2007;87:488-498. [PubMed] [DOI] |
| 9. | Abdel Aziz MT, Atta HM, Mahfouz S, Fouad HH, Roshdy NK, Ahmed HH, Rashed LA, Sabry D, Hassouna AA, Hasan NM. Therapeutic potential of bone marrow-derived mesenchymal stem cells on experimental liver fibrosis. Clin Biochem. 2007;40:893-899. [PubMed] [DOI] |
| 10. | Baertschiger RM, Serre-Beinier V, Morel P, Bosco D, Peyrou M, Clément S, Sgroi A, Kaelin A, Buhler LH, Gonelle-Gispert C. Fibrogenic potential of human multipotent mesenchymal stromal cells in injured liver. PLoS One. 2009;4:e6657. [PubMed] [DOI] |
| 13. | Parekkadan B, van Poll D, Megeed Z, Kobayashi N, Tilles AW, Berthiaume F, Yarmush ML. Immunomodulation of activated hepatic stellate cells by mesenchymal stem cells. Biochem Biophys Res Commun. 2007;363:247-252. [PubMed] [DOI] |
| 14. | Shi L, Li G, Wang J, Sun B, Yang L, Wang G, Wang D, Mu L, Chen H, Jin L. Bone marrow stromal cells control the growth of hepatic stellate cells in vitro. Dig Dis Sci. 2008;53:2969-2974. [PubMed] [DOI] |
| 15. | Wang X, Tang X, Gong X, Albanis E, Friedman SL, Mao Z. Regulation of hepatic stellate cell activation and growth by transcription factor myocyte enhancer factor 2. Gastroenterology. 2004;127:1174-1188. [PubMed] [DOI] |
| 17. | Pulavendran S, Vignesh J, Rose C. Differential anti-inflammatory and anti-fibrotic activity of transplanted mesenchymal vs. hematopoietic stem cells in carbon tetrachloride-induced liver injury in mice. Int Immunopharmacol. 2010;10:513-519. [PubMed] [DOI] |
| 18. | Trebicka J, Hennenberg M, Laleman W, Shelest N, Biecker E, Schepke M, Nevens F, Sauerbruch T, Heller J. Atorvastatin lowers portal pressure in cirrhotic rats by inhibition of RhoA/Rho-kinase and activation of endothelial nitric oxide synthase. Hepatology. 2007;46:242-253. [PubMed] [DOI] |
| 19. | Zhou Q, Hennenberg M, Trebicka J, Jochem K, Leifeld L, Biecker E, Sauerbruch T, Heller J. Intrahepatic upregulation of RhoA and Rho-kinase signalling contributes to increased hepatic vascular resistance in rats with secondary biliary cirrhosis. Gut. 2006;55:1296-1305. [PubMed] [DOI] |
| 20. | Shiotani S, Shimada M, Suehiro T, Soejima Y, Yosizumi T, Shimokawa H, Maehara Y. Involvement of Rho-kinase in cold ischemia-reperfusion injury after liver transplantation in rats. Transplantation. 2004;78:375-382. [PubMed] [DOI] |
| 21. | 胡 昆鹏, 林 楠, 林 继宗, 邓 美海, 汤 照峰, 项 鹏, 许 瑞云. 人骨髓间质干细胞对肝星状细胞的体外调控. 中国组织工程研究与临床康复. 2009;13:5257-5260. |
| 22. | Crisostomo PR, Wang Y, Markel TA, Wang M, Lahm T, Meldrum DR. Human mesenchymal stem cells stimulated by TNF-alpha, LPS, or hypoxia produce growth factors by an NF kappa B- but not JNK-dependent mechanism. Am J Physiol Cell Physiol. 2008;294:C675-C682. [PubMed] |
| 23. | Shi MN, Zheng WD, Zhang LJ, Chen ZX, Wang XZ. Effect of IL-10 on the expression of HSC growth factors in hepatic fibrosis rat. World J Gastroenterol. 2005;11:4788-4793. [PubMed] [DOI] |
| 24. | Sanz S, Pucilowska JB, Liu S, Rodríguez-Ortigosa CM, Lund PK, Brenner DA, Fuller CR, Simmons JG, Pardo A, Martínez-Chantar ML. Expression of insulin-like growth factor I by activated hepatic stellate cells reduces fibrogenesis and enhances regeneration after liver injury. Gut. 2005;54:134-141. [PubMed] [DOI] |
| 25. | Forte G, Minieri M, Cossa P, Antenucci D, Sala M, Gnocchi V, Fiaccavento R, Carotenuto F, De Vito P, Baldini PM. Hepatocyte growth factor effects on mesenchymal stem cells: proliferation, migration, and differentiation. Stem Cells. 2006;24:23-33. [PubMed] [DOI] |
| 26. | Giannopoulou M, Dai C, Tan X, Wen X, Michalopoulos GK, Liu Y. Hepatocyte growth factor exerts its anti-inflammatory action by disrupting nuclear factor-kappaB signaling. Am J Pathol. 2008;173:30-41. [PubMed] [DOI] |
| 27. | Wang X, Le P, Liang C, Chan J, Kiewlich D, Miller T, Harris D, Sun L, Rice A, Vasile S. Potent and selective inhibitors of the Met [hepatocyte growth factor/scatter factor (HGF/SF) receptor] tyrosine kinase block HGF/SF-induced tumor cell growth and invasion. Mol Cancer Ther. 2003;2:1085-1092. [PubMed] |
| 28. | Wang J, Bian C, Liao L, Zhu Y, Li J, Zeng L, Zhao RC. Inhibition of hepatic stellate cells proliferation by mesenchymal stem cells and the possible mechanisms. Hepatol Res. 2009;39:1219-1228. [PubMed] [DOI] |
| 29. | Suzumura K, Hirano T, Son G, Iimuro Y, Mizukami H, Ozawa K, Fujimoto J. Adeno-associated virus vector-mediated production of hepatocyte growth factor attenuates liver fibrosis in mice. Hepatol Int. 2008;2:80-88. [PubMed] [DOI] |
| 30. | Huh CG, Factor VM, Sánchez A, Uchida K, Conner EA, Thorgeirsson SS. Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair. Proc Natl Acad Sci U S A. 2004;101:4477-4482. [PubMed] [DOI] |
| 31. | Kendall TJ, Hennedige S, Aucott RL, Hartland SN, Vernon MA, Benyon RC, Iredale JP. p75 Neurotrophin receptor signaling regulates hepatic myofibroblast proliferation and apoptosis in recovery from rodent liver fibrosis. Hepatology. 2009;49:901-910. [PubMed] [DOI] |
| 32. | Watson MR, Wallace K, Gieling RG, Manas DM, Jaffray E, Hay RT, Mann DA, Oakley F. NF-kappaB is a critical regulator of the survival of rodent and human hepatic myofibroblasts. J Hepatol. 2008;48:589-597. [PubMed] [DOI] |
| 33. | Chen A, Zheng S. Curcumin inhibits connective tissue growth factor gene expression in activated hepatic stellate cells in vitro by blocking NF-kappaB and ERK signalling. Br J Pharmacol. 2008;153:557-567. [PubMed] [DOI] |