修回日期: 2010-04-20
接受日期: 2010-04-27
在线出版日期: 2010-05-28
目的: 探讨DR-nm23蛋白在大肠癌组织中的表达及其与大肠癌发生发展和转移的关系.
方法: 应用SP免疫组织化学法检测98例大肠癌、57例大肠腺瘤及42例正常大肠黏膜组织中DR-nm23蛋白的表达, 统计学分析比较DR-nm23蛋白表达差异与大肠癌的发生、进展、淋巴结转移以及大肠癌组织学分型、病理分级的相关性.
结果: DR-nm23蛋白在正常组、腺瘤组和大肠癌组的表达逐渐下调, 3组间表达差异具有显著性(71.4% vs 38.6%, 35.7%, 均P<0.01). 腺瘤组中, 高级别上皮内肿瘤的表达率低于低级别上皮内肿瘤(25.7% vs 59.1%, P<0.05); 大肠癌无淋巴结转移组表达率高于淋巴结转移组, 表达与淋巴结转移呈负相关(44.1% vs 23.1%, P<0.05); DR-nm23表达与组织学分型(χ2 = 13.731, P<0.01)及病理分级(χ2 = 12.198, P<0.01)均有相关性. 转移组中, 淋巴结转移癌DR-nm23蛋白表达率较原发癌高, 但二者差异无显著性(P>0.05).
结论: DR-nm23参与大肠癌细胞的分化, 其表达下调与大肠癌发生发展转移密切相关, 可作为反映大肠癌生物学行为和判断预后的潜在重要指征.
引文著录: 杨直, 曲利娟, 武一曼, 曾玲, 熊喜生. DR-nm23在大肠癌组织中的蛋白表达及意义. 世界华人消化杂志 2010; 18(15): 1563-1568
Revised: April 20, 2010
Accepted: April 27, 2010
Published online: May 28, 2010
AIM: To investigate the relationship between the expression of DR-nm23 protein and the carcinogenesis, progression and metastasis of colorectal carcinoma.
METHODS: Ninety-eight colorectal carcinoma specimens, 57 adenoma specimens and 42 normal colorectal tissue specimens were examined by immunohistochemistry using the streptavidin-peroxidase method. The correlation of DR-nm23 protein expression with the carcinogenesis, progression, lymph node metastasis, histological type and differentiation grade of colorectal carcinoma was then analyzed.
RESULTS: The positive rate of DR-nm23 protein expression was significantly higher in normal colorectal tissue than in adenoma and colorectal carcinoma (71.4% vs 38.6% and 35.7%, respectively; both P < 0.01). The positive rate of DR-nm23 protein expression was significantly lower in high-grade intraepithelial tumors than in low-grade intraepithelial tumors in the adenoma group (25.7% vs 59.1%, P < 0.05), and in metastatic colorectal carcinoma than in non-metastatic colorectal carcinoma (23.1% vs 44.1%, P < 0.05). The expression of DR-nm23 is negatively related to lymph node metastasis (P < 0.05). DR-nm23 expression is also closely related to histological type (χ2 = 13.731, P < 0.01) and differentiation grade (χ2 = 12.198, P < 0.01). The positive rate of DR-nm23 protein was higher in secondary tumors than in primary tumors in the metastatic colorectal carcinoma group though no significant difference was noted between them (P > 0.05).
CONCLUSION: Decreased DR-nm23 protein expression is closely related to tumor differentiation, carcinogenesis, progression and metastasis in colorectal carcinoma. DR-nm23 is an important parameter for evaluation of the biological behavior and prognosis of colorectal carcinoma.
- Citation: Yang Z, Qu LJ, Wu YM, Zeng L, Xiong XS. Significance of DR-nm23 protein expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1563-1568
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1563
DR-nm23基因是nm23肿瘤转移抑制基因家族成员之一. 1995年Ventruelli等[1]利用cDNA文库差异显示筛选技术, 从慢性粒细胞性白血病(chronic myelogenous leukemia, CML)急性发作期的原代细胞中克隆出与nm23-H1和nm23-H2具有65%-70%高度同源的DR-nm23 cDNA, 之后有关该基因参与多种肿瘤形成和进展等方面的研究越来越受到关注, 但其与大肠癌组织的相关性研究未见报道. 本文采用SP免疫组织化学法检测大肠癌、腺瘤及正常肠黏膜组织中DR-nm23蛋白的表达, 探讨DR-nm23蛋白与大肠癌发生发展及转移的关系.
选取中国人民解放军南京军区福州总医院2006-2008年经病理证实的大肠癌根治术标本98例, 其中大肠癌不伴淋巴结转移组59例, 大肠癌伴淋巴结转移组39例; 39例转移组中同时具有原发癌和淋巴结转移癌29例. 选取57例大肠管状绒毛状腺瘤为腺瘤组, 其中腺瘤伴高级别上皮内肿瘤35例, 腺瘤伴低级别上皮内肿瘤22例. 另选取42例大肠癌无转移组配对邻近正常黏膜组织为正常组. 98例大肠癌组中, 男69例, 女29例, 年龄27-79(中位年龄57.84)岁. 肿瘤发生部位: 结肠46例, 直肠52例. 组织学类型: 乳头状腺癌25例, 管状腺癌30例, 黏液腺癌14例, 低分化腺癌17例, 印戒细胞癌12例. 病理分级(参照2000年WHO分级标准): Ⅰ级25例, Ⅱ级44例, Ⅲ级29例.
1.2.1 免疫组织化学: 所有标本经40 g/L甲醛固定, 常规石蜡包埋. 浓缩型羊抗人DR-nm23(编号SC-50945)多克隆抗体及即用型SABC免疫组织化学试剂盒分别购自美国Santa Cruz Biotechnology公司和武汉博士德生物工程有限公司. 采用SP法免疫组织化学法染色: 切片脱蜡入水, 组织抗原高压修复1 min 40 s, PBS 5 min×2; 3% H2O2阻断过氧化氢酶活性10 min, PBS 5 min×2; 正常兔血清室温孵育15 min; 羊抗人DR-nm23抗体(工作浓度1:300), 4 ℃过夜12 h, PBS 3 min×3; 生物素标记二抗室温孵育15 min, PBS 3 min×3; 辣根酶标记链霉卵白素室温孵育15 min, PBS 3 min×3; DAB显色, 显微镜观察, 水洗终止; 苏木精复染, 盐酸分化, 水洗反蓝; 封固, 光镜下观察. 用PBS代替一抗作为阴性对照.
1.2.2 阳性结果判断: DR-nm23蛋白阳性表达颗粒定位于细胞质. 每张切片根据免疫组织化学评分标准分别进行阳性率及着色强度评分: 无着色为0分, 浅黄色为1分, 浅棕色为2分, 深棕色为3分; 5%以下为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%以上为4分. 将阳性率和着色强度两项评分的乘积进行评价, 结果分为3级: 0-4分为阴性(-), 5-8分为弱阳性表达(+), 9-12分为强阳性表达(++).
统计学处理 应用SPSS 13.0统计软件包进行多个独立样本非参数Kreskas-Wallis H检验和两独立样本非参数Mann-Whitney U检验.
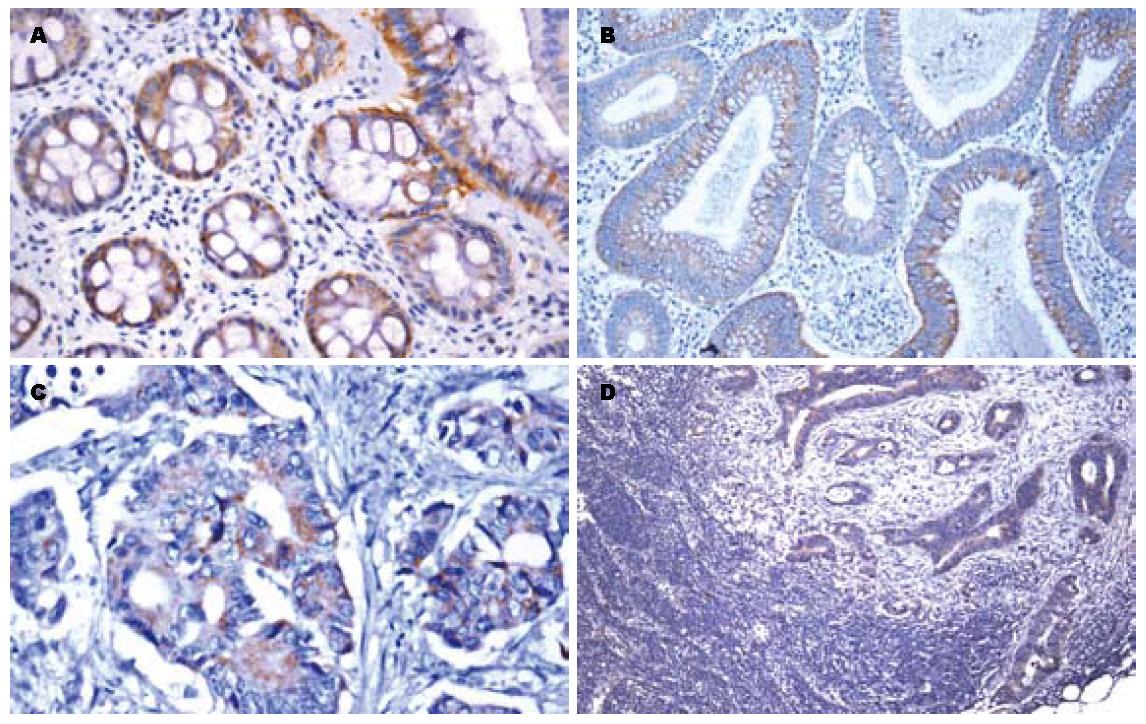
正常组DR-nm23蛋白表达率71.4%(30/42), 其中强阳性19例(19/42, 45.2%), 弱阳性11例(11/42, 26.2%), 阴性12例(12/42, 28.6%); 腺瘤组DR-nm23蛋白表达率38.6%(22/57), 其中强阳性2例(2/57, 3.5%), 弱阳性20例(20/57, 35.1%), 阴性35例(35/57, 61.4%); 大肠癌组DR-nm23蛋白表达率35.7%(25/98), 其中强阳性10例(10/98, 10.2%), 弱阳性25例(25/98, 25.5%), 阴性63例(63/98, 64.3%). 阳性颗粒均定位于细胞质(图1). 正常组、腺瘤组和大肠癌组间DR-nm23蛋白表达差异具有显著性(χ2 = 25.852, P<0.01). 两两比较, 正常组与腺瘤组(Z = -4.385, P<0.01)、正常组与大肠癌组(Z = -4.606, P<0.01)间DR-nm23蛋白表达差异均有显著性, 而腺瘤组与大肠癌组(Z = -0.024, P>0.05)表达差异无显著性(表1).
腺瘤伴低级别上皮内肿瘤组DR-nm23蛋白表达率59.1%(13/22), 其中强阳性2例(2/22, 9.1%), 弱阳性11例(11/22, 50.0%), 阴性9例(9/22, 40.9%); 腺瘤伴高级别上皮内肿瘤组DR-nm23蛋白表达率25.7%(9/35), 均为弱阳性, 阴性26例(26/35, 74.3%). 统计学分析二组表达差异具有显著性(Z = -2.646, P<0.05, 表2).
| 分组 | n | DR-nm23蛋白表达n(%) | 阳性率(%) | P值 | ||
| - | + | ++ | ||||
| 低级别 | 22 | 9(40.9) | 11(50.0) | 2(9.1) | 59.1 | |
| 高级别 | 35 | 26(74.3) | 9(25.7) | 0(0.0) | 25.7 | 0.008 |
大肠癌伴淋巴结转移癌组与大肠癌不伴淋巴结转移癌组DR-nm23蛋白表达率分别为23.1%(9/39)和44.1%(26/59), 统计学分析二组表达差异具有显著性(Z = -2.156, P<0.05), 表达与淋巴结转移呈负相关; DR-nm23表达与组织学类型(χ2 = 13.731, P<0.01)和病理分级(χ2 = 12.198, P<0.01)均有相关性(表3).
| 分组 | n | DR-nm23蛋白表达n(%) | 阳性率(%) | P值 | ||
| - | + | ++ | ||||
| 组织学分型 | ||||||
| 乳头状腺癌 | 24 | 13 | 8 | 3 | 29.2 | |
| 管状腺癌 | 30 | 14 | 11 | 5 | 53.3 | |
| 黏液腺癌 | 15 | 10 | 3 | 2 | 33.3 | 0.008 |
| 低分化腺癌 | 17 | 16 | 1 | 0 | 5.9 | |
| 印戒细胞癌 | 12 | 10 | 2 | 0 | 16.7 | |
| 病理分级 | ||||||
| Ⅰ | 25 | 12 | 10 | 3 | 52 | |
| Ⅱ | 44 | 25 | 12 | 7 | 43.2 | 0 |
| Ⅲ | 29 | 26 | 3 | 0 | 10 | |
| 淋巴结转移 | ||||||
| 有 | 39 | 30 | 7 | 2 | 23.1 | 0.031 |
| 无 | 59 | 33 | 18 | 8 | 44.1 | |
转移组原发癌DR-nm23蛋白表达率20.7%(6/29), 其中强阳性1例(1/29, 3.5%), 弱阳性5例(5/29, 17.2%), 阴性23例(23/29, 79.3%); 淋巴结转移癌DR-nm23蛋白表达率27.6%(8/29), 其中强阳性1例(1/29, 3.5%), 弱阳性7例(7/29, 24.1%), 阴性21例(21/29, 72.4%). 统计学分析二组差异无显著性(Z = -0.585, P>0.05, 表4).
| 分组 | DR-nm23蛋白表达n(%) | 阳性率(%) | P值 | ||
| - | + | ++ | |||
| 大肠原发癌 | 23(79.31) | 5(17.24) | 1(3.45) | 20.69 | |
| 淋巴结转移癌 | 21(72.41) | 7(24.14) | 1(3.45) | 27.59 | 0.559 |
DR-nm23基因是迄今nm23肿瘤转移抑制基因家族8个成员(nm23-H1-nm23-H8)之一, 又称nm23-H3或NME3(non-metastasis cell 3). 基因定位于人染色体16q13, cDNA全长849 bp, 由6个外显子和5个内含子组成, 转录起始点位于翻译起始密码子上游170 bp和370bp, 启动子结构与该家族其他成员不同, 富含G+C, 几乎不含经典TATA框或CAAT框[1]. 已证实该基因有Ap-2、SP1、Myb、ets、GATA和Hox-1等多个转录起始因子相关元件结合位点, 但只有Ap-2参与了调控基因的转录效率及活性, 激活DR-nm23基因的表达[1,2]. 已知nm23基因家族所编码的蛋白质产物是二磷酸核苷激酶(nucleoside diphosphate kinase, NDPK), NDPK最早是在酵母菌和鸽子胸肌中发现, 随后又证实NDPK活性是该家族的共同特性, 与细胞的分化和增殖活动密切相关[3-5], 具有组氨酸蛋白激酶活性、参与丝氨酸磷酸化、转录激活等生物学特性, 主要通过磷酸组氨酸中间产物将与蛋白质结合的二磷酸核苷可逆磷酸化为三磷酸核苷, 调节细胞内能量池的大小, 活化蛋白质, 参与蛋白质各种功能活动[6-8].
目前有关DR-nm23参与肿瘤形成和进展的机制尚不十分明确, 一般认为可能也与NDPK的活性有关. 研究发现nm23肿瘤转移抑制基因家族不同成员的NDPK活性所表现的生物学效应不尽相同. nm23-H1基因产物NDPKA与肿瘤细胞的分化和转移密切相关[9,10]; nm23-H2基因产物NDPKB调控c-myc原癌基因转录, 参与细胞的生长、分化[11,12]等; nm23-H4基因产物是线粒体NDPK, 其氨基酸序列与NDPKA和NDPKB有58%-59%的同源性, 推测也与肿瘤的发生发展和转移有关[13,14]; 此外, 睾丸特异性表达基因nm23-H5和nm23-H6-nm23-H8的基因产物均被证实具有NDPK活性或NDPK样区域[15], 可能参与细胞的分化和生长. 而DR-nm23的基因产物为NDPKC, 除了在氨基末端多17个氨基酸并组成疏水性基团, 使其具有膜连接活性[16]外, NDPKC的长度和结构与NDPKA、NDPKB基本相同, 因此推测DR-nm23同样具有多种蛋白质功能[17].
Venturelli等[17]研究发现DR-nm23基因在CD34(+)髓细胞分化早期表达上调, 后期表达下调或缺失; 进一步研究发现DR-nm23的表达水平与CML慢性期向急性发作期转化密切相关. CML病程早期, DR-nm23过表达不仅能抑制粒细胞集落刺激因子诱导粒细胞分化, 同时促进粒细胞凋亡, 使病情处于相对静止的慢性期; 随着病程进展, DR-nm23表达上调, 粒细胞分化严重抑制甚至停滞, 髓前体细胞过度增殖, 使病情急转直下向急性发作期转化. 此外, 通过S61P突变和RGD缺失改变蛋白质结构, 影响粒细胞胞质内与线粒体膜上靶蛋白的相互作用, 也削弱了野生型DR-nm23的生物学效应. 提示DR-nm23在造血细胞分化早期发挥重要作用, 基因突变、缺失和CML不同阶段的差异表达, 可能与CML的发生、发展和恶化密切相关. Huang等[18]利用cDNA表达芯片技术, 证实正常脑组织不表达DR-nm23, 而多数星形细胞瘤表达上调, 提示DR-nm23基因与星形细胞瘤的发生有关. Amendola等[19]发现神经母细胞瘤细胞株DR-nm23基因过度表达, 且分化越好的表型表达水平越高; 未被DR-nm23 mRNA转染的SK-N-SH神经母细胞瘤细胞株, DR-nm23表达水平与瘤细胞分化诱导状态相关; 而稳定转染后的细胞株具备了波形蛋白表达增加、Ⅳ型胶原沉积增多等分化细胞的特性, 表明DR-nm23与神经母细胞瘤的分化密切相关.
本组实验结果显示: 正常组、腺瘤组和大肠癌组DR-nm23蛋白表达依次下调, 统计学分析表达差异具有显著性(P<0.01); 腺瘤组中, 高级别上皮内肿瘤表达较低级别上皮内肿瘤显著性下调(P<0.05), 但腺瘤组与大肠癌组间表达差异无显著性; DR-nm23蛋白表达与肿瘤病理分级和组织学分型均有相关性(P<0.01). 提示DR-nm23蛋白表达水平下调与大肠癌发生发展以及肿瘤细胞的分化程度密切相关, 且可能主要参与上皮内瘤变等癌前病变的过程.
有关该家族与肿瘤转移关系的研究报道已很多, 作为经典的肿瘤转移抑制基因nm23-H1, 其表达水平与不同肿瘤转移的相关性不尽相同. 研究证实nm23-H1表达与乳腺癌、胃癌、肝细胞癌、食道癌、肺癌、淋巴瘤等肿瘤转移呈负相关[20-25], 与卵巢癌、前列腺癌等转移呈正相关[26], 有些研究还发现nm23-H1表达水平与转移潜能无关[27,28]. 此外, nm23-H1与大肠癌转移的相关性, 各家报道也不一致[29-31]. 由此可见, nm23基因家族与肿瘤转移的关系十分复杂, 不同肿瘤组织、相同肿瘤组织不同发展阶段, nm23表达水平及其所诱导的生物学效应具有组织特异性, 深入研究nm23在不同肿瘤中的表达及其意义具有广阔的前景. 迄今, 有关DR-nm23与肿瘤转移关系的研究报道极少. Amendola等[19]研究发现, DR-nm23高表达的人SK-N-SH神经母细胞瘤细胞株通过降低细胞外基质的黏附性, 抑制了其在软琼脂中的生长. 而鼠NLE-15神经母细胞瘤细胞株通过上调DR-nm23的表达, 促进瘤细胞轴突快速生长, 使β-整联蛋白显著增多, Ⅰ型胶原蛋白黏附性增加, 从而抑制瘤细胞的生长[32]. Sun等[33]应用肿瘤转移相关cDNA基因芯片技术, 检测已知447个转移相关基因在大肠癌中的表达, 发现51个基因(上调基因22个, 下调基因29个)与大肠癌转移密切相关, 其中DR-nm23是29个下调基因之一. 本组实验结果与他们相同, 淋巴结转移组DR-nm23蛋白表达较无淋巴结转移组高, 表达与淋巴结转移呈负相关性(P<0.05), 提示DR-nm23蛋白可作为反映大肠癌生物学行为和预后的潜在重要指征之一. Negroni等认为DR-nm23蛋白的61位丝氨酸残基可能是赋予抑制肿瘤转移潜能的主要磷酸化位点, 其突变导致细胞分化能力的减弱, 使蛋白之间相互作用受到影响, 参与并促进肿瘤转移过程的发生[34].
本组实验结果还显示: 转移组中, 原发癌与其匹配淋巴结转移癌的DR-nm23蛋白表达差异无显著性, 从另一方面也提示了大肠癌从原发灶向转移灶转移的过程, 不仅是多基因、多因素、多机制共同参与的复杂病理过程, 而且蛋白质表达水平在转移过程中也可能发生相应变化.
大肠癌是常见的消化系恶性肿瘤, 占恶性肿瘤发病率第二位, 严重危害人类健康. 转移是大肠癌的重要生物学行为, 也是肿瘤患者死亡的主要原因之一. 大肠癌转移涉及包括基因突变、激活, 肿瘤细胞的黏附、迁移、增殖, 细胞外基质降解, 组织免疫性及肿瘤血管形成等在内的多步骤、多因素、多基因共同参与的复杂病理过程, 及早确定其转移潜能及其相关因素对判断预后、指导治疗、提高生活质量具有十分重要的意义. DR-nm23基因是nm23肿瘤转移抑制基因家族成员之一, 近年来有关该基因与多种肿瘤形成和进展等方面的研究越来越受到关注, 但其与大肠癌组织的相关性研究未见报道. 本文旨在探讨大肠癌组织中DR-nm23蛋白的表达与大肠癌浸润、转移及病理特征的相关性,为大肠癌患者判断预后提供参考依据.
刘丽江, 教授, 江汉大学医学院病理学.
DR-nm23基因是nm23肿瘤转移抑制基因家族成员之一, 近年来有关该基因与多种肿瘤形成和进展等方面的研究越来越受到关注, 但其与大肠癌组织的相关性研究未见报道.
Amendola等研究发现神经母细胞瘤细胞株DR-nm23基因过度表达, 且分化越好的表型表达水平越高. DR-nm23高表达的人SK-N-SH神经母细胞瘤细胞株通过降低细胞外基质的黏附性, 抑制了其在软琼脂中的生长; 而鼠NLE-15神经母细胞瘤细胞株通过上调DR-nm23的表达, 促进瘤细胞轴突快速生长, 使β-整联蛋白显著增多, Ⅰ型胶原蛋白黏附性增加, 从而抑制瘤细胞的生长.
本文较全面地观察了DR-nm23蛋白在大肠癌、腺瘤及正常组织中的表达, 较早提出了DR-nm23蛋白表达水平下调与大肠癌发生发展以及肿瘤细胞的分化程度密切相关, 且可能主要参与上皮内瘤变等癌前病变的过程; 表达与大肠癌转移呈负相关性, 而与大肠癌组织学类型和病理分级均无相关性等观点.
DR-nm23参与大肠癌细胞的分化, 其表达下调是大肠癌发生发展的重要分子事件, 与大肠癌发生发展及转移密切相关, 可作为大肠癌生物学行为和判断预后的潜在重要指征.
本研究设计比较严谨, 研究数据可支持其结论, 具有较好的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Venturelli D, Martinez R, Melotti P, Casella I, Peschle C, Cucco C, Spampinato G, Darzynkiewicz Z, Calabretta B. Overexpression of DR-nm23, a protein encoded by a member of the nm23 gene family, inhibits granulocyte differentiation and induces apoptosis in 32Dc13 myeloid cells. Proc Natl Acad Sci U S A. 1995;92:7435-7439. [PubMed] [DOI] |
| 2. | 曲 利娟, 丁 彦青. DR-nm23基因与肿瘤发生发展关系的研究进展. 国外医学·肿瘤学分册. 2005;32:336-339. |
| 3. | Postel EH. Multiple biochemical activities of NM23/NDP kinase in gene regulation. J Bioenerg Biomembr. 2003;35:31-40. [PubMed] [DOI] |
| 4. | Kim HD, Youn B, Kim TS, Kim SH, Shin HS, Kim J. Regulators affecting the metastasis suppressor activity of Nm23-H1. Mol Cell Biochem. 2009;329:167-173. [PubMed] [DOI] |
| 5. | Boissan M, Dabernat S, Peuchant E, Schlattner U, Lascu I, Lacombe ML. The mammalian Nm23/NDPK family: from metastasis control to cilia movement. Mol Cell Biochem. 2009;329:51-62. [PubMed] [DOI] |
| 6. | Lombardi D, Mileo AM. Protein interactions provide new insight into Nm23/nucleoside diphosphate kinase functions. J Bioenerg Biomembr. 2003;35:67-71. [PubMed] [DOI] |
| 7. | Miyamoto M, Iwashita S, Yamaguchi S, Ono Y. Role of nm23 in the regulation of cell shape and migration via Rho family GTPase signals. Mol Cell Biochem. 2009;329:175-179. [PubMed] [DOI] |
| 8. | Postel EH, Zou X, Notterman DA, La Perle KM. Double knockout Nme1/Nme2 mouse model suggests a critical role for NDP kinases in erythroid development. Mol Cell Biochem. 2009;329:45-50. [PubMed] [DOI] |
| 9. | Jin L, Liu G, Zhang CH, Lu CH, Xiong S, Zhang MY, Liu QY, Ge F, He QY, Kitazato K. Nm23-H1 regulates the proliferation and differentiation of the human chronic myeloid leukemia K562 cell line: a functional proteomics study. Life Sci. 2009;84:458-467. [PubMed] [DOI] |
| 10. | Lee JH, Marshall JC, Steeg PS, Horak CE. Altered gene and protein expression by Nm23-H1 in metastasis suppression. Mol Cell Biochem. 2009;329:141-148. [PubMed] [DOI] |
| 11. | Thakur RK, Kumar P, Halder K, Verma A, Kar A, Parent JL, Basundra R, Kumar A, Chowdhury S. Metastases suppressor NM23-H2 interaction with G-quadruplex DNA within c-MYC promoter nuclease hypersensitive element induces c-MYC expression. Nucleic Acids Res. 2009;37:172-183. [PubMed] [DOI] |
| 12. | Dexheimer TS, Carey SS, Zuohe S, Gokhale VM, Hu X, Murata LB, Maes EM, Weichsel A, Sun D, Meuillet EJ. NM23-H2 may play an indirect role in transcriptional activation of c-myc gene expression but does not cleave the nuclease hypersensitive element III(1). Mol Cancer Ther. 2009;8:1363-1377. [PubMed] [DOI] |
| 13. | Tokarska-Schlattner M, Boissan M, Munier A, Borot C, Mailleau C, Speer O, Schlattner U, Lacombe ML. The nucleoside diphosphate kinase D (NM23-H4) binds the inner mitochondrial membrane with high affinity to cardiolipin and couples nucleotide transfer with respiration. J Biol Chem. 2008;283:26198-26207. [PubMed] [DOI] |
| 14. | Lacombe ML, Tokarska-Schlattner M, Epand RF, Boissan M, Epand RM, Schlattner U. Interaction of NDPK-D with cardiolipin-containing membranes: Structural basis and implications for mitochondrial physiology. Biochimie. 2009;91:779-783. [PubMed] [DOI] |
| 15. | Munier A, Serres C, Kann ML, Boissan M, Lesaffre C, Capeau J, Fouquet JP, Lacombe ML. Nm23/NDP kinases in human male germ cells: role in spermiogenesis and sperm motility? Exp Cell Res. 2003;289:295-306. [PubMed] [DOI] |
| 16. | Erent M, Gonin P, Cherfils J, Tissier P, Raschellà G, Giartosio A, Agou F, Sarger C, Lacombe ML, Konrad M. Structural and catalytic properties and homology modelling of the human nucleoside diphosphate kinase C, product of the DRnm23 gene. Eur J Biochem. 2001;268:1972-1981. [PubMed] [DOI] |
| 17. | Venturelli D, Cesi V, Ransac S, Engelhard A, Perrotti D, Calabretta B. The nucleoside diphosphate kinase activity of DRnm23 is not required for inhibition of differentiation and induction of apoptosis in 32Dcl3 myeloid precursor cells. Exp Cell Res. 2000;257:265-271. [PubMed] [DOI] |
| 18. | Huang H, Colella S, Kurrer M, Yonekawa Y, Kleihues P, Ohgaki H. Gene expression profiling of low-grade diffuse astrocytomas by cDNA arrays. Cancer Res. 2000;60:6868-6874. [PubMed] |
| 19. | Amendola R, Martinez R, Negroni A, Venturelli D, Tanno B, Calabretta B, Raschellà G. DR-nm23 gene expression in neuroblastoma cells: relationship to integrin expression, adhesion characteristics, and differentiation. J Natl Cancer Inst. 1997;89:1300-1310. [PubMed] [DOI] |
| 20. | Bal A, Joshi K, Logasundaram R, Radotra BD, Singh R. Expression of nm23 in the spectrum of pre-invasive, invasive and metastatic breast lesions. Diagn Pathol. 2008;3:23. [PubMed] [DOI] |
| 22. | 杨 育生, 刘 斌, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. 胃癌组织中Caveolin-1, nm23及MMP-2的表达及其意义. 世界华人消化杂志. 2007;15:1725-1730. [DOI] |
| 23. | Boissan M, Lacombe ML. Nm23/NDP kinases in hepatocellular carcinoma. J Bioenerg Biomembr. 2006;38:169-175. [PubMed] [DOI] |
| 24. | Niitsu N, Nakamine H, Okamoto M, Tamaru JI, Hirano M. A clinicopathological study of nm23-H1 expression in classical Hodgkin's lymphoma. Ann Oncol. 2008;19:1941-1946. [PubMed] [DOI] |
| 25. | Guan-Zhen Y, Ying C, Can-Rong N, Guo-Dong W, Jian-Xin Q, Jie-Jun W. Reduced protein expression of metastasis-related genes (nm23, KISS1, KAI1 and p53) in lymph node and liver metastases of gastric cancer. Int J Exp Pathol. 2007;88:175-183. [PubMed] [DOI] |
| 26. | Youn BS, Kim DS, Kim JW, Kim YT, Kang S, Cho NH. NM23 as a prognostic biomarker in ovarian serous carcinoma. Mod Pathol. 2008;21:885-892. [PubMed] [DOI] |
| 27. | Murakami M, Meneses PI, Lan K, Robertson ES. The suppressor of metastasis Nm23-H1 interacts with the Cdc42 Rho family member and the pleckstrin homology domain of oncoprotein Dbl-1 to suppress cell migration. Cancer Biol Ther. 2008;7:677-688. [PubMed] [DOI] |
| 28. | Wang YF, Chen JY, Chang SY, Chiu JH, Li WY, Chu PY, Tai SK, Wang LS. Nm23-H1 expression of metastatic tumors in the lymph nodes is a prognostic indicator of oral squamous cell carcinoma. Int J Cancer. 2008;122:377-386. [PubMed] [DOI] |
| 30. | Pasz-Walczak G, Salagacka A, Potemski P, Balcerczak E, Kordek R, Mirowski M. Maspin and Nm23-H1 expression in colorectal cancer. Neoplasma. 2010;57:95-101. [PubMed] [DOI] |
| 31. | Dusonchet L, Corsale S, Migliavacca M, Calò V, Bazan V, Amato A, Cammareri P, Totaro MS, Agnese V, Cascio S. Nm23-H1 expression does not predict clinical survival in colorectal cancer patients. Oncol Rep. 2003;10:1257-1263. [PubMed] [DOI] |
| 32. | Amendola R, Martinez R, Negroni A, Venturelli D, Tanno B, Calabretta B, Raschellà G. DR-nm23 expression affects neuroblastoma cell differentiation, integrin expression, and adhesion characteristics. Med Pediatr Oncol. 2001;36:93-96. [PubMed] [DOI] |
| 33. | Sun Q, Ding YQ, Gao XQ, Yan S, Han JX. [Development and application of cDNA microarray of tumor metastasis-associated genes]. Diyi Junyi Daxue Xuebao. 2002;22:1070-1075. [PubMed] |
| 34. | Negroni A, Venturelli D, Tanno B, Amendola R, Ransac S, Cesi V, Calabretta B, Raschellà G. Neuroblastoma specific effects of DR-nm23 and its mutant forms on differentiation and apoptosis. Cell Death Differ. 2000;7:843-850. [PubMed] [DOI] |