修回日期: 2010-04-28
接受日期: 2010-05-10
在线出版日期: 2010-05-28
目的: 探讨紧密连接蛋白-2(Tjp-2)表达及定位变化与胰腺癌细胞解离的关系.
方法: 采用RT-PCR和Western blot分别检测解离型高转移株(PC-1.0)和非解离型低转移株(PC-1)胰腺癌细胞中Tjp-2的基因和蛋白表达, 利用免疫细胞化学方法确定PC-1.0和PC-1细胞中Tjp-2的细胞内定位变化. 最后分析Tjp-2的表达及细胞内定位变化与胰腺癌细胞解离的相关性.
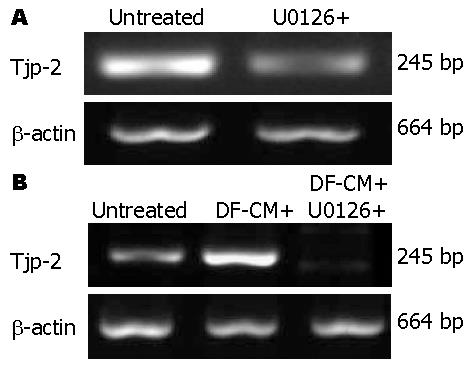
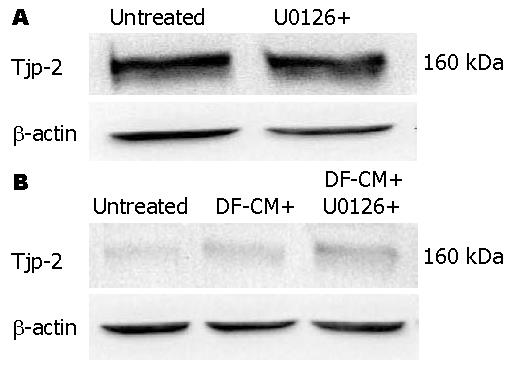
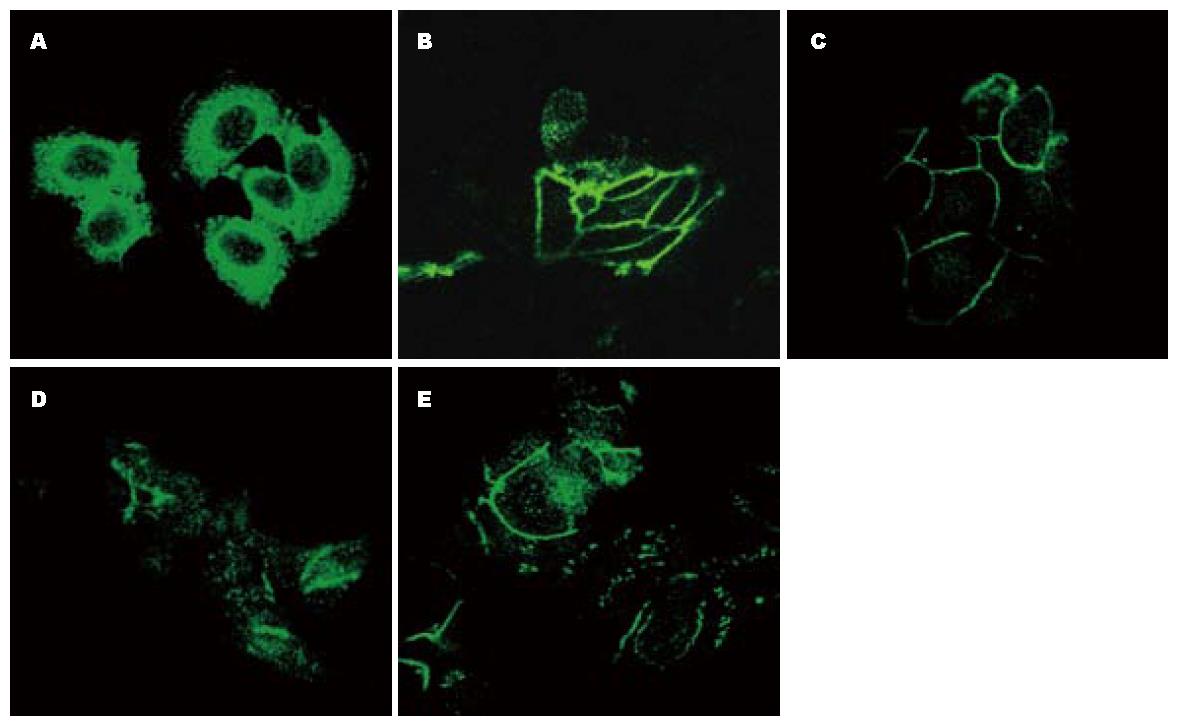
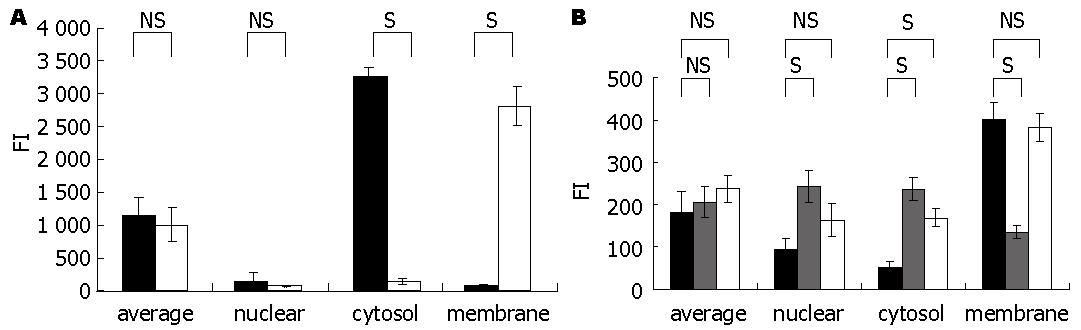
结果: Tjp-2 mRNA和蛋白在PC-1.0细胞中过度表达, 在PC-1细胞中表达均较弱. U0126(丝裂原活化蛋白激酶激酶抑制剂)抑制PC-1.0细胞中Tjp-2 mRNA的表达, 含细胞解离因子的培养液上清(DF-CM)则诱导PC-1细胞中Tjp-2 mRNA表达增加. 在PC-1.0细胞中Tjp-2蛋白主要分布于细胞质(FI = 3 273.7±131.2), U0126处理后细胞边缘部位的Tjp-2表达显著增强(FI = 2 814.8±297.0, P = 0.003). 在PC-1细胞中Tjp-2蛋白主要分布于细胞间连接部位(FI = 401.5±41.3), 经DF-CM处理后细胞间连接部位Tjp-2表达明显减弱(FI = 135.6±15.8, P = 0.024), 再经U0126处理后Tjp-2蛋白再次向细胞间连接部位聚集(FI = 382.6±34.1, P = 0.072).
结论: Tjp-2基因表达及蛋白的细胞内定位变化参与调控胰腺癌细胞解离. Tjp-2可作为抗胰腺癌侵袭转移分子靶向治疗的新靶点.
引文著录: 谭晓冬, 周磊, 王巍, 王宝胜, 刘金钢, 戴显伟. 紧密连接蛋白-2表达及定位变化与胰腺癌细胞解离的关系. 世界华人消化杂志 2010; 18(15): 1537-1543
Revised: April 28, 2010
Accepted: May 10, 2010
Published online: May 28, 2010
AIM: The investigate the correlation between the expression and localization of tight junction protein-2 (Tjp-2) and the dissociation of pancreatic cancer cells.
METHODS: The expression of Tjp-2 mRNA and protein in highly (PC-1.0) and weakly (PC-1) invasive and metastatic pancreatic cancer cells was detected by RT-PCR and Western blotting, respectively. Immunocytochemistry was used to observe the redistribution of Tjp-2 protein in PC-1.0 and PC-1 cells. The correlation between the expression and localization of Tjp-2 and the dissociation of pancreatic cancer cells was then analyzed.
RESULTS: Both Tjp-2 mRNA and protein were overexpressed in PC-1.0 cells, but weakly expressed in PC-1 cells. Treatment with U0126, a mitogen activated protein kinase kinase inhibitor, inhibited Tjp-2 mRNA expression in PC-1.0 cells. Dissociation factor-conditioned medium (DF-CM) significantly induced Tjp-2 mRNA expression in PC-1 cells. Tjp-2 protein was mainly distributed in the cytoplasm of PC-1.0 cells [fluorescence intensity (FI) = 3 273.7 ± 131.2]. U0126 treatment obviously induced Tjp-2 protein expression at the sites of cell-cell contact (FI = 2 814.8 ± 297.0, P = 0.003). In PC-1 cells, Tjp-2 protein was mainly distributed at the sites of cell-cell contact (FI = 401.5 ± 41.3). Treatment with DF-CM suppressed Tjp-2 expression at the sites of cell-cell contact (FI = 135.6 ± 15.8, P = 0.024). However, subsequent U0126 treatment induced the re-accumulation of Tjp-2 protein at the sites of cell-cell contact (FI = 382.6 ± 34.1, P = 0.072) in PC-1 cells.
CONCLUSION: The changes in Tjp-2 expression and localization are involved in regulating the dissociation of pancreatic cancer cells. Tjp-2 may serve as a new target for molecular therapies that prevent the invasion and metastasis of pancreatic cancer.
- Citation: Tan XD, Zhou L, Wang W, Wang BS, Liu JG, Dai XW. Correlation of tight junction protein-2 expression and localization with pancreatic cancer cell dissociation. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1537-1543
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1537.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1537
高侵袭转移是胰腺癌预后极差的重要原因之一. 有文献报道, 肿瘤细胞从原发部位解离是肿瘤侵袭转移过程中最为重要的一步[1], 但胰腺癌细胞解离的分子机制尚不清楚. 明确细胞解离的分子机制有助于阐明胰腺癌侵袭转移的分子机制, 并有利于开发针对胰腺癌侵袭转移的新型治疗方法并改善患者的预后. 在前期研究中我们从解离型高转移株胰腺癌细胞PC-1.0的培养液上清中分离出胰腺癌细胞解离因子(dissociation factor, DF), DF可诱导非解离型低转移株胰腺癌细胞PC-1的细胞解离[2,3]. 进一步研究发现, DF可激活丝裂原活化蛋白激酶激酶2(mitogen-activated protein kinase kinase 2, MEK2)/细胞外信号调节激酶2(extracellular signal-regulated kinase 2, ERK2)信号转导通路, 并通过此信号转导通路调控胰腺癌细胞解离[4-7]. 在近期研究中, 我们应用cDNA微阵列分析筛选出在PC-1.0和PC-1细胞中与侵袭转移密切相关的差异表达基因紧密连接蛋白2(tight junction protein-2, Tjp-2)[8]. Tjp家族有3名成员, 分别为Tjp-1、Tjp-2和Tjp-3[9-11]. Tjps属于膜相关鸟苷酸激酶(membrane-associated guanylate kinase, MAGUK)的同分异构体, 参与组成上皮和内皮细胞结构[12]. Tjp与连接性跨膜蛋白(junctional transmembrane protein)的胞质侧C端结合, 使其与细胞骨架的肌动蛋白和信号转导通路分子连接[13]. 目前, 对于Tjp结构和生理学功能方面的研究取得了一定的进展[13], 但Tjp-2参与肿瘤侵袭转移, 尤其是细胞解离的相关机制尚未阐明[14,15]. 本研究分析Tjp-2的表达及细胞内定位变化与胰腺癌细胞解离的关系, 以明确Tjp-2参与胰腺癌细胞解离的作用机制.
PC-1细胞通过BOP诱导的叙利亚仓鼠实验性胰腺癌模型建立[16]. PC-1.0细胞是由同系仓鼠皮下接种PC-1细胞后产生的转移性肿瘤而建立[17,18]. 两种细胞均以RPMI 1640培养液(Gibco-BRL, Grand Island, NY)培养, 并加100 mL/L胎牛血清(Bioserum, Victoria, Australia)、100 kU/L青霉素G和100 mg/L链霉素, 并于含50 mL/L CO2的37 ℃孵箱内培养. 利用兔抗人Tjp-2及β-actin抗体(Santa Cruz Biotechnology, Santa Cruz, CA)作为一抗. 利用辣根过氧化物酶结合抗体和FITC标记的荧光抗体(Santa Cruz Biotechnology, Santa Cruz, CA)作为二抗.
1.2.1 RT-PCR: 以PTC-200 PCR反应仪 (Mjresearch公司, 美国)通过one-step法进行逆转录合成互补DNA(cDNA)第一链及PCR扩增. 合成cDNA第一链的总反应体积为25 μL, 取1 μg总RNA按说明书加入各种反应试剂, 条件如下: 95 ℃预变性5 min后进行30个循环的PCR扩增(94 ℃变性20 s, 63 ℃复性30 s, 72 ℃延伸60 s), 最后72 ℃后延伸7 min. PCR扩增用引物序列如下: Tjp-2(245 bp): 5'-GCAGAGCGAACGAAGAGTATGG(forward), 5'-TGACGGGATGTTGATGAGGGT(reverse); β-actin(664 bp): 5'-GTGGGGCGCCCCAGGCACCA(forward), 5'-CTCCTTAAGTCACGCACGATTCC(reverse). PCR扩增产物于1.5%琼脂糖凝胶中电泳, 溴化乙锭染色后紫外灯下观察.
1.2.2 细胞样本制备: 细胞在含100 mL/L胎牛血清的10 mL RPMI 1640培养液的90 mm细胞培养皿中培养. 为了明确Tjp-2蛋白表达变化及其与胰腺癌细胞解离的关系, 在非解离型低转移株细胞PC-1及解离型高转移株细胞PC-1.0中分别加入PC-1.0细胞的条件培养基(即DF-CM)和特异性MEK抑制剂U0126(Cell Signaling Technology, MA)[5,19]. 在活化实验中, PC-1细胞培养液中加入终浓度为40%的DF-CM后培养36 h. 在抑制实验中, PC-1.0细胞培养液中加入10 μmol/L U0126后培养36 h. 此外, 加入DF-CM培养36 h的PC-1细胞培养液中再加入10 μmol/L U0126后培养36 h. 细胞培养皿中加入1 mL RIPA蛋白裂解液(50 mmol/L Tris, 150 mmol/L NaCl, 1% NP-40, 0.5%脱氧胆酸钠, 0.1% SDS, pH7.5. 使用前加入1 mmol/L苯甲磺酰氟, 1 g/L亮肽酶素, 1 g/L抑肽酶), 冰上反应15 min. 4 ℃ 5 000 r/min离心5 min后将细胞裂解产物的上清液保存于-80 ℃中备用. 以β-actin作为内对照.
1.2.3 Western blot分析: Western blot实验步骤可参照前期实验[20]. 蛋白样本与4倍的加样缓冲液混合, 95 ℃加热. 取等量的20 μg样本行聚丙烯酰胺平板凝胶电泳, 利用PVDF膜(Bio-Rad), 以含5%脱脂牛奶和0.1% Tween-20的PBS液在室温下封闭转膜2 h, 然后用0.1% PBS/Tween-20稀释的一抗在4 ℃下培养过夜. 漂洗后用0.1% PBS/Tween-20以1:5000稀释马源性过氧化物酶结合的二抗, 室温下培养2 h. 利用柯达科学成像胶片(Eastman Kodak Company, Rochester, NY)通过化学发光法检测信号强度.
1.2.4 免疫荧光染色和荧光强度(fluorescence intensity, FI)分析: 上述细胞加入chamber slide中培养36 h. 加入DF-CM或U0126处理细胞, 以明确Tjp-2蛋白定位及Tjp-2表达与胰腺癌细胞解离的相关性. 细胞处理方法见1.2.2描述. 细胞加入DF-CM或U0126孵育后, 室温下以0.5%多聚甲醛固定10 min, 再以10%山羊血清阻滞30 min, 之后加入Tjp-2一抗(1:200, 以含1%小牛白蛋白的PBS液稀释)4 ℃孵育过夜. 再加入FITC标记的二抗室温孵育2 h. 固定后利用共聚焦激光显微镜(FV500-IX, Olympus, Japan)获取图像. 对照组标本制备如下: (1)切片不用一抗处理; (2)正常山羊血清和非特异山羊IgG代替Tjp-2一抗. 最后, 随机选取细胞核、细胞质、细胞膜及细胞总体的10个点, 利用Fluoview 500(version 3.3, Olympus, Japan)软件检测Tjp-2表达的FI值.
统计学处理 采用Stat View计算机软件(SAS Institute, Inc., Cary, NC)利用非配对Student's t检验分析不同实验组细胞核、细胞质、细胞膜及细胞总体10个点的Tjp-2表达的平均FI值. P<0.05认为差异具有显著性.
Tjp-2 mRNA在PC-1.0细胞中过度表达, 加入U0126培养24 h后Tjp-2 mRNA表达被明显抑制(图1A). Tjp-2 mRNA在PC-1细胞中表达则较弱. 加入DF-CM培养24 h后Tjp-2 mRNA表达明显增强. 经U0126培养12 h后再经DF-CM培养24 h则Tjp-2 mRNA表达无明显变化(图1B).
Western blot结果显示Tjp-2蛋白在PC-1.0细胞中高表达(图2A). 与Tjp-2 mRNA的表达相比, 经U0126培养36 h后Tjp-2蛋白的表达没有被抑制(图2A). 此外, 在PC-1细胞中Tjp-2蛋白的表达较弱(图2B). 但与Tjp-2 mRNA表达不同, 在PC-1细胞培养液中加入DF-CM未能诱导Tjp-2蛋白的表达增强(图2B).
在未处理的PC-1.0细胞中(图3A). Tjp-2蛋白主要分布于细胞质, 在细胞边缘及细胞核中表达较弱. 经U0126培养36 h后, 细胞间接触部位的Tjp-2蛋白表达显著增强(图3B). 与PC-1.0细胞相比, 未处理的PC-1细胞(图3C)中Tjp-2蛋白几乎全部分布于细胞间连接部位, 在细胞核及细胞质中表达较弱. 经DF-CM培养36 h后细胞间连接部位分布的Tjp-2蛋白明显减少(图3D). 但经DF-CM处理的PC-1细胞再经U0126培养36 h后Tjp-2蛋白再次向细胞连接部位聚集, 该部位Tjp-2蛋白表达增强(图3E).
PC-1.0细胞及PC-1细胞中Tjp-2蛋白表达的荧光强度(FI)值分析结果列于图4. PC-1.0细胞中整体细胞的Tjp-2的表达较强(平均FI = 1160.7±259.1, 图4A), 且Tjp-2蛋白主要定位于细胞质(FI = 3273.7±131.2), 在细胞核(FI = 139.0±115.7)和细胞边缘(FI = 69.5±38.0)几乎未检测到荧光. 经U0126处理24 h后, PC-1.0细胞中整体细胞的Tjp-2表达没有显著改变(平均FI = 1009.4±257.8, P>0.05). 但在细胞间连接部位(FI = 2814.8±297.0, P<0.05)的Tjp-2蛋白表达明显增强. 此外, 在细胞核(FI = 75.3±28.1, P>0.05)中Tjp-2表达没有显著变化, 而在细胞质(FI = 139.5±47.5, P<0.05)中Tjp-2蛋白表达显著减少.
PC-1细胞(图4B)中整体细胞的Tjp-2表达平均FI值为182.3±48.2. Tjp-2蛋白在细胞核(FI = 93.6±27.2)及细胞质(FI = 52.1±16.4)中表达较弱, 但在细胞间连接部位表达较强(FI = 401.5±41.3). 与未处理细胞相比, 经DF-CM培养36 h后整体细胞的Tjp-2蛋白表达未见明显改变 (平均FI = 207.1±35.4, P>0.05), 其中在细胞核(FI = 242.7±38.9, P<0.05)和细胞质(FI = 236.2±27.3, P<0.05)的Tjp-2表达显著增加, 在细胞间连接部位的Tjp-2表达明显减弱(FI = 135.6±15.8, P<0.05). 另外, 经U0126再培养36 h后PC-1细胞中细胞质的Tjp-2表达显著增加(FI = 169.1±20.0, P<0.05), 但在整体细胞中(平均FI = 238.5±31.6, P>0.05)、细胞核(FI = 163.7±37.3, P>0.05)及细胞间连接部位(FI = 382.6±34.1, P>0.05)Tjp-2表达的FI值变化不明显.
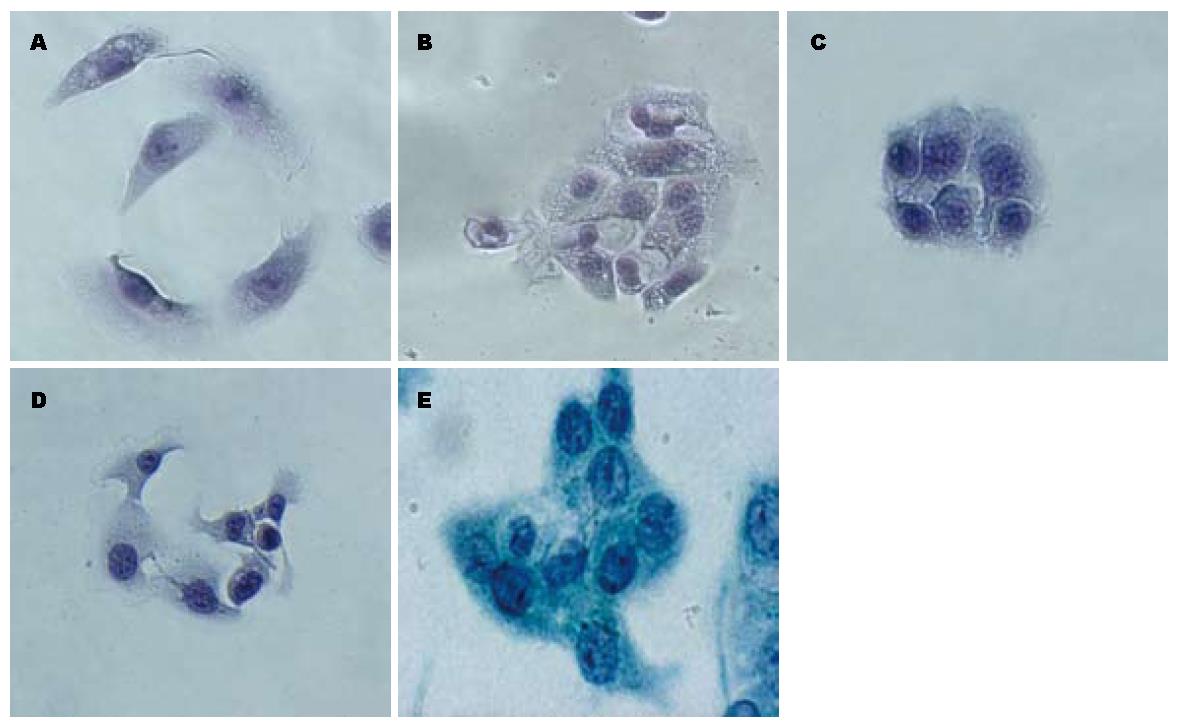
光学显微镜图像显示未处理PC-1.0细胞以单个细胞方式生长(图5A). 添加U0126培养36 h后PC-1.0细胞聚集成岛样细胞克隆方式生长(图5B). 与PC-1.0细胞不同, 未处理的PC-1细胞呈岛样细胞克隆方式生长(图5C). 而经过DF-CM培养36 h后PC-1细胞的岛样克隆解离, 表现为类似于PC-1.0细胞的形态学改变: 细胞解离, 并伴有细胞伸长和伪足形成(图5D). 另外, 已解离的PC-1细胞再加入U0126培养36 h后细胞则重新聚集成团, 形成岛样细胞克隆(图5E).
前期研究中我们发现胰腺癌细胞DF能够诱导MEK2/ERK2信号转导通路的活化和胰腺癌细胞的解离. 相反, MEK抑制剂U0126能抑制MEK2/ERK2信号转导通路的活化和胰腺癌细胞的解离[5,6]. 此外, 我们通过基因组学方法发现Tjp-2在解离型高转移株细胞PC-1.0与非解离型低转移株细胞PC-1间基因表达存在明显差异, 是与侵袭转移密切相关的基因之一[8].
本研究中我们证实了Tjp-2 mRNA在解离型高转移株细胞PC-1.0与非解离型低转移株细胞PC-1中表达的明显差异, 并发现DF和U0126能够分别增强和抑制Tjp-2 mRNA的表达. 提示Tjp-2可能参与胰腺癌细胞解离及其后侵袭转移过程的调控, 且Tjp-2基因表达可能受MEK2/ERK2信号转导通路调控.
另外, 虽然Tjp-2蛋白表达水平在PC-1.0和PC-1细胞中差异明显, 但是加入DF或U0126后Tjp-2蛋白水平变化不明显. 提示在胰腺癌细胞解离过程中Tjp-2的表达可能不仅受MEK2/ERK2信号转导通路调控, 还可能受到其他因素影响[21]. 而microRNA可能是其中的重要因素之一[22], 近年的文献报道microRNA可调控细胞内的翻译过程[23,24].
本研究中我们还发现DF和U0126能明显改变Tjp-2蛋白在细胞内的定位, 同时Tjp-2蛋白的细胞内定位和分布状态与胰腺癌细胞解离状态密切相关. 提示Tjp-2蛋白在细胞间连接部的定位在维持细胞紧密连接的稳定和防止胰腺癌细胞解离及其后的侵袭转移中可能发挥重要作用[25,26], Tjp-2蛋白的细胞内定位变化可能参与调控细胞解离及侵袭转移. 据文献报道, Tjp-2蛋白磷酸化状态的改变能够改变其细胞内定位[27-30]. 此外, 本研究结果提示Tjp-2蛋白在细胞核、细胞质及细胞膜的定位变化与MEK2/ERK2信号转导通路的活化(磷酸化)关系密切, Tjp-2蛋白的磷酸化状态变化可能通过MEK2/ERK2信号转导通路调控. 但Tjp-2蛋白磷酸化在胰腺癌细胞解离及侵袭转移调控机制中的作用未来需进一步深入研究.
总之, Tjp-2通过基因表达及细胞内定位的变化参与调控胰腺癌细胞解离. Tjp-2为开发针对胰腺癌侵袭转移的分子靶向治疗方法提供了一个具有重要价值的新靶点.
感谢日本熊本大学医学院消化器外科马场秀夫教授惠赠PC-1及PC-1.0胰腺癌细胞株.
肿瘤细胞从原发部位解离是肿瘤侵袭转移过程中最为重要的一步. 明确细胞解离的分子机制有助于阐明胰腺癌侵袭转移的分子机制, 并有利于开发针对胰腺癌侵袭转移的新型治疗方法并改善患者的预后.
曹杰, 主任医师, 广州医学院附属广州市第一人民医院胃肠外科; 谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科.
本研究应用cDNA微阵列分析筛选出在PC-1.0和PC-1细胞中与侵袭转移密切相关的差异表达基因Tjp-2. 对于Tjp结构和生理学功能方面的研究取得了一定的进展, 但Tjp-2参与肿瘤侵袭转移, 尤其是细胞解离的相关机制尚未阐明.
在胰腺癌细胞解离过程中Tjp-2的表达可能不仅受MEK2/ERK2信号转导通路调控, 还可能受到其他因素影响. 而据Goggins报道 microRNA可能是其中的重要因素之一. 此外, 近年Bloomston等报道microRNA可调控细胞内的翻译过程.
本研究中发现Tjp-2蛋白的细胞内定位和分布状态与胰腺癌细胞解离状态密切相关. 提示Tjp-2蛋白在细胞间连接部的定位在维持细胞紧密连接的稳定和防止胰腺癌细胞解离及其后的侵袭转移中可能发挥重要作用, Tjp-2蛋白的细胞内定位变化可能参与调控细胞解离及侵袭转移.
Tjp-2通过基因表达及细胞内定位的变化参与调控胰腺癌细胞解离. Tjp-2为开发针对胰腺癌侵袭转移的分子靶向治疗方法提供了一个具有重要价值的新靶点.
本研究立题依据充分, 结果准确, 有一定学术价值与创新性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Torimura T, Ueno T, Kin M, Harada R, Nakamura T, Kawaguchi T, Harada M, Kumashiro R, Watanabe H, Avraham R. Autocrine motility factor enhances hepatoma cell invasion across the basement membrane through activation of beta1 integrins. Hepatology. 2001;34:62-71. |
| 2. | Hirota M, Egami H, Corra S, Fujii H, Chaney WG, Rizzino A, Pour PM. Production of scatter factor-like activity by a nitrosamine-induced pancreatic cancer cell line. Carcinogenesis. 1993;14:259-264. |
| 3. | Kurizaki T, Egami H, Hirota M, Akagi J, Ohmachi H, Yamamoto S, Ogawa M. Characterization of cancer cell dissociation factor in a highly invasive pancreatic cancer cell line. Cancer. 1995;75:1554-1561. |
| 4. | Ishikawa S, Egami H, Kurizaki T, Akagi J, Tamori Y, Yoshida N, Tan X, Hayashi N, Ogawa M. Identification of genes related to invasion and metastasis in pancreatic cancer by cDNA representational difference analysis. J Exp Clin Cancer Res. 2003;22:299-306. |
| 5. | Tan X, Egami H, Kamohara H, Ishikawa S, Kurizaki T, Yoshida N, Tamori Y, Takai E, Hirota M, Ogawa M. Involvement of the mitogen-activated protein kinase kinase 2 in the induction of cell dissociation in pancreatic cancer. Int J Oncol. 2004;24:65-73. |
| 6. | Tan X, Egami H, Ishikawa S, Kurizaki T, Tamori Y, Takai E, Hirota M, Ogawa M. Relationship between the expression of extracellular signal-regulated kinase 1/2 and the dissociation of pancreatic cancer cells: Involvement of ERK1/2 in the dissociation status of cancer cells. Int J Oncol. 2004;24:815-820. |
| 7. | Tan X, Egami H, Ishikawa S, Nakagawa M, Ishiko T, Kamohara H, Hirota M, Ogawa M. Relationship between activation of epidermal growth factor receptor and cell dissociation in pancreatic cancer. Int J Oncol. 2004;25:1303-1309. |
| 8. | Tan X, Zhou L, Wang W, Wang B, Egami H, Baba H, Dai X. Genomic analysis of invasion-metastasis related factors in pancreatic cancer cells. Exp Ther Med. 2010;1:211-216. |
| 9. | Kiener TK, Sleptsova-Friedrich I, Hunziker W. Identification, tissue distribution and developmental expression of tjp1/zo-1, tjp2/zo-2 and tjp3/zo-3 in the zebrafish, Danio rerio. Gene. Expr Patterns. 2007;7:767-776. |
| 10. | Gumbiner B, Lowenkopf T, Apatira D. Identification of a 160-kDa polypeptide that binds to the tight junction protein ZO-1. Proc Natl Acad Sci U S A. 1991;88:3460-3464. |
| 11. | Singh D, Solan JL, Taffet SM, Javier R, Lampe PD. Connexin 43 interacts with zona occludens-1 and -2 proteins in a cell cycle stage-specific manner. J Biol Chem. 2005;280:30416-30421. |
| 12. | González-Mariscal L, Betanzos A, Avila-Flores A. MAGUK proteins: structure and role in the tight junction. Semin Cell Dev Biol. 2000;11:315-324. |
| 13. | Lapierre LA. The molecular structure of the tight junction. Adv Drug Deliv Rev. 2000;41:255-264. |
| 14. | Chlenski A, Ketels KV, Korovaitseva GI, Talamonti MS, Oyasu R, Scarpelli DG. Organization and expression of the human zo-2 gene (tjp-2) in normal and neoplastic tissues. Biochim Biophys Acta. 2000;1493:319-324. |
| 15. | Glaunsinger BA, Weiss RS, Lee SS, Javier R. Link of the unique oncogenic properties of adenovirus type 9 E4-ORF1 to a select interaction with the candidate tumor suppressor protein ZO-2. EMBO J. 2001;20:5578-5586. |
| 16. | Egami H, Takiyama Y, Cano M, Houser WH, Pour PM. Establishment of hamster pancreatic ductal carcinoma cell line (PC-1) producing blood group-related antigens. Carcinogenesis. 1989;10:861-869. |
| 17. | Egami H, Tomioka T, Tempero M, Kay D, Pour PM. Development of intrapancreatic transplantable model of pancreatic duct adenocarcinoma in Syrian golden hamsters. Am J Pathol. 1991;138:557-561. |
| 18. | Pour PM, Egami H, Takiyama Y. Patterns of growth and metastases of induced pancreatic cancer in relation to the prognosis and its clinical implications. Gastroenterology. 1991;100:529-536. |
| 19. | Tan X, Egami H, Nozawa F, Abe M, Baba H. Analysis of the invasion-metastasis mechanism in pancreatic cancer: involvement of plasmin(ogen) cascade proteins in the invasion of pancreatic cancer cells. Int J Oncol. 2006;28:369-374. |
| 20. | Tan X, Egami H, Ishikawa S, Sugita H, Kamohara H, Nakagawa M, Nozawa F, Abe M, Ogawa M. Involvement of matrix metalloproteinase-7 in invasion-metastasis through induction of cell dissociation in pancreatic cancer. Int J Oncol. 2005;26:1283-1289. |
| 21. | Avila-Flores A, Rendón-Huerta E, Moreno J, Islas S, Betanzos A, Robles-Flores M, González-Mariscal L. Tight-junction protein zonula occludens 2 is a target of phosphorylation by protein kinase C. Biochem J. 2001;360:295-304. |
| 22. | Goggins M. Identifying molecular markers for the early detection of pancreatic neoplasia. Semin Oncol. 2007;34:303-310. |
| 23. | Bloomston M, Frankel WL, Petrocca F, Volinia S, Alder H, Hagan JP, Liu CG, Bhatt D, Taccioli C, Croce CM. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA. 2007;297:1901-1908. |
| 24. | Cho WC. OncomiRs: the discovery and progress of microRNAs in cancers. Mol Cancer. 2007;6:60. |
| 25. | Métais JY, Navarro C, Santoni MJ, Audebert S, Borg JP. hScrib interacts with ZO-2 at the cell-cell junctions of epithelial cells. FEBS Lett. 2005;579:3725-3730. |
| 26. | Fink C, Weigel R, Hembes T, Lauke-Wettwer H, Kliesch S, Bergmann M, Brehm RH. Altered expression of ZO-1 and ZO-2 in Sertoli cells and loss of blood-testis barrier integrity in testicular carcinoma in situ. Neoplasia. 2006;8:1019-1027. |
| 27. | Sabath E, Negoro H, Beaudry S, Paniagua M, Angelow S, Shah J, Grammatikakis N, Yu AS, Denker BM. Galpha12 regulates protein interactions within the MDCK cell tight junction and inhibits tight-junction assembly. J Cell Sci. 2008;121:814-824. |
| 28. | Tsukamoto T, Nigam SK. Role of tyrosine phosphorylation in the reassembly of occludin and other tight junction proteins. Am J Physiol. 1999;276:F737-F750. |
| 29. | Adachi M, Inoko A, Hata M, Furuse K, Umeda K, Itoh M, Tsukita S. Normal establishment of epithelial tight junctions in mice and cultured cells lacking expression of ZO-3, a tight-junction MAGUK protein. Mol Cell Biol. 2006;26:9003-9015. |
| 30. | Martin TA, Watkins G, Mansel RE, Jiang WG. Loss of tight junction plaque molecules in breast cancer tissues is associated with a poor prognosis in patients with breast cancer. Eur J Cancer. 2004;40:2717-2725. |