修回日期: 2010-04-22
接受日期: 2010-04-27
在线出版日期: 2010-05-18
目的: 研究血清瘦素与结直肠癌突变癌基因的相关性, 探讨其参与结直肠癌发生发展的机制.
方法: 研究对象肿瘤组选择30例结直肠癌患者, 选择24名健康成年人作为对照组. 用双抗体夹心ABC-ELISA法测定血清的瘦素水平, 采用RT-PCR方法测定肿瘤标本的癌基因K-ras以及抑癌基因P53、APC和DCC的表达, 对各癌基因表达的差异与血清的瘦素水平做出相关性分析.
结果: 肿瘤APC抑癌基因表达阳性的患者血清瘦素水平要高于表达阴性者(3.78 µg/L±1.85 µg/L vs 2.41 µg/L±2.53 µg/L, P<0.05), 且随着血清瘦素水平的升高APC基因的表达强度也逐渐增加(P<0.05), 其余3种癌基因的表达与血清瘦素水平没有明显相关性(P>0.05).
结论: 瘦素参与结直肠癌发生发展的途径与抑癌基因APC的表达有关, 与癌基因K-ras及抑癌基因P53、DCC的表达无关.
引文著录: 黄哲, 沈名扬, 王俊江, 丛进春, 陈春生. 血清瘦素与结直肠癌相关癌基因表达的相关性. 世界华人消化杂志 2010; 18(14): 1509-1513
Revised: April 22, 2010
Accepted: April 27, 2010
Published online: May 18, 2010
AIM: To search possible pathways via which leptin participates in colorectal carcinogenesis by analyzing the correlation between serum leptin and oncogene expression.
METHODS: Serum leptin and adiponectin levels were measured by avidin-biotin-peroxidase complex enzyme-linked immunosorbent assay (ABC-ELLSA) in 30 colorectal cancer patients and 24 normal controls. The expression of K-ras, P53, adenomatous polyposis coli (APC) and deleted in colorectal carcinoma (DCC) mRNAs in tumor samples was detected by reverse transcription-polymerase chain reaction (RT-PCR). The correlation between oncogene expression and serum leptin and adiponectin was then analyzed.
RESULTS: The level of serum leptin was significantly higher in APC-positive patients than in APC-negative ones (3.78 µg/L ± 1.85 µg/L vs 2.41 µg/L ± 2.53 µg/L, P < 0.05), and the relative expression level of APC mRNA increased with the increase in serum leptin levels (P < 0.05). No significant correlation was noted between serum leptin and the expression of K-ras, P53 and DCC mRNAs in colorectal cancer (all P > 0.05).
CONCLUSION: There is a significant correlation between serum leptin level and APC expression in colorectal cancer. No significant correlation is noted between serum leptin level and the expression of K-ras, P53 and DCC mRNAs in colorectal cancer.
- Citation: Huang Z, Shen MY, Wang JJ, Cong JC, Chen CS. Correlation of serum leptin with oncogene expression in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1509-1513
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1509.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1509
流行病学调查显示在肥胖人群中癌症的患病风险明显增加[1,2], 其机制目前仍然不清楚. 瘦素作为肥胖基因的一种产物, 在肥胖人群中明显升高[3], 他被认为是可能与肿瘤发生发展密切相关的一种因素[4]. 瘦素是一个16 kDa的细胞因子, 他主要调节哺乳动物的食物摄入和能量消耗[5]. 虽然瘦素主要由脂肪组织产生, 不过近期的研究发现胃、乳腺、结肠以及肝脏等其他组织同样有瘦素的表达[6-9]. 离体实验的结果显示瘦素对不同的肿瘤细胞系可以作为一种促有丝分裂的、抗凋亡的和致使肿瘤生成的因子[10,11], 在对结直肠癌的研究中发现瘦素能够刺激肠癌细胞株HT-29的生长、增殖和原癌基因c-fos蛋白的表达, 同时干预试验中也观察到, 通过提高饮食中的脂肪含量可以引起瘦素浓度升高及脂肪组织的增加, 从而导致结肠细胞增生、c-fos蛋白表达和异变腺窝病灶(aberrant crypt foci, ACF)提高, 研究认为血清中瘦素浓度与结肠细胞的增生和ACF形成之间有明显的相关性[12]. 不过同样的研究, Ealey等的实验研究却发现瘦素在与结肠癌形成密切相关的ACF形成过程中并不起作用[13]. 目前在流行病学研究发现血清中的瘦素水平与乳腺癌[14]和前列腺癌[15]的发生发展有着密切关系, 不过在结直肠癌中的研究结果却充满争议[16]. 本研究首先通过酶联免疫方法测定结直肠癌患者血清中的瘦素表达, 然后用RT-PCR方法测定相应肿瘤标本的K-ras、P53、APC及DCC突变基因, 通过结直肠癌中的血清瘦素水平与肿瘤癌基因的相关性研究来探讨瘦素可能参与结直肠癌发生发展的机制.
实验所用的标本均来自中国医科大学附属盛京医院, 肿瘤组选择30例行结直肠癌手术的患者, 年龄64.3岁±13.2岁, 对照组选择24例在盛京医院体检中未发现肠道疾患的健康成年人, 年龄61.2岁±23.5岁.
1.2.1 标本采集: 所有血清标本均采自清晨空腹, 肿瘤组患者均采自手术前, 研究对象采血前均至少休息30 min, 采血后以2 000 r/min离心10 min后置于-80 ℃冰箱保存. 入选的肿瘤组患者术前均未接受过化疗、放疗或其他针对肿瘤的治疗, 所有的肿瘤标本均为手术中的新鲜标本, 采集后直接放入液氮罐中, 后转入-80 ℃冰箱保存.
1.2.2 血清瘦素水平的测定: 所有样本采用双盲法测定, 瘦素的水平测定采用双抗体夹心ABC-ELISA法, 试剂来自上海森雄科技实业有限公司, 重复性板内变异系数<10%, 板间变异系数<15%, 灵敏度最小可测0.06 µg/L, 在492 nm处测吸光度值.
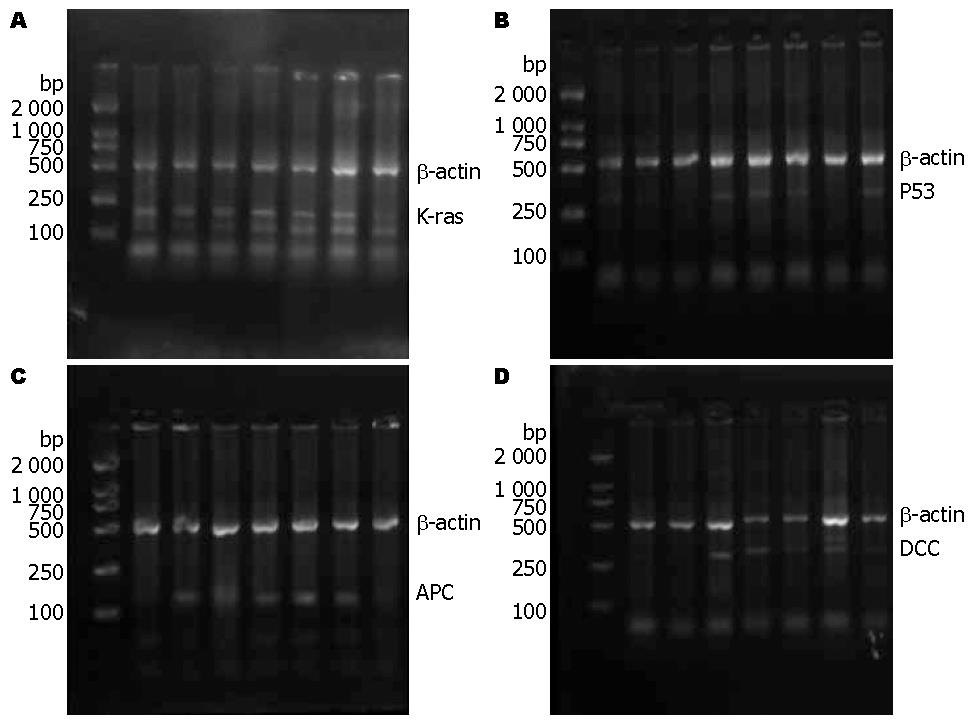
1.2.3 肿瘤标本的癌基因定量分析: 从美国国立图书馆Medline基因库检索基因全序列, 电脑软件Primer 5.0版自行设计, 由上海Invitrogon英骏生物技术有限公司合成引物(表1). PCR循环条件: 变性94 ℃、40s→退火(温度见表1)、1 min→延伸72 ℃、1 min. 将含有产物条带的电泳图谱扫入电脑, 用凝胶分析软件对条带进行分析, 读取其积分吸光度, 所得数值与β-actin平均值的比为表达强度, 从而对K-ras、P53、APC及DCC表达做出强度分析.
| 基因/内参 | 引物 | 长度(bp) | 温度(℃) |
| β-actin | β-actin-F 5'-GTG GGG CGC CCC AGG CAC CA-3' | 约498 | 55.5 |
| β-actin-R 5'-CTC CTT AAT GTC ACG CAC GAT TTC-3' | |||
| P53 | P53-F 5'-GTC TAC CTC CCG CCA TAA-3' | ||
| P53-R 5'-CAT CTC CCA AAC ATC CCT-3' | 约316 | 53.0 | |
| K-ras | K-ras-F 5'-GTG GTA GTT GGA GCT GGT G-3' | ||
| K-ras-R 5'-TAC TGG TCC CTC ATT GCA-3' | 约194 | 50.5 | |
| APC | APC-F 5'-CCA ACA AGG CTA CGC TAT-3' | ||
| APC-R 5'-CTG CTC GCC AAG ACA AAT-3' | 约126 | 49.8 | |
| DCC | DCC-F 5'-ATC CTG CTG TCG TGA GCG-3' | ||
| DCC-R 5'-CTG CGG AGT GGG TGA GTT-3' | 约301 | 56.2 |
统计学处理 由于数据呈偏态分布, 统计中采用非参数检验, 用ANOVA来分析肿瘤各癌基因阴阳性表达之间的差异, 瘦素与各癌基因的相关性研究采用五分位数法分析, P<0.05为差异有统计学意义.
研究中采用RT-PCR对肿瘤的癌基因表达进行强度分析, 其中没有癌基因表达的为阴性(图1), K-ras、P53、APC及DCC的阳性率分别为80%、50%、83.3%和73.3%, 表达阳性者的强度分别为0.85±0.29、0.87±0.31、0.77±0.35和0.81±0.28. 其中肿瘤APC表达阳性的患者血清中瘦素水平高于表达阴性表达者(P<0.05), 其他3个癌基因的阴阳性表达的对应血清瘦素水平没用统计学差异(表2). 由于结果中的血清瘦素水平呈现偏态分布, 在研究中采用五分位数法对瘦素与各癌基因阳性表达强度进行相关性分析, 其中APC基因随着血清瘦素水平的升高而表达强度逐渐增加(P<0.05), 其中Q4、Q5的APC表达强度要明显高于Q1、Q2(P<0.05), 而其余各癌基因表达强度与血清中瘦素水平没有明显相关性(表3).
| 基因 | 表达(%) | 血清瘦素(μg/L) | P值 |
| P53 | 阳性(50.0) | 3.38±2.31 | 0.787 |
| 阴性(50.0) | 3.77±2.53 | ||
| K-ras | 阳性(80.0) | 3.30±2.05 | 0.450 |
| 阴性(20.0) | 4.73±4.09 | ||
| DCC | 阳性(73.3) | 2.63±2.26 | 0.353 |
| 阴性(26.7) | 4.00±2.32 | ||
| APC | 阳性(83.3) | 3.78±1.85 | 0.034 |
| 阴性(16.7) | 2.41±2.53 |
| 基因 | 瘦素 | P值 | ||||
| Q1(0.66-2.05)(%) | Q2(2.06-3.44)(%) | Q3(3.45-4.83)(%) | Q4(4.84-6.22)(%) | Q5(6.23-7.62)(%) | ||
| K-ras1 | 0.88±0.21(75) | 0.73±0.16(77.8) | 0.87±0.28(75) | 0.76±0.26(80) | 0.93±0.19(100) | 0.659 |
| P531 | 0.87±0.26(25) | 0.79±0.27(66.7) | 0.76±0.21(50) | 0.92±0.18(40) | 0.93±0.27(75) | 0.541 |
| DCC1 | 0.97±0.30(50) | 0.82±0.21(77.8) | 0.76±0.17(100) | 0.95±0.20(40) | 0.76±0.18(75) | 0.362 |
| APC1 | 0.53±0.19(50) | 0.57±0.21(77.8) | 0.75±0.18(87.5) | 0.91±0.37(100) | 0.97±0.28(100) | 0.046 |
肥胖可以引起结直肠癌的患病风险增加, 与肥胖密切相关的瘦素被认为是促进肿瘤发生发展的因素, 不过瘦素到底是直接影响结直肠癌的发生发展, 还是被已经改变的肿瘤所影响, 抑或只是一个无关的旁观者, 这目前仍是一个尚未解决的课题.
对瘦素可能参与结直肠癌机制的研究中主要集中在离体实验中, 仍有争议. Hardwick等[10]对实验鼠注射鼠重组瘦素, 结果发现结肠上皮增殖较对照组明显增加, 而Chaudhary等[17]同样对小鼠注射瘦素后却发现上皮的增殖轻度下降. 有学者对瘦素水平升高的肥胖♂db/db小鼠和他们无脂肪的同胞仔进行对比研究, 同时予他们以结肠敏感性致癌物氧化偶氮甲烷(AOM)处理, 在5 wk后处死分析结肠的发育异常和早期的新生物病变, 结果显示db/db小鼠比他们的同胞仔出现更多的病变, 提示瘦素是结肠癌的一个启动因子[18]. 然而在另一项研究中, 予非肥胖♂小鼠以瘦素泵入, 在此同时用AOM诱导肿瘤前期ACF, 结果显示瘦素处理的小鼠出现的ACF要比正常对照组少得多[19]. 而Ealey等则通过对瘦素缺失小鼠的实验研究中认为瘦素在ACF的形成过程中并不起作用[13]. 由于在瘦素与ACF关系的研究中无法达成共识, 近期的研究转而集中于离体的肿瘤细胞, 其中发现在人类结肠癌细胞HT-29中, 瘦素具有促增殖作用, 同时能抑制细胞凋亡[20], 在APC基因突变型的结肠上皮细胞中, 瘦素能够通过旁分泌和自分泌来促进细胞的增殖[21], 在这些研究中的结肠上皮细胞癌变多采用APC基因突变来诱发, 另外对前列腺癌的研究中发现, 瘦素能够通过调节P53和Bcl-2的表达来干预肿瘤细胞的生长[20], 故而我们设想瘦素与肿瘤发生发展的关联是不是与这些突变基因有关?
目前对结直肠癌的癌基因研究, 公认的4个相关基因分别是癌基因K-ras和抑癌基因P53、APC及DCC, 在本研究中, 4种基因表达的阳性率分别是80.0%、50.0%、83.3%及73.3%. 结果显示APC抑癌基因阳性者对应的血清瘦素水平要明显高于表达阴性者, 而且随着瘦素水平的升高的APC基因的表达也逐渐增强, 其中Q4、Q5的APC表达强度要明显高于Q1、Q2, 这说明在结直肠癌中血清的瘦素水平与肿瘤的APC癌基因表达有明显的相关性. 至于是瘦素水平的升高引起APC基因突变的上调, 还是APC基因的改变引起瘦素水平的增加, 本项研究尚不能提供结果, 不过离体实验都是通过对APC基因突变的结肠上皮细胞增加瘦素水平来促进增殖, 所以可能是瘦素水平的增加而引起APC基因突变的上调, 这需要进一步的实验来证明. 另外在研究瘦素以及APC基因对肿瘤的作用机制中发现, 他们都能引起c-Myc和cyclin D1的转录, 从而加快细胞周期、促进细胞增殖促进肿瘤发生[22-25], 这进一步说明了瘦素与结直肠癌的相关性与APC抑癌基因的表达密不可分. 至于K-ras、P53、DCC其他3种基因, 本研究中未发现与瘦素表达有类似上述的相关性.
本项研究结果提示瘦素的水平与APC基因的表达有密切关系, 而APC是目前已知的唯一发生在结直肠癌整个癌变过程中的基因, 尤其在早期的腺瘤样变中, 本研究中没有结直肠腺瘤的病例, 需要进一步的深入研究.
瘦素与肥胖和胰岛素抵抗密切相关, 其主要功能是调节哺乳动物的食物摄入和能量消耗, 不过近年来发现瘦素在肿瘤的发生、发展中也起着重要作用.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科; 黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
瘦素与各种肿瘤的相关性近年来成为研究的热点, 多数研究集中在瘦素与各种肿瘤的临床表现型之间的相关性分析, 动物实验也是关于瘦素对肿瘤细胞增殖干预的探讨, 目前瘦素可能参与肿瘤发生、发展的机制仍不清楚.
实验室研究发现瘦素能够明显的加快细胞周期、促进细胞增殖从而促进肿瘤发生, 对于结直肠癌同样发现瘦素能够刺激肠癌细胞株HT-29的生长、增殖和原癌基因c-fos蛋白的表达, 从而促进肿瘤的形成.
本研究通过研究血清瘦素与结直肠癌突变癌基因K-ras、P53、APC和DCC表达的相关性, 探讨其可能参与结直肠癌发生发展的机制.
本文探讨了瘦素与结直肠癌相关癌基因表达的相关性, 对结直肠癌发病机制的相关研究提供了实验依据, 学术价值较好.
编辑: 李军亮 电编: 何基才
| 1. | Pan SY, Johnson KC, Ugnat AM, Wen SW, Mao Y. Association of obesity and cancer risk in Canada. Am J Epidemiol. 2004;159:259-268. [PubMed] [DOI] |
| 2. | Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003;348:1625-1638. [PubMed] [DOI] |
| 3. | Sauter ER, Garofalo C, Hewett J, Hewett JE, Morelli C, Surmacz E. Leptin expression in breast nipple aspirate fluid (NAF) and serum is influenced by body mass index (BMI) but not by the presence of breast cancer. Horm Metab Res. 2004;36:336-340. [PubMed] [DOI] |
| 4. | Garofalo C, Surmacz E. Leptin and cancer. J Cell Physiol. 2006;207:12-22. [PubMed] [DOI] |
| 5. | Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994;372:425-432. [PubMed] [DOI] |
| 6. | Hong SJ, Kwon KW, Kim SG, Ko BM, Ryu CB, Kim YS, Moon JH, Cho JY, Lee JS, Lee MS. Variation in expression of gastric leptin according to differentiation and growth pattern in gastric adenocarcinoma. Cytokine. 2006;33:66-71. [PubMed] [DOI] |
| 7. | Smith-Kirwin SM, O'Connor DM, De Johnston J, Lancey ED, Hassink SG, Funanage VL. Leptin expression in human mammary epithelial cells and breast milk. J Clin Endocrinol Metab. 1998;83:1810-1813. [PubMed] [DOI] |
| 8. | Koda M, Sulkowska M, Kanczuga-Koda L, Surmacz E, Sulkowski S. Overexpression of the obesity hormone leptin in human colorectal cancer. J Clin Pathol. 2007;60:902-906. [PubMed] [DOI] |
| 9. | Wang SN, Yeh YT, Yang SF, Chai CY, Lee KT. Potential role of leptin expression in hepatocellular carcinoma. J Clin Pathol. 2006;59:930-934. [PubMed] [DOI] |
| 10. | Hardwick JC, Van Den Brink GR, Offerhaus GJ, Van Deventer SJ, Peppelenbosch MP. Leptin is a growth factor for colonic epithelial cells. Gastroenterology. 2001;121:79-90. [PubMed] [DOI] |
| 11. | Aparicio T, Kotelevets L, Tsocas A, Laigneau JP, Sobhani I, Chastre E, Lehy T. Leptin stimulates the proliferation of human colon cancer cells in vitro but does not promote the growth of colon cancer xenografts in nude mice or intestinal tumorigenesis in Apc(Min/+) mice. Gut. 2005;54:1136-1145. [PubMed] [DOI] |
| 12. | Liu Z, Uesaka T, Watanabe H, Kato N. High fat diet enhances colonic cell proliferation and carcinogenesis in rats by elevating serum leptin. Int J Oncol. 2001;19:1009-1014. [PubMed] [DOI] |
| 13. | Ealey KN, Lu S, Archer MC. Development of aberrant crypt foci in the colons of ob/ob and db/db mice: evidence that leptin is not a promoter. Mol Carcinog. 2008;47:667-677. [PubMed] [DOI] |
| 14. | Falk RT, Brinton LA, Madigan MP, Potischman N, Sturgeon SR, Malone KE, Daling JR. Interrelationships between serum leptin, IGF-1, IGFBP3, C-peptide and prolactin and breast cancer risk in young women. Breast Cancer Res Treat. 2006;98:157-165. [PubMed] [DOI] |
| 15. | Stattin P, Söderberg S, Hallmans G, Bylund A, Kaaks R, Stenman UH, Bergh A, Olsson T. Leptin is associated with increased prostate cancer risk: a nested case-referent study. J Clin Endocrinol Metab. 2001;86:1341-1345. [PubMed] [DOI] |
| 16. | Slattery ML, Wolff RK. Leptin and colorectal cancer: an undefined link. Nat Clin Pract Gastroenterol Hepatol. 2007;4:118-119. [PubMed] [DOI] |
| 17. | Chaudhary M, Mandir N, FitzGerald AJ, Howard JK, Lord GM, Ghatei MA, Bloom SR, Goodlad RA. Starvation, leptin and epithelial cell proliferation in the gastrointestinal tract of the mouse. Digestion. 2000;61:223-229. [PubMed] [DOI] |
| 18. | Hirose Y, Hata K, Kuno T, Yoshida K, Sakata K, Yamada Y, Tanaka T, Reddy BS, Mori H. Enhancement of development of azoxymethane-induced colonic premalignant lesions in C57BL/KsJ-db/db mice. Carcinogenesis. 2004;25:821-825. [PubMed] [DOI] |
| 19. | Aparicio T, Guilmeau S, Goiot H, Tsocas A, Laigneau JP, Bado A, Sobhani I, Lehy T. Leptin reduces the development of the initial precancerous lesions induced by azoxymethane in the rat colonic mucosa. Gastroenterology. 2004;126:499-510. [PubMed] [DOI] |
| 20. | Mistry T, Digby JE, Desai KM, Randeva HS. Leptin and adiponectin interact in the regulation of prostate cancer cell growth via modulation of p53 and bcl-2 expression. BJU Int. 2008;101:1317-1322. [PubMed] [DOI] |
| 21. | Fenton JI, Lavigne JA, Perkins SN, Liu H, Chandramouli GV, Shih JH, Hord NG, Hursting SD. Microarray analysis reveals that leptin induces autocrine/paracrine cascades to promote survival and proliferation of colon epithelial cells in an Apc genotype-dependent fashion. Mol Carcinog. 2008;47:9-21. [PubMed] [DOI] |
| 22. | He TC, Sparks AB, Rago C, Hermeking H, Zawel L, da Costa LT, Morin PJ, Vogelstein B, Kinzler KW. Identification of c-MYC as a target of the APC pathway. Science. 1998;281:1509-1512. [PubMed] [DOI] |
| 23. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] [DOI] |
| 24. | Dieudonne MN, Machinal-Quelin F, Serazin-Leroy V, Leneveu MC, Pecquery R, Giudicelli Y. Leptin mediates a proliferative response in human MCF7 breast cancer cells. Biochem Biophys Res Commun. 2002;293:622-628. [PubMed] [DOI] |
| 25. | Garofalo C, Sisci D, Surmacz E. Leptin interferes with the effects of the antiestrogen ICI 182,780 in MCF-7 breast cancer cells. Clin Cancer Res. 2004;10:6466-6475. [PubMed] [DOI] |