修回日期: 2010-04-20
接受日期: 2010-05-10
在线出版日期: 2010-05-18
目的: 筛选稳定干扰Pin1的食管癌细胞系, 研究Pin1表达与食管癌细胞生物学特征的关系.
方法: 将针对Pin1基因的shRNA(pmU6-Pin1)转染入EC1细胞, 经G418加压筛选稳定表达Pin1小干扰RNA的细胞株, 用免疫印迹法检测细胞中Pin1的表达, 确定筛选细胞系的正确性. 通过MTT实验以及流式细胞仪检测Pin1抑制对食管癌细胞增殖、凋亡的影响.
结果: Western blot检测结果显示, Pin1蛋白表达被成功抑制, 建立了稳定表达Pin1小干扰RNA的细胞株(shPin1). 与正常EC1细胞比较, MTT实验和流式细胞术实验结果表明基因沉默Pin1抑制食管癌细胞增殖(抑制率为51.8%), 诱导细胞凋亡(凋亡率为46.39%); 并增加了食管癌细胞EC1对顺铂的敏感性, 抑制食管癌细胞增殖以及诱导细胞凋亡的能力均有所增强, 抑制率从23.5%上升到61.0%, 凋亡率从26.10%上升到58.95%.
结论: 稳定干扰Pin1食管癌细胞系的建立为进一步研究Pin1在食管癌中的作用提供了研究平台; 基因沉默Pin1增加了食管癌细胞对顺铂的敏感性.
引文著录: 李玲, 陈平, 连鸿凯, 赵继敏, 马俊芬, 董子明. 稳定干扰Pin1基因的食管癌细胞株的筛选及其生物学特征. 世界华人消化杂志 2010; 18(14): 1485-1488
Revised: April 20, 2010
Accepted: May 10, 2010
Published online: May 18, 2010
AIM: To screen stable peptidyl-prolyl cis/trans isomerase (Pin1)-knockdown esophageal squamous cell carcinoma cell strains and to study the effects of Pin1 down-regulation on the biological characteristics of esophageal squamous cell carcinoma cells (EC1).
METHODS: After EC1 cells were transfected with pmU6-Pin1 plasmid, cell strains stably expressing Pin1 siRNA were selected in the presence of G418. The expression of Pin1 protein was detected by Western blotting. After stable Pin1-knockdown cell strains were obtained, the impact of Pin1 knockdown on cell growth and apoptosis was detected by MTT assay and flow cytometry, respectively.
RESULTS: Western blot analysis showed that the expression of Pin1 protein was effectively inhibited in EC1 cell strains stably expressing Pin1 siRNA. MTT assay and flow cytometry showed that Pin1 knockdown inhibited cell proliferation (the reduced rate of cell proliferation: 51.8%) and induced cell apoptosis (apoptosis rate: 46.39%). Inhibition of Pin1 could significantly increase the sensitivity of EC1 to cisplatin (CDDP) since the reduced rate of cell proliferation increased from 23.5% to 61.0% and the apoptosis rate from 26.10% to 58.95%.
CONCLUSION: Stable Pin1-knockdown esophageal squamous cell carcinoma cell strains provide a basis for studying Pin1 function in esophageal squamous cell carcinoma. The observation that Pin1 knockdown could increase the sensitivity of EC1 cells to CDDP provides new insight into the therapy of esophageal squamous cell carcinoma.
- Citation: Li L, Chen P, Lian HK, Zhao JM, Ma JF, Dong ZM. Screening and characterization of stable Pin1-knockdown esophageal squamous cell carcinoma cell strains. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1485-1488
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1485.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1485
肽酰-脯氨酰顺反异构酶(Pinl)特异性地识别蛋白质分子中已磷酸化的丝氨酸/苏氨酸-脯氨酸(pSer/Thr-Pro)基序, 催化其肽键构型改变, 影响磷酸化蛋白的功能[1,2]. Pin1的作用底物涉及有丝分裂蛋白、细胞骨架蛋白、转录因子蛋白以及凋亡蛋白等, 与多种肿瘤的发生密切相关[3-5]. 阻抑Pinl的功能或减少其表达将能有效地抑制癌症的发生和肿瘤的进程[6]. 顺铂(CDDP)是治疗癌症的常用药物之一. 但一些肿瘤细胞对顺铂产生耐药性, 限制了顺铂的临床应用. 本研究利用RNA干扰技术, 通过药物筛选, 得到稳定特异性抑制Pin1的食管癌细胞系, 检测对食管癌细胞增殖、凋亡的影响; 同时检测对常用化疗药物顺铂的敏感度, 以期找到一种新的食管癌治疗策略.
食管癌细胞系EC1由本教研室保存; Lipofectamine 2000购自Invitrogen; 四氮唑蓝(MTT)、二甲基亚砜(DMSO)购自Sigma公司; 顺铂(CDDP)购自云南生物谷灯盏花药业有限公司; G418购自北京索来宝公司; Annexin V-FITC/PI凋亡检测试剂盒购自郑州宝赛生物有限公司.
1.2.1 药物配制: 将顺铂(CDDP)配制成终浓度为2 mg/L的工作液; 将G418配制成100 g/L的储存浓度, 贮存于-20 ℃.
1.2.2 针对Pin1基因shRNA序列的设计及shRNA表达载体的构建及鉴定: 构建的干扰质粒命名为pmU6-Pin1; 构建的阴性对照干扰质粒命名为pmU6-4A.
1.2.3 稳定细胞系筛选: 将EC1细胞接种于6孔板, 待其生长至60%-70%融合时转染, 方法遵循Lipofectamine 2000操作手册. 48 h后细胞消化传代, 24 h细胞贴壁后加入含400 mg/L G418的1640培养基, 筛选稳定转染细胞. 待出现G418抗性克隆时, 将克隆通过96孔板进行单克隆化, 筛选稳定表达Pin1小干扰RNA的细胞系.
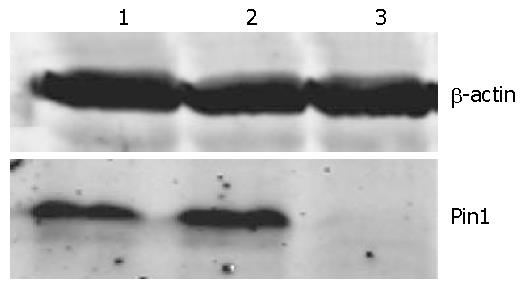
1.2.4 蛋白印迹法检测Pin1蛋白表达: 分别提取基因沉默细胞系以及对照细胞系, 进行细胞裂解和蛋白提取, 测定蛋白浓度. 通过15% SDS-PAGE分离后转至PVDF膜上, 4 ℃封闭过夜, 分别加Pin1(R&D)和β-actin抗体(Santa Cruz)室温孵育2 h, 0.05% PBST溶液洗膜, 加入红外标记的二抗(LI-COR公司)室温孵育1 h, 0.05% PBST洗膜后使用红外扫描检测膜上印迹的蛋白.
1.2.5 MTT比色法测定细胞的生长抑制率: 取对数生长期的食管癌EC1细胞以及基因沉默Pin1细胞系, 接种于96孔板, 分4组: 对照组(EC1组)、CDDP组、基因沉默Pin1细胞组以及基因沉默Pin1+CDDP组. 细胞贴壁后, 按分组情况相应加入2 g/L的CDDP, 48 h后分别加入MTT(5 g/L)20 μL, 37 ℃温育4 h后弃培养液, 加DMSO 150 μL, 振荡10 min, 结晶完全溶解. 在酶标仪上于570 nm波长测吸光度(A)值, 空白对照调零. 并按照下面公式计算各组对EC1细胞增殖活力的抑制: 细胞抑制率(%) = (阴性对照组A值-实验组A值/阴性对照组A值)×100%.
1.2.6 流式细胞仪(FCM)测定细胞凋亡: 取对数生长期的食管癌EC1细胞以及基因沉默Pin1细胞系, 接种到6孔培养板上, 分组同上. 待细胞贴壁后, 按分组相应的加入2 g/L的CDDP, 48 h后收集细胞. 按照试剂盒说明书步骤处理细胞后, 直接采用FACSort流式细胞仪(美国BD公司产品)进行检测分析. 实验设置相应的对照组.
统计学处理 所有实验均重复3次, 数据以-t-s表示, 统计学分析均使用SigmaPlot软件进行处理, 各组间均数的比较采用t检验, 0.05为显著性水平界值.
Western blot实验结果显示, 与未处理组细胞相比, 转染质粒pmU6-4A组的EC1细胞中Pin1蛋白表达水平无明显变化; 稳定转染pmU6-Pin1质粒的细胞系, 与其他两对照组细胞比较, 对靶蛋白的沉默效果明显, 其表达抑制率达到了90%以上(图1).
EC1细胞以及基因沉默Pin1的EC1细胞系, 经CDDP处理48 h后, MTT法检测细胞增殖的变化, 结果见表1. 将EC1细胞组作为对照组, 基因沉默Pin1的细胞组显著抑制了食管癌细胞的增殖(抑制率为51.8%), 并且增强了顺铂抑制食管癌EC1细胞增殖的能力(抑制率为61.0%), 与空白对照组以及CDDP组、shPin1组分别比较, 差异均具有统计学意义(P<0.05).
| 对照组 | CDDP组 | shPin1组 | shPin1+CDDP组 | |
| A值 | 1.2327±0.01 | 0.9426±0.03 | 0.5945±0.05 | 0.4802±0.01 |
| 抑制率(%) | 0.0 | 23.5 | 51.8 | 61.0 |
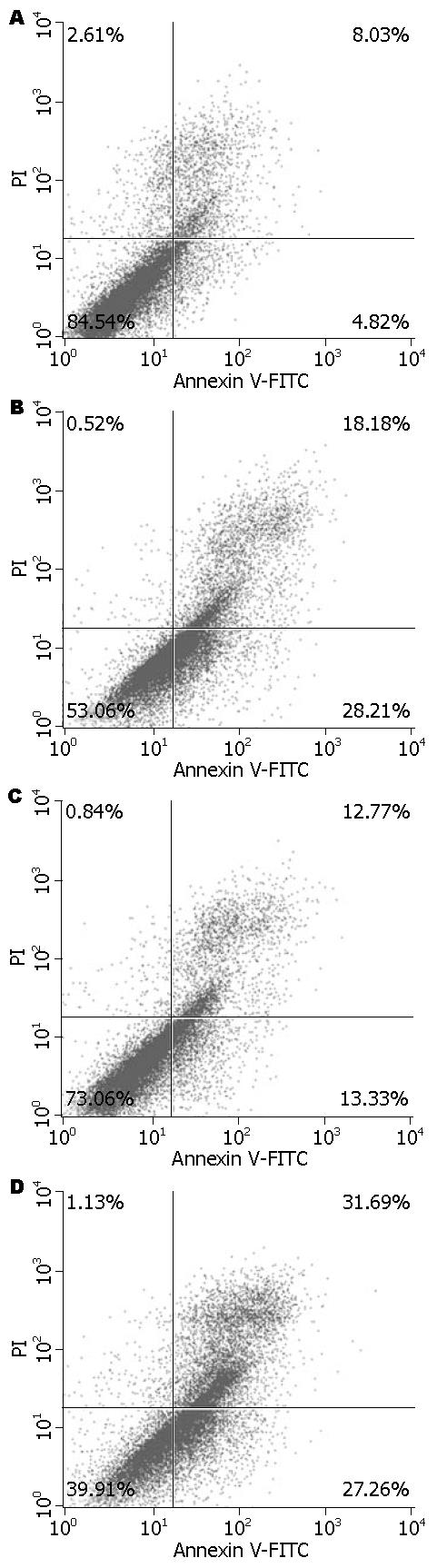
EC1细胞以及基因沉默Pin1的EC1细胞系, 经CDDP处理48 h后, 流式细胞仪检测细胞凋亡率的变化, 结果见表2, 图2. 基因沉默Pin1后增强了EC1细胞的凋亡率(46.39%), 并且增加了EC1细胞对顺铂的敏感性, 诱导细胞的凋亡率从26.10%增加到了58.95%.
| 对照组 | CDDP组 | shPin1组 | shPin1+CDDP组 | |
| UR | 8.03 | 12.77 | 18.18 | 31.69 |
| LR | 4.82 | 13.33 | 28.21 | 27.26 |
| 总凋亡率(UR+LR) | 12.85 | 26.10 | 46.39 | 58.95 |
Pin1在许多肿瘤中过度表达, 被称为肿瘤发生的催化分子[7]. 为了进一步了解Pin1在食管癌发生中的作用, 我们通过构建特异性靶向Pin1的干扰质粒, 将其导入食管癌EC1细胞, 经过G418药物筛选获得了稳定沉默Pin1表达的食管癌细胞株, 并测定了基因沉默Pin1后对食管癌细胞增殖、凋亡的影响. 结果显示, 抑制Pin1可以抑制食管癌细胞的增殖、诱导细胞凋亡, 为我们更深入地研究Pin1在食管癌发生中的作用机制奠定了基础.
手术后化疗是食管癌重要的辅助治疗措施[8], 但由于肿瘤细胞对化疗药物的耐药性, 大大增加了食管癌治疗的难度. 如何提高化疗药物的敏感性, 具有重要的临床意义. 随着科技的发展, 信号转导通路中的信号分子逐渐成为癌症靶向治疗中具有发展潜力的治疗方式[9]. 许多方面的证据表明Pin1是一个具有潜力的癌症药物治疗靶标, 抑制Pin1可以自发的抑制多条原癌信号通路[10,11].
DNA损伤在食管癌的发病机制中占有重要地位[12]. 各种DNA损伤性应激刺激细胞所导致的细胞周期阻滞或凋亡, 是因为野生型p53的作用所致. 而野生型p53的积聚与稳定, 是由Pin1所调节的[5,13,14]. 顺铂作为DNA损伤剂, 其作用机制在于引起DNA复制障碍, 诱导细胞凋亡, 并且这种凋亡为p53依赖性的[15]. 因此我们推测抑制Pin1可能增强肿瘤细胞对顺铂的敏感性. 本研究结果证实了这一推测. 基因沉默Pin1可以提高CDDP抑制细胞增殖、诱导细胞凋亡的能力, 二者抑制食管癌细胞增殖、诱导食管癌细胞凋亡的效应叠加可提高抗肿瘤的疗效, 为探讨食管癌治疗中常规化疗药结合特异性信号通路阻断的治疗新策略提供思路与理论依据.
Pin1的作用底物涉及有丝分裂蛋白、细胞骨架蛋白、转录因子蛋白以及凋亡蛋白等, 与多种肿瘤的发生密切相关. 阻抑Pinl的功能或减少其表达将能有效地抑制癌症的发生和肿瘤的进程. 顺铂(CDDP)是治疗癌症的常用药物之一. 但一些肿瘤细胞对顺铂产生耐药性, 限制了顺铂的临床应用. 本研究利用RNA干扰技术, 通过药物筛选, 得到稳定特异性抑制Pin1的食管癌细胞系, 检测对食管癌细胞增殖、凋亡的影响; 同时检测对常用化疗药物顺铂的敏感度, 以期找到一种新的食管癌治疗策略.
李增山, 副教授, 中国人民解放军第四军医大学病理教研室
手术后化疗是食管癌重要的辅助治疗措施, 但由于肿瘤细胞对化疗药物的耐药性, 大大增加了食管癌治疗的难度. 如何提高化疗药物的敏感性, 具有重要的临床意义.
基因沉默Pin1可以提高CDDP抑制细胞增殖、诱导细胞凋亡的能力, 二者抑制食管癌细胞增殖、诱导食管癌细胞凋亡的效应叠加可提高抗肿瘤的疗效.
本研究通过抑制Pin1在食管癌细胞系EC1中的表达, 发现可抑制细胞的增殖, 并提高对化疗药物的敏感性, 为探讨Pin1在食管癌中的治疗作用提供了一定的研究基础.
编辑: 李军亮 电编: 何基才
| 1. | Lu KP, Zhou XZ. The prolyl isomerase PIN1: a pivotal new twist in phosphorylation signalling and disease. Nat Rev Mol Cell Biol. 2007;8:904-916. [PubMed] [DOI] |
| 2. | Yeh ES, Means AR. PIN1, the cell cycle and cancer. Nat Rev Cancer. 2007;7:381-388. [PubMed] [DOI] |
| 3. | Wulf G, Garg P, Liou YC, Iglehart D, Lu KP. Modeling breast cancer in vivo and ex vivo reveals an essential role of Pin1 in tumorigenesis. EMBO J. 2004;23:3397-3407. [PubMed] [DOI] |
| 4. | Fukuchi M, Fukai Y, Kimura H, Sohda M, Miyazaki T, Nakajima M, Masuda N, Tsukada K, Kato H, Kuwano H. Prolyl isomerase Pin1 expression predicts prognosis in patients with esophageal squamous cell carcinoma and correlates with cyclinD1 expression. Int J Oncol. 2006;29:329-334. [PubMed] [DOI] |
| 5. | Wulf GM, Liou YC, Ryo A, Lee SW, Lu KP. Role of Pin1 in the regulation of p53 stability and p21 transactivation, and cell cycle checkpoints in response to DNA damage. J Biol Chem. 2002;277:47976-47979. [PubMed] [DOI] |
| 6. | Ryo A, Uemura H, Ishiguro H, Saitoh T, Yamaguchi A, Perrem K, Kubota Y, Lu KP, Aoki I. Stable suppression of tumorigenicity by Pin1-targeted RNA interference in prostate cancer. Clin Cancer Res. 2005;11:7523-7531. [PubMed] [DOI] |
| 9. | Druker BJ. Perspectives on the development of a molecularly targeted agent. Cancer Cell. 2002;1:31-36. [PubMed] [DOI] |
| 10. | Ryo A, Liou YC, Lu KP, Wulf G. Prolyl isomerase Pin1: a catalyst for oncogenesis and a potential therapeutic target in cancer. J Cell Sci. 2003;116:773-783. [PubMed] [DOI] |
| 11. | Ryo A, Nakamura M, Wulf G, Liou YC, Lu KP. Pin1 regulates turnover and subcellular localization of beta-catenin by inhibiting its interaction with APC. Nat Cell Biol. 2001;3:793-801. [PubMed] [DOI] |
| 12. | 赵 继敏, 路 静, 刘 康栋, 王 瑾瑾, 杨 洪艳, 黄 幼田, 董 子明. 互隔交链孢酚通过PKA-CREB信号通路激活NIH3T3细胞中DNA聚合酶β表达. 中国病理生理杂志. 2009;25:744-748. |
| 13. | Zheng H, You H, Zhou XZ, Murray SA, Uchida T, Wulf G, Gu L, Tang X, Lu KP, Xiao ZX. The prolyl isomerase Pin1 is a regulator of p53 in genotoxic response. Nature. 2002;419:849-853. [PubMed] [DOI] |