修回日期: 2010-04-21
接受日期: 2010-05-10
在线出版日期: 2010-05-18
目的: 探讨5-羟色胺转运体蛋白(SERT)在内脏高敏感性中的作用, 为功能性胃肠病的发病机制研究提供理论基础.
方法: 采用乳鼠醋酸灌肠建立大鼠慢性内脏高敏感动物模型, 同时设立对照组. 待乳鼠成年后应用直肠内球囊扩张评估腹壁撤离反射(AWR)的方法, 评估其内脏敏感性; 检测髓过氧化物酶(MPO)评价其肠道黏膜炎症程度; 用RT-PCR方法评价大鼠结肠SERT的mRNA水平, 免疫组织化学方法评价大鼠结肠SERT的表达; 用ELISA方法检测血浆和结肠组织5-HT水平.
结果: 乳鼠醋酸灌肠建立的大鼠慢性内脏高敏感模型组与对照组相比HE染色显示结肠黏膜未见明显急、慢性炎症改变; 两组大鼠结肠组织MPO水平没有显著性差异; 在不同容量下的AWR评分慢性内脏高敏感模型组显著高于对照组(P<0.01). 血浆5-HT水平慢性内脏高敏感模型组明显高于对照组(95.75±15.99 vs 72.17±8.01, P<0.01), 而两组结肠组织5-HT含量没有明显差异. 免疫组织化学研究显示内脏高敏感模型组结肠上皮SERT表达水平显著低于对照组(0.187±0.010 vs 0.191±0.011, P<0.01), 而其结肠SERT mRNA水平显著高于对照组(16.02±3.7 vs 10.05±2.12, P<0.01).
结论: 内脏高敏感大鼠外周5-HT水平的增高主要来源于其灭活的减少而非合成的增加, 与SERT的关系密切, 结肠SERT可能具有不同的亚型和功能.
引文著录: 孙程程, 迟雁, 王化虹, 谢鹏雁. 内脏高敏感大鼠结肠5-羟色胺转运体蛋白的表达. 世界华人消化杂志 2010; 18(14): 1428-1433
Revised: April 21, 2010
Accepted: May 10, 2010
Published online: May 18, 2010
AIM: To determine whether colonic serotonin transporter (SERT) expression is altered in rats with visceral hypersensitivity and to explore the possible mechanism underlying the pathogenesis of visceral hypersensitivity.
METHODS: A rat model of visceral hypersensitivity was created by intracolonic injection of acetic acid between postnatal days 8 and 21. The expression of SERT mRNA and protein in the colonic epithelium was detected by RT-PCR and immunohistochemistry, respectively. The levels of serotonin in plasma and colonic tissue were also measured.
RESULTS: Colon irritation in neonates resulted in chronic visceral hypersensitivity in the absence of identifiable peripheral pathology. Under different capacities the abdominal withdrawal reflex (AWR) score in rats with chronic visceral hypersensitivity was significantly higher than that in controls (P < 0.01). Although plasma serotonin content significantly increased in rats with visceral hypersensitivity compared to controls (95.75 ± 15.99 vs 72.17 ± 8.01, P < 0.01), no significant difference was noted in colonic serotonin content between the two groups. SERT immunoreactivity in colonic epithelium was significantly reduced in rats with visceral hypersensitivity (0.187 ± 0.010 vs 0.191 ± 0.011, P < 0.01), whereas a significant increase was noted in SERT mRNA level in the colon of rats with visceral hypersensitivity compared to controls (16.02 ± 3.7 vs 9.47 ± 2.34, P < 0.05).
CONCLUSION: In visceral hypersensitivity, the increase in serotonin content is mainly due to decreased degradation of the protein. The expression and function of SERT may be different in serotonergic neurons compared to colonic epithelial mucosa cells.
- Citation: Sun CC, Chi Y, Wang HH, Xie PY. Serotonin transporter expression in rats with chronic visceral hypersensitivity. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1428-1433
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1428.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1428
目前, 内脏高敏感性被认为是胃肠道功能性疾病最重要的病生理改变之一[1], 其机制迄今为止仍未完全阐明. 近年来一些研究揭示了胃肠道功能性疾病中5-羟色胺(5-hydroxytryptamine, 5-HT)信号系统的改变[2-6]. 5-HT转运体蛋白(serotonin transporter, SERT)作为5-HT失活最重要的蛋白, 是影响局部5-HT浓度及其生物活性的重要物质, 选择性5-HT再摄取抑制剂可作用于5-HT转运体, 抑制5-HT的再摄取, 增高突触间隙中的5-HT浓度, 在临床应用中发现此类药能有效缓解一些IBS患者的症状, 尤其是腹痛症状[7], 因而SERT可能在内脏高敏感性的产生过程中起到重要的作用. 目前对SERT在胃肠道功能性疾病中的表达所进行的研究结果差异很大, 内脏高敏感性与SERT表达的关系的研究甚少. 本文采用幼年早期的胃肠道刺激建立慢性内脏高敏感模型, 通过这个模型, 检测SERT的表达及外周和结肠局部5-HT水平, 探讨SERT在内脏高敏感性中的作用, 为SERT在内脏高敏感性中的作用提供理论依据, 并为功能性胃肠病的发病机制研究提供理论基础.
新生SD大鼠, ♂, 每10-12只与其母鼠共同饲养在同一箱内, 发育至25 d后, 将母鼠与幼鼠分离. 分离后的大鼠每笼4只, 自由饮水、喂以标准饲料. 所有大鼠均在安静室温下饲养, 室温25 ℃昼夜控制为12 h周期. 实验用大鼠由北大医院实验动物中心提供. ELISA试剂盒购自ADL公司, 兔抗5-HT转运体购自Merck公司, 髓过氧化物酶(MPO)检测试剂盒购自南京建成生物研究所, TRIzol购自美国Invitrogen公司, dNTP购自Gibco公司, 逆转录酶M-MLV、随机引物购自美国Promega公司. 引物和探针序列由上海生工生物工程有限公司合成, 余试剂均为市售分析纯.
1.2.1 大鼠高敏感模型的建立: 参照Al-Chaer以及刘雁冰等的方法[8,9], 并稍作修改, 新生SD大鼠16只随机分为2组: 高敏感组(醋酸灌肠组, A组)和对照组(盐水灌肠组, B组). 出生后第8-21天内, A组大鼠每天直肠内给予0.6%醋酸刺激, 建立内脏高敏感性模型; B组大鼠每天直肠内给予0.9% 生理盐水, 作为对照. 从第21天后的3 wk内不进行任何实验操作, 至大鼠体质量达到180 g以上(第7周)开始实验. 实验前1 d禁食, 为消除生物节律对实验结果的影响, 均于8:00开始实验.
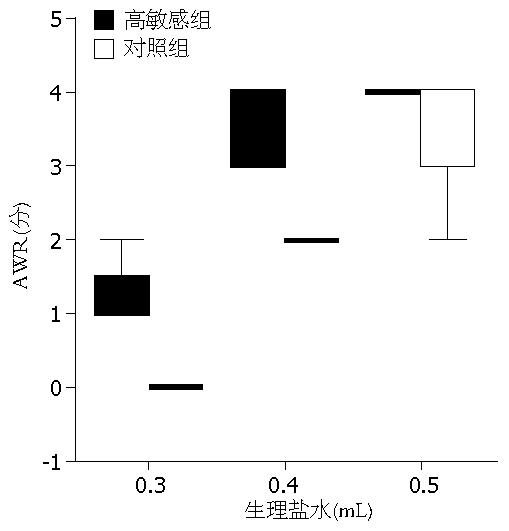
1.2.2 肠道敏感性的测定: (1)评估方法: 行直肠扩张(colorectal distention, CRD)实验, 观察大鼠的腹部撤离反射(abdominal withdrawal reflex, AWR)作为敏感性的评价指标. 将大鼠放在特制的透明塑料笼(20 cm×8 cm×8 cm)内, 清醒状态下, 将石蜡油润滑后的Fogarty(6 F)导管经肛门插入, 气囊末端距离肛门2 cm, 待大鼠适应环境20 min, 进行直肠扩张. 导管球囊内快速注入生理盐水(37 ℃)0.3、0.4、0.5 mL扩张肠道, 观察所引起的腹部撤离反射(AWR). 每次直肠扩张持续20 s, 间隔3 min. 为得到准确的评估结果, 对每一容量都重复进行5次扩张, 数据取中位数. AWR计分标准: 0分: 对扩张无反应; 1分: 偶尔扭头; 2分: 腹背部肌肉轻微收缩但腹部未抬离地面; 3分: 腹背部肌肉较强收缩并把腹部抬离地面; 4分: 腹肌强烈收缩, 背部拱起, 腹部、盆部及会阴部抬离地面.
1.2.3 评价肠道炎症: (1)结肠组织HE染色: 在第7周时处死2组大鼠, 取其距肛门4 cm处降结肠, 40 g/L甲醛固定, 依次乙醇脱水, 二甲苯透明, 石蜡包埋, 切成4 µm厚度切片, HE染色. (2)MPO测定: 取大鼠1 cm降结肠部分, 与1 mL冰生理盐水匀浆, 稀释成5%的浓度, 按试剂盒操作步骤采用生化法检测MPO水平.
1.2.4 5-HT浓度的检测: (1)大鼠结肠组织5-HT水平的测定: 参照Coates等的研究[10], 处死大鼠后, 迅速取距离肛门约6 cm的降结肠组织约0.5 cm, 称取质量, 按10 mL/g的比例加入0.2 mol/L的高氯酸匀浆沉淀蛋白. 4 ℃, 10 000 g, 离心5 min. 吸取上清液, 加入等体积的1 mol/L的硼酸盐缓冲液中和(pH9.25), 4 ℃, 10 000 g, 离心1 min. 取上清液50 µL按试剂盒步骤操作, 用ELISA方法测定5-HT含量. 反应结束后, 在30 min内于波长450 nm的酶标仪上读取各孔的A值. 以A值为纵坐标, 标准品的浓度为横坐标, 绘制曲线图, 根据样品的A值查找对应的浓度, 再计算每毫克组织中的5-HT含量, 以µg/g组织表示. (2)大鼠血浆5-HT水平的测定: 取大鼠肠系膜上动脉血, 4 ℃, 10 000 g, 离心5 min, 取上清同样应用上述方法测定血浆5-HT含量, 单位以mg/L表示.
1.2.5 结肠上皮SERT的免疫组织化学表达: 参照以往研究方法[11], 取大鼠距肛门3 cm处降结肠, 40 g/L多聚甲醛固定4 ℃过夜, 30%蔗糖脱水4 ℃过夜, OCT包埋, 液氮冷冻, -70 ℃保存; 取包埋好的标本, 置于恒冷切片机上, -20 ℃恒温下切片, 片厚10 µm, 常规方法进行免疫组织化学染色. 兔抗SERT浓度为1:3 000. 每张切片连续测定5个视野, 用计算机图像分析系统(LE ICA Q550CW)对上皮层的灰度值进行分析, 以显示SERT表达的相对含量.
1.2.6 结肠SERT mRNA水平: 参照以往研究方法[11], 应用实时定量PCR对大鼠结肠组织SERT mRNA的表达水平进行分析(TaqMan法). 取距肛门约5 cm处结肠, 用常规方法进行总RNA提取和cDNA合成. 在50 µL体系中, 应用标准曲线法进行SERT的Real-Time PCR(Real-Time7300system, ABI公司), 95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 1 min 40循环. 管家基因为β-actin. SERT的引物及探针序列分别为5'-CCATCAGCCCTCTGTTTCTC-3'、5'-GGACGACATCCCTATGCAGT-3'和5'-CCCACCCCAGCTACGGCTTTTCC-3'. β-actin的引物和探针序列分别为5'-CCCTGGCTCCTAGCACCAT-3'、5'-AGAGCCACCAATCCACACAGA-3'和5'-AAGATCATTGCTCCTCCTGAGCGCAAGTA-3'.
统计学处理 本研究所有资料均以mean±SD表示. 用SPSS13.0软件对资料检验, P<0.05为差异有显著性. 大鼠AWR评分采用Mann-Whitney检验, 两组间的其他比较采用独立样本的t检验.
2组大鼠的敏感性测定显示在不同扩张容量下, AWR评分在醋酸灌肠组均显著高于对照组(图1). 两组大鼠均未发现明显组织学炎症表现. 醋酸组大鼠MPO水平为0.042±0.008, 对照组大鼠为0.047±0.014, 二者相比无显著性差异(P = 0.438). 提示幼鼠结肠刺激后到成年结肠不具有明显的炎症改变, 而可以引起成年大鼠的内脏高敏感性.
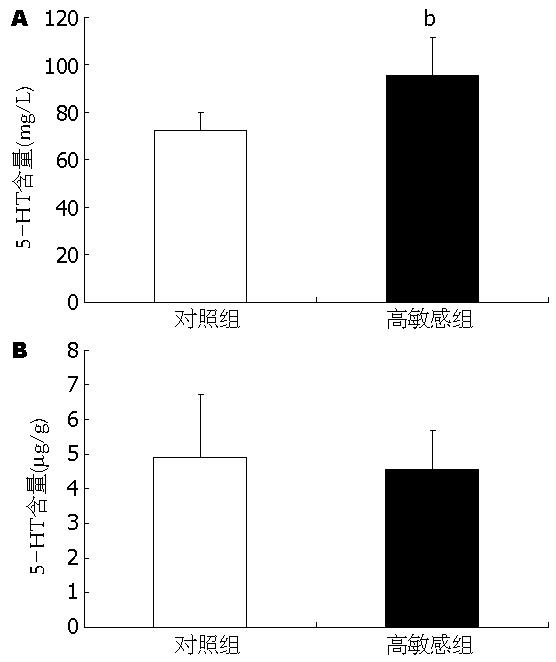
内脏高敏感组大鼠的血浆5-HT含量为95.75 mg/L±15.99 mg/L, 较对照组(72.17 mg/L±8.01 mg/L)明显增高(P<0.01, 图2A). 两组结肠组织5-HT水平差异无显著性(4.55 µg/g±1.13 µg/g vs 4.90 µg/g±1.80 µg/g, P = 0.553, 图2B).
2.3 结肠上皮SERT的表达
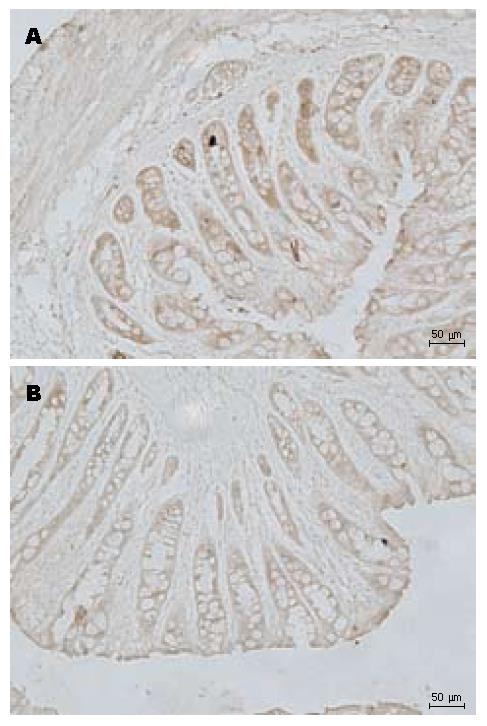
免疫组织化学显示SERT在大鼠结肠黏膜上皮层、神经丛、及肌间神经丛均有染色, 但主要表达于上皮层, 几乎所有的上皮细胞均表达SERT. 内脏高敏感组大鼠的结肠上皮层SERT灰度值显著低于对照组(0.187±0.010 vs 0.191±0.011, P<0.05, 图3).
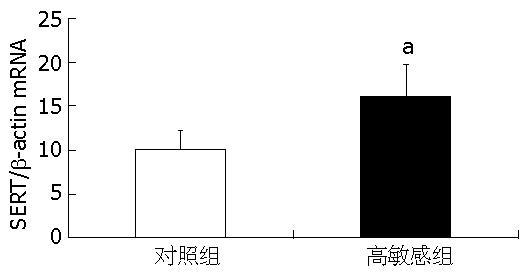
结肠SERT mRNA水平在内脏高敏感组大鼠为16.02±3.70, 对照组大鼠为9.47±2.34, 二者间差异有显著性(P<0.05, 图4).
肠易激综合征(irritable bower syndrome, IBS)是一组多因素引起的原发性慢性疾病, 主要病因包括: 精神因素、遗传因素、感染、食物、神经内分泌因素. 慢性内脏高敏感性是IBS等胃肠道功能性疾病的重要而具有特征性特点[12], 是引起IBS腹痛和异常肠动力最重要的机制. 已有实验证实幼年时期反复的外周刺激可以导致成年后慢性内脏高敏感性的产生[8]. 本研究中, 我们用0.5%的醋酸对幼年大鼠进行肠内刺激建立内脏高敏感大鼠模型, 在其成年后发现内脏敏感性增高, 而结肠黏膜没有明显炎症改变. 同时检测该组大鼠黏膜炎症和组织的中性粒细胞浸润的标志物髓过氧化物酶(MPO)[13]. 与对照组相比, 内脏高敏感大鼠MPO没有明显的变化, 提示本动物模型很好的模拟了IBS等胃肠道功能性疾病的慢性内脏敏感性的特点, 可用于胃肠道功能性疾病的慢性内脏敏感性相关机制的研究.
5-HT是一种分布广泛的单胺类物质, 在人体内约95%的5-HT存在于胃肠嗜咯细胞中[14]. 近年来研究发现IBS患者存在外周5-HT水平的异常[15-18]. 5-HT由肠道嗜铬细胞以及神经系统摄取色氨酸或胺前体合成, 在发挥生理作用后必须灭活, 以免产生中毒反应及5-HT受体的脱敏. 这个过程主要依靠肠黏膜上皮细胞膜上的5-HT转运体来完成, 5-HT能神经元也可表达5-HT转运体将5-HT再摄取. SERT作为介导细胞外5-HT重摄取的重要膜蛋白, 广泛分布于肠上皮细胞、中枢和外周的神经元以及血小板[19]. 高亲和力的SERT对5-HT的清除是十分重要的, 是维持中枢和肠道突触间5-HT稳态环境的重要物质[20]. 目前, 肠黏膜SERT的表达对5-HT生理活性的影响及其在胃肠道功能性疾病的发病过程中的作用正成为研究的热点. 在这些研究中, 有很多关于SERT基因多态性的研究, SERT基因多态性与IBS各型间可能存在联系, 尚有待多中心、大样本的SERT基因多态性的研究, 以进一步揭示其中的复杂关系[21-23]. 此外, 有研究认为腹泻型IBS患者的病生理异常与5-HT再摄取减少相关[24], Coates等研究发现IBS患者肠黏膜的SERT水平是减低的[10], 但最近亦有研究显示IBS患者的SERT表达是正常的[25], 提示SERT表达的异常及在内脏高敏感性产生中的作用需要进一步探讨. 人和大鼠的SERT基因编码序列有很大的同源性, 分布也大致相同[26]. 在肠道, SERT主要表达于黏膜和肠神经系统[27]. 本研究中, 免疫组织化学显示SERT主要分布于大鼠结肠黏膜的上皮层, 几乎所有的结肠上皮细胞都表达SERT. 在慢性内脏高敏感模型中, 与对照组相比, 结肠组织SERT的表达减低. 许多研究显示血浆5-HT可以被用来评估胃肠道5-HT的释放水平[28], IBS患者血中5-HT有可能升高. 此模型中, 慢性内脏高敏感组血浆5-HT水平增高而结肠5-HT含量不变, 可能与慢性内脏高敏感性结肠组织SERT的表达减低相关, 是结肠局部5-HT经过SERT的作用结果, 同时提示内脏高敏感模型中5-HT水平的变化可能主要是由于5-HT失活的减少而不是合成的增加造成的.
我们的研究还发现慢性内脏高敏感大鼠结肠的SERT mRNA水平的表达显著高于对照组, 这似乎与免疫组织化学的研究结果相矛盾, 但也正说明SERT mRNA受血中5-HT和结肠局部5-HT影响的结果, 可能为结肠上皮减少的SERT表达引起的对SERT mRNA的负反馈作用. 另一种解释考虑到肠道的神经元细胞与上皮细胞均能合成SERT蛋白[27], 与免疫组织化学进行的上皮细胞的表达研究不同, mRNA主要检测的是结肠全层的SERT mRNA水平, 包括上皮细胞层的SERT和黏膜下及肌间神经丛的SERT; 而最近相关的研究发现一些前炎症细胞因子对于上皮细胞和神经元的SERT的功能具有不同的作用[29,30], 因此, mRNA的研究结果可能基于上皮细胞和神经元SERT表达的综合作用, 而这两种SERT在高敏感动物中的变化和功能值得进一步探讨.
总之, 内脏高敏感性作为IBS等胃肠功能性疾病重要的生物学特征之一, 由于其复杂的病生理特征, 其产生机制至今仍是讨论的热点. 我们的实验显示了内脏高敏感大鼠具有结肠上皮SERT的低表达, 这种SERT的变化引起了5-HT水平的变化, 为阐明5-HT系统在内脏高敏感性中的作用提供了依据, 而增高的结肠SERT mRNA水平的改变提示上皮细胞和神经元可能具有不同的SERT的表达和功能, 其确切的机制尚待进一步研究.
内脏高敏感性被认为是胃肠道功能性疾病最重要的病生理改变之一, 很多研究发现5-羟色胺及其转运体在内脏敏感性升高的病生理机制中发挥重要的作用.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
内脏高敏感大鼠模型分析其肠黏膜上皮细胞中5-羟色胺与5-羟色胺转运体之间相互作用的机制仍需进一步研究.
很多研究表明在IBS患者及内脏高敏感动物模型中5-羟色胺含量增多, 也有研究表明在IBS患者结肠炎动物模型中5-羟色胺转运体表达减少.
在本实验中, 选取内脏高敏感大鼠模型分析其肠黏膜上皮细胞中5-羟色胺与5-羟色胺转运体的含量, 并初步分析二者之间的关系.
5-羟色胺重摄取抑制剂曾用于临床治疗IBS, 对二者之间关系深入的研究可能为今后的治疗提供新的靶点.
本文研究了内脏高敏感大鼠结肠SERT的表达情况, 对探讨IBS等胃肠功能性疾病的发病机制提供了实验依据, 学术价值较好.
编辑: 曹丽鸥 电编: 何基才
| 1. | Ohman L, Simrén M. New insights into the pathogenesis and pathophysiology of irritable bowel syndrome. Dig Liver Dis. 2007;39:201-215. [PubMed] [DOI] |
| 7. | Creed F, Fernandes L, Guthrie E, Palmer S, Ratcliffe J, Read N, Rigby C, Thompson D, Tomenson B. The cost-effectiveness of psychotherapy and paroxetine for severe irritable bowel syndrome. Gastroenterology. 2003;124:303-317. [PubMed] [DOI] |
| 8. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 10. | Coates MD, Mahoney CR, Linden DR, Sampson JE, Chen J, Blaszyk H, Crowell MD, Sharkey KA, Gershon MD, Mawe GM. Molecular defects in mucosal serotonin content and decreased serotonin reuptake transporter in ulcerative colitis and irritable bowel syndrome. Gastroenterology. 2004;126:1657-1664. [PubMed] [DOI] |
| 11. | Linden DR, Chen JX, Gershon MD, Sharkey KA, Mawe GM. Serotonin availability is increased in mucosa of guinea pigs with TNBS-induced colitis. Am J Physiol Gastrointest Liver Physiol. 2003;285:G207-G216. [PubMed] [DOI] |
| 12. | Tian XY, Bian ZX, Hu XG, Zhang XJ, Liu L, Zhang H. Electro-acupuncture attenuates stress-induced defecation in rats with chronic visceral hypersensitivity via serotonergic pathway. Brain Res. 2006;1088:101-108. [PubMed] [DOI] |
| 13. | Rachmilewitz D, Simon PL, Schwartz LW, Griswold DE, Fondacaro JD, Wasserman MA. Inflammatory mediators of experimental colitis in rats. Gastroenterology. 1989;97:326-337. [PubMed] [DOI] |
| 14. | Gershon MD. Review article: roles played by 5-hydroxytryptamine in the physiology of the bowel. Aliment Pharmacol Ther. 1999;13 Suppl 2:15-30. [PubMed] [DOI] |
| 15. | Houghton LA, Atkinson W, Whitaker RP, Whorwell PJ, Rimmer MJ. Increased platelet depleted plasma 5-hydroxytryptamine concentration following meal ingestion in symptomatic female subjects with diarrhoea predominant irritable bowel syndrome. Gut. 2003;52:663-670. [PubMed] [DOI] |
| 16. | Miwa J, Echizen H, Matsueda K, Umeda N. Patients with constipation-predominant irritable bowel syndrome (IBS) may have elevated serotonin concentrations in colonic mucosa as compared with diarrhea-predominant patients and subjects with normal bowel habits. Digestion. 2001;63:188-194. [PubMed] [DOI] |
| 18. | Bearcroft CP, Perrett D, Farthing MJ. Postprandial plasma 5-hydroxytryptamine in diarrhoea predominant irritable bowel syndrome: a pilot study. Gut. 1998;42:42-46. [PubMed] [DOI] |
| 19. | Chen JX, Pan H, Rothman TP, Wade PR, Gershon MD. Guinea pig 5-HT transporter: cloning, expression, distribution, and function in intestinal sensory reception. Am J Physiol. 1998;275:G433-G448. [PubMed] |
| 20. | Narboux-Nême N, Pavone LM, Avallone L, Zhuang X, Gaspar P. Serotonin transporter transgenic (SERTcre) mouse line reveals developmental targets of serotonin specific reuptake inhibitors (SSRIs). Neuropharmacology. 2008;55:994-1005. [PubMed] [DOI] |
| 21. | Lesch KP, Bengel D, Heils A, Sabol SZ, Greenberg BD, Petri S, Benjamin J, Müller CR, Hamer DH, Murphy DL. Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region. Science. 1996;274:1527-1531. [PubMed] [DOI] |
| 22. | Park JM, Choi MG, Park JA, Oh JH, Cho YK, Lee IS, Kim SW, Choi KY, Chung IS. Serotonin transporter gene polymorphism and irritable bowel syndrome. Neurogastroenterol Motil. 2006;18:995-1000. [PubMed] [DOI] |
| 23. | Yeo A, Boyd P, Lumsden S, Saunders T, Handley A, Stubbins M, Knaggs A, Asquith S, Taylor I, Bahari B. Association between a functional polymorphism in the serotonin transporter gene and diarrhoea predominant irritable bowel syndrome in women. Gut. 2004;53:1452-1458. [PubMed] [DOI] |
| 24. | Atkinson W, Lockhart S, Whorwell PJ, Keevil B, Houghton LA. Altered 5-hydroxytryptamine signaling in patients with constipation- and diarrhea-predominant irritable bowel syndrome. Gastroenterology. 2006;130:34-43. [PubMed] [DOI] |
| 25. | Camilleri M, Andrews CN, Bharucha AE, Carlson PJ, Ferber I, Stephens D, Smyrk TC, Urrutia R, Aerssens J, Thielemans L. Alterations in expression of p11 and SERT in mucosal biopsy specimens of patients with irritable bowel syndrome. Gastroenterology. 2007;132:17-25. [PubMed] [DOI] |
| 27. | Wade PR, Chen J, Jaffe B, Kassem IS, Blakely RD, Gershon MD. Localization and function of a 5-HT transporter in crypt epithelia of the gastrointestinal tract. J Neurosci. 1996;16:2352-2364. [PubMed] |
| 28. | Sikander A, Rana SV, Prasad KK. Role of serotonin in gastrointestinal motility and irritable bowel syndrome. Clin Chim Acta. 2009;403:47-55. [PubMed] [DOI] |
| 29. | Foley KF, Pantano C, Ciolino A, Mawe GM. IFN-gamma and TNF-alpha decrease serotonin transporter function and expression in Caco2 cells. Am J Physiol Gastrointest Liver Physiol. 2007;292:G779-G784. [PubMed] [DOI] |
| 30. | Zhu CB, Blakely RD, Hewlett WA. The proinflammatory cytokines interleukin-1beta and tumor necrosis factor-alpha activate serotonin transporters. Neuropsychopharmacology. 2006;31:2121-2131. [PubMed] [DOI] |