修回日期: 2010-04-24
接受日期: 2010-05-10
在线出版日期: 2010-05-18
目的: 探讨小泛素相关修饰物(SUMO-1)在肝纤维化形成中的作用机制.
方法: 将90只♂SD大鼠分为2组: 模型组(n = 50)和对照组(n = 40), 对模型组给予40% CCl4 3 μL/g皮下注射, 分别于造模后2、4、6、8、10、12 wk取肝组织, 同时给予对照组等量的生理盐水皮下注射, 且分别在与模型组相同的时间处死动物. 采用病理检查观察肝纤维化形成的变化, RT-PCR检测SUMO-1 mRNA的表达, Western blot检测SUMO-1蛋白的表达, 将各周检测的数据进行分析, 相互比较, 并将各周数据分别与对照组进行比较分析.
结果: 随着肝纤维化至肝硬化的形成, SUMO-1 mRNA在2、4、6、8、10、12 wk的表达逐渐增强(0.725±0.017、0.786±0.018、0.803±0.023、0.831±0.020、0.863±0.016、0.892±0.008, P<0.01). Western blot显示SUMO-1的蛋白表达在2、4、6、8、10、12 wk也是同时逐渐增强(0.810±0.059、0.873±0.049、0.923±0.055、0.959±0.032、0.988±0.011、0.998±0.004, P<0.01).
结论: SUMO-1基因及蛋白表达在肝纤维化形成过程中逐渐增强, 说明其在肝纤维化形成过程中具有重要的意义.
引文著录: 肖志华, 郭武华, 张吉翔. SUMO-1在实验性大鼠肝纤维化形成过程中的作用. 世界华人消化杂志 2010; 18(14): 1422-1427
Revised: April 24, 2010
Accepted: May 10, 2010
Published online: May 18, 2010
AIM: To observe the changes in the expression of small ubiquitin-related modifier-1 (SUMO-1) during the formation of hepatic fibrosis in rats and to investigate the role of SUMO-1 in the pathogenesis of hepatic fibrosis.
METHODS: Ninety male Sprague-Dawley rats were divided into two groups: model group and control group. The model group was subcutaneously injected with 40% carbon tetrachloride at a dose of 0.3 mL/100 g of body weight, while the control group was given equivalent volume of normal saline. Liver tissue samples were taken at weeks 2, 4, 6, 8, 10 and 12 after carbon tetrachloride injection. Hepatic fibrosis was pathologically evaluated. The expression of SUMO-1 mRNA and protein in liver tissue was detected by RT-PCR and Western blot, respectively.
RESULTS: During the formation of hepatic fibrosis, the expression of SUMO-1 mRNA was gradually up-regulated from week 2 to 12 (0.725 ± 0.017, 0.786 ± 0.018, 0.803 ± 0.023, 0.831 ± 0.020, 0.863 ± 0.016 and 0.892 ± 0.008, respectively; P < 0.01). Similarly, SUMO-1 protein expression was also gradually up-regulated from week 2 to 12 (0.810 ± 0.059, 0.873 ± 0.049, 0.923 ± 0.055, 0.959 ± 0.032, 0.988 ± 0.011 and 0.998 ± 0.004, respectively; P < 0.01).
CONCLUSION: The expression of both SUMO-1 mRNA and protein is gradually up-regulated during the formation of hepatic fibrosis, suggesting an important role of SUMO-1 in the pathogenesis of hepatic fibrosis.
- Citation: Xiao ZH, Guo WH, Zhang JX. Role of small ubiquitin-related modifier-1 in the pathogenesis of hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1422-1427
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1422.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1422
小泛素相关修饰物(small ubiquitin related modifier, SUMO)是泛素(Ubiquitin)类蛋白家族的重要成员之一, 其与蛋白的共价连接是一种新的蛋白质翻译后加工形式. 虽然SUMO的生化反应途径与泛素相似, 但SUMO不诱导底物蛋白降解. SUMO化能够使蛋白质更加稳定并参与细胞核内的一系列生理过程, 如核运输、信号传递、细胞周期调控及基因表达调控等. 本研究通过观察SUMO-1的mRNA及蛋白质表达的变化, 并探讨SUMO-1在肝纤维化形成过程中的作用.
SD大鼠80只, ♂, 体质量250 g±30 g, 购自南昌大学医学院动物学部. PCR热循环仪(GeneAmp® PCR System 9600), Western blot仪器(Bio-Rad Corporation), GeneGenius Match(Syngene, 美国)全自动凝胶成像分析系统. TRIzol(Invitrogen, 美国); RT-PCR试剂: Oligo(dT)(Promega, 美国), M-MLV RT 5×Buffer (Promega, 美国), dNTP(Generay Biotech, 美国), Rnase抑制剂(Promega, 美国), M-MLV逆转录酶(Promega, 美国), Master Mix(天根公司)、DNA Ladder(天根公司); Western blot试剂: 总蛋白提取试剂(Applygen, 美国), SUMO-1一抗(兔多克隆抗体, Abzoom, 美国), β-actin一抗(兔多克隆抗体, Santa Cruz, 美国), 辣根过氧化物酶标记Streptavidin(Beyotime, 美国).
1.2.1 造模及分组: 随机将其分为模型组(n = 50)和对照组(n = 40), 模型组给予40% CCl4 3 μL/g 皮下注射, 分别于造模后2、4、6、8、10、12 wk处死动物, 每次处死6只, 造模过程中死亡14只(6 wk时死亡2只, 为注射部位溃烂而死, 8 wk时死亡3只, 为注射部位溃烂感染而死, 10 wk时死亡3只, 肝硬化腹水而死, 12 wk时死亡6只, 肝硬化腹水而死). 对照组给予等量的生理盐水, 分别在相同时间处死动物, 每次处死6只, 自然死亡4只. 对照组和模型组每次分别取1 cm×1 cm ×1 cm肝组织经40 g/L中性缓冲甲醛固定后行病理检查, 剩余肝组织液氮罐中冻存后以行逆转录-聚合酶链反应(RT-PCR)检测和Western blot检测.
1.2.2 组织病理学: 100 g/L甲醛固定的肝组织,石蜡包埋, 制作4 μm切片, 脱蜡, 梯度乙醇水化, PBS冲洗, Weigert铁苏木素染色5 min, 冲水, 苦味酸-酸性品红染色2-5 min, 然后水洗, 乙醇分化, 脱水, 透明, 封片.
1.2.3 RT-PCR检测SUMO-1 mRNA表达: 肝组织总RNA的提取按TRIzol试剂盒操作说明进行, SUMO-1上游引物为5'-AGGAGGCAAAACCTTCAACT-3', 下游引物为5'-TTCTTCCTCCATTCCCAGTT-3', 扩增DNA片段大小为245 bp. β-actin: 上游引物为5'-ACACTGTGCCCATCTACGAGG-3', 下游引物为5'-AGGGGCCGGACTCGTCATACT-3', 扩增DNA片段大小为621 bp. 反应分两步进行, 取总RNA 5 μg, 在M-MLV逆转录酶作用下逆转录为cDNA, 以此为模板, 分别按以下条件进行PCR反应, 扩增SUMO-1条件: 94 ℃变性1 min, 51 ℃退火45 s, 72 ℃延伸1 min, 30个循环, 最后72 ℃延伸7 min. 扩增β-actin条件: 94 ℃变性1 min, 52 ℃退火45 s, 72 ℃延伸1 min, 30个循环, 最后72 ℃延伸7 min. PCR反应产物5 μL在1.5%琼脂糖凝胶上电泳30 min(80 V)图像分析仪采集图像, 以β-actin为基准, 做半定量分析, 即以扩增目的片段与β-actin的灰度比值表示所扩增的目的基因片段的相对表达水平.
1.2.4 Western blot检测蛋白的表达: 按分子克隆操作指南方法, 用抽提试剂提取各阶段肝组织总蛋白样品, 考马斯亮蓝染色测定样品浓度并调整上样量至50 μg. 12%的SDSPAGE凝胶电泳. 纤维素滤膜印迹, 而后依次以含5%脱脂奶粉TBST溶液封闭、山羊抗小鼠SUMO-1抗体4 ℃过夜, 辣根过氧化物酶标记二抗孵育, 电化学发光试剂盒显色, 经曝光、显影、定影后照相. 全自动数码成像系统扫描分析靶蛋白条带, 以其灰度值作为蛋白表达的相对水平.
统计学处理 所有数据经SAS统计软件统计分析, 多组间比较采用方差分析, 两两比较采用LSD-t检验, P<0.05为差异有统计学意义.
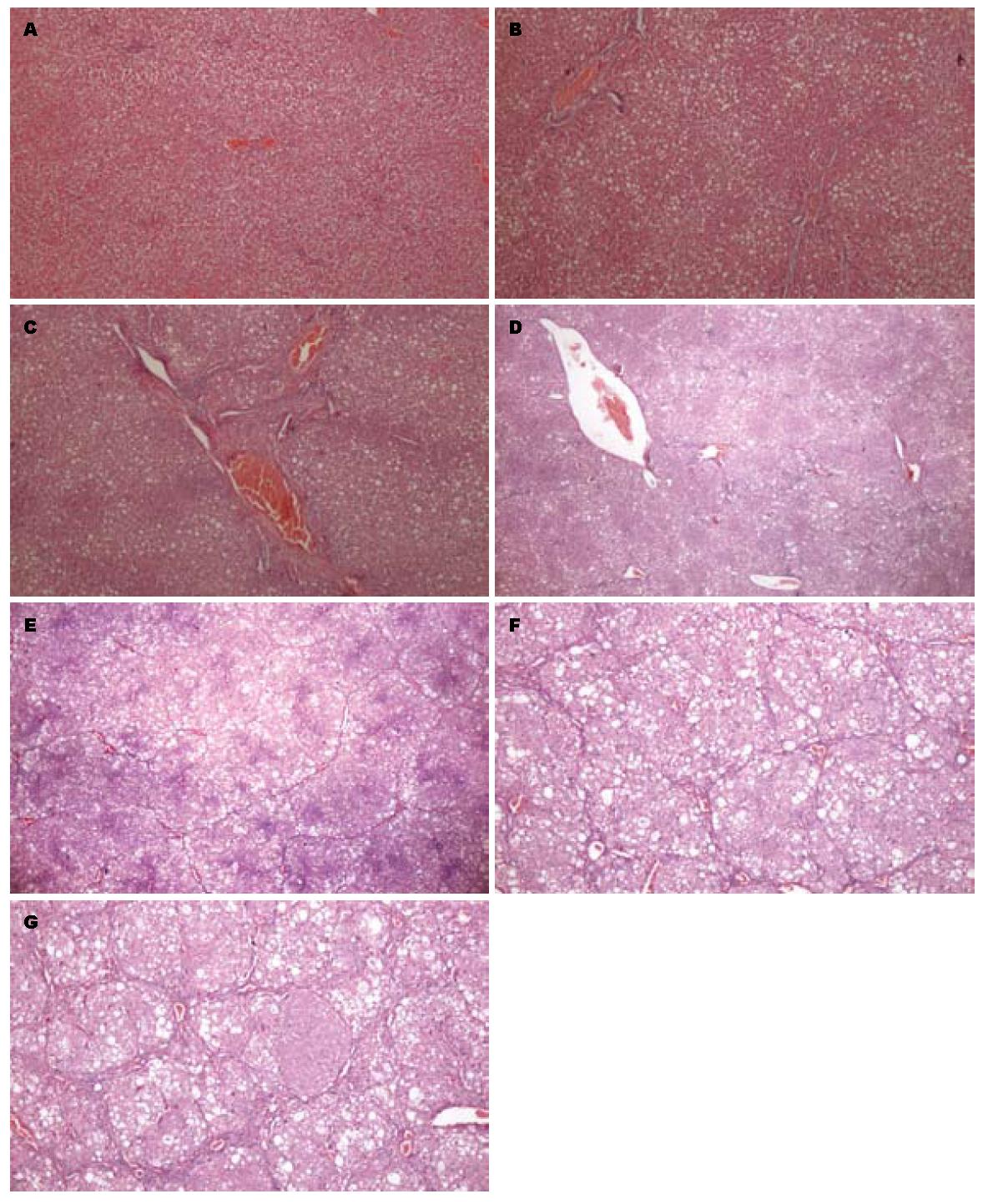
正常大鼠肝脏内未见明显染色, 对照组大鼠皮下注射生理盐水后, 病理表现与正常大鼠肝脏一致, 肝细胞排列整齐, 无炎细胞浸润, 无纤维间隔形成, 未见明显染色纤维(图1A). 2 wk时, 可见脂肪滴形成, 肝细胞坏死, 肝小叶结构不甚完整, 多数肝细胞气球样变性, 汇管区部分炎性细胞浸润(图1B). 4 wk时肝细胞气球样变明显, 见有灶性坏死, 肝小叶及汇管区内大量淋巴, 单核细胞浸润, 纤维间隔开始形成, 可少许纤维束形成(图1C), 6 wk时较之前纤维束增多, 纤维间隔逐渐形成(图1D). 8 wk时, 可见汇管区条索状染色纤维向肝小叶内伸展, 逐渐分割肝小叶, 提示纤维间隔形成明显(图1E). 10 wk可见汇管区条索状染色纤维越来越多, 形成纤维束, 包绕再生结节, 肝小叶明显(图1F). 12 wk时, 可见汇管区条索状染色纤维更多, 形成纤维束, 提示肝硬化明显形成(图1G), 同一时间点各个标本表现均一致.
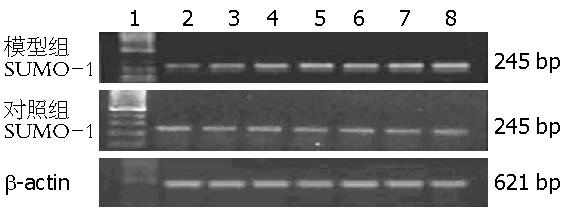
通过RT-PCR扩增出长度为245 bp的SUMO-1 cDNA片段, 与正常及对照组大鼠相比, 注射CCl4 2 wk后, SUMO-1基因转录水平受到轻微的诱导而升高, 4 wk其表达明显增强, 第8周时表达更强. 至12 wk最强, 而生理盐水对照组随着时间递增表达无明显增强. 各阶段灰度扫描和β-actin比值与对照组比较, 差异有显著性(图2), 在前后相差为2 wk的比较中, 差异无显著性. 但在前后相差4 wk甚至更长时间的比较中, 差异均有显著性(F = 72.346, P<0.01, 表1).
| 分组 | RT-PCR结果 | Western blot结果 |
| 对照组 | ||
| 2 wk | 0.714±0.005 | 0.716±0.059 |
| 4 wk | 0.680±0.076 | 0.756±0.057 |
| 6 wk | 0.709±0.008 | 0.750±0.061 |
| 8 wk | 0.711±0.006 | 0.749±0.054 |
| 10 wk | 0.713±0.006 | 0.763±0.048 |
| 12 wk | 0.724±0.007 | 0.763±0.052 |
| 模型组 | ||
| 2 wk | 0.725±0.017b | 0.810±0.059 |
| 4 wk | 0.786±0.018b | 0.873±0.049 |
| 6 wk | 0.803±0.023b | 0.923±0.055 |
| 8 wk | 0.831±0.020b | 0.959±0.032 |
| 10 wk | 0.863±0.016b | 0.988±0.011 |
| 12 wk | 0.892±0.008b | 0.998±0.004 |
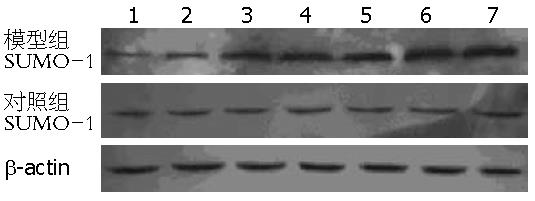
正常及对照组大鼠SUMO-1无明显表达, 相对分子质量17 000 Da处未见明显条带, 模型组大鼠皮下注射CCl4 2 wk后, 相对分子质量17 000 Da处可见阳性条带, 蛋白出现少量表达, 注射CCl4 4 wk后, 条带增强, 蛋白表达进一步增强, 8 wk蛋白条带更宽, 蛋白表达更强. 至第12周, 蛋白条带更宽, 蛋白表达最强, 而生理盐水对照组随着时间递增无明显增强(图3). SUMO-1的Western blot各阶段灰度扫描和β-actin比值与对照组比较, 差异有显著性, 在前后相差为2 wk的比较中, 差异无显著性. 但在前后相差4 wk甚至更长时间的比较中, 差异均有显著性(F = 25.671, P<0.01, 表1).
肝纤维化常见病因在我国以乙型或丙型病毒性肝炎为最多, 20%-30%慢性丙型肝炎患者最终出现严重的肝纤维化或肝硬化病变. 在西方国家以慢酒精中毒为主要病因, 其中60%-70%最终可发展为肝硬化. 关于肝纤维化机制及对其防治的研究, 近年来已成为国内外生物学、医学研究的热点之一[1-3]. 近年来关于泛素相关小修饰蛋白家族中的SUMO-1的修饰、调控功能的研究很多. 目前已知哺乳动物的SUMO家族成员有: SUMO-l、SUMO-2、SUMO-3和SUMO-4. SUMO-1具有家族成员共同特性: C端均有一个向外伸展的突出端; 但不同SUMO家基酸序列是不同的[4], SUMO-1在经过由三个酶的修饰后, 与靶蛋白共价连接, 并参与蛋白质与蛋白质之间的相互作用, 调控靶蛋白在细胞内的分布. 其主要机制是通过阻碍泛素对靶蛋白的共价修饰, 提高靶蛋白的稳定性. 此外, SUMO-1还参与DNA的复制修复以及转录调控过程[5]. SUMO化能够使蛋白质更加稳定, 参与细胞核内的一系列生理过程, 如核运输、信号传递、细胞周期调控, 以及基因表达的调控等. 近年研究证实SUMO参与了过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPAR)-γ、核转录因子(nuclear transcription factor, NF)-κB及TGF-β1等通路的信号传递.
肝纤维化是一切慢性肝病的共同病理基础, 其实质是组织发生修复反应时细胞外基质(extracellular matrix, ECM)合成、降解与沉积不平衡而引起的病理过程[6]. 在肝纤维化的过程中, 肝脏内细胞与细胞、细胞与基质、基质与介质间发生十分复杂的相互作用, 细胞内许多基因的表达模式发生异常改变, 出现肝细胞的变性、坏死, 炎症细胞浸润, 细胞因子作用紊乱以及肝组织中细胞外基质的过度产生和沉积等复杂病理变化[7]. Miyahara等[8,9]发现PPAR-γ表达在维持肝星状细胞(hepatic stellate cell, HSC)静息状态时有重要作用, 当其表达减少时, 将可能成为HSC激活进程的早期重要因素. HSC活化合成大量ECM的机制, 一方面可能与其增殖、细胞数量增加有关; 另一方面可能与单个HSC合成ECM的能力增强有关. 因而抗肝纤维化治疗主要集中在抑制肝脏炎症, 抑制HSC的激活和增生并诱导其凋亡, 促进肝脏ECM的降解. HSC是参与该过程的重要细胞, HSC的活化增殖是肝纤维化发生机制的中心环节, 抑制HSC增殖, 诱导其凋亡是抗纤维化的重要策略[10,11].
郭武华等[12]研究表明SUMO-1基因在肝癌及肝癌细胞中高表达而在癌旁肝组织中低表达. 本研究旨在观察SUMO-1在大鼠肝纤维化过程中的表达情况, 以探讨SUMO-1对肝纤维化的作用.
目前认为HSC激活是肝纤维化形成的关键. 病理状态下, HSC可以转化为肌纤维母细胞, 分泌大量的胶原而导致肝纤维化甚至肝硬化. HSC的激活受多种细胞因子的影响, TGF-β1可以通过直接和间接途径对HSC的转化过程起关键性的调节作用, 是目前已知的最重要的促HSC活化因子之一[13], 在正常情况下, TGF-β1与其他细胞因子一起处于一种网络平衡状态, 共同维持肝脏内环境的稳定, 病理状态下, TGF-β1可刺激ECM产生, 减少其降解, 从而使ECM在肝脏大量沉积导致纤维化. 在肝纤维化患者和肝纤维化实验模型中, 均可见TGF-β1 mRNA表达水平增加[14], 有实验表明, TGF-β1通过TGF-β1/Smad信号途径对Ⅰ型胶原蛋白的表达有上调作用[15].
TGF-β1通过催化Smad磷酸化, 磷酸化的Smad的方法分子形成同源寡聚体或异源寡聚体后进入细胞核, 调节相应基因的转录速度, 影响细胞的分化, 吴晓玲等[16]研究TGF-β-Smad参与了大鼠实验性肝纤维化的形成与发展, 其关键信号分子的表达失调是慢性肝损伤进展为肝纤维化的重要机制. 由此促进HSC激活, 并转化为肌成纤维样(myofibroblast-likecell, MFLC), 诱导活化的HSC收缩, 在HSC活化早期刺激ECM的合成与沉积, 主要包括Ⅰ型胶原、Ⅲ型胶原和Ⅳ型胶原[17,18], 促进肝纤维化的形成.
Miyazono等[19]总结出SUMO-1可以通过修饰TGF-β1, 从而增强TGF-β1的信号传导; Kang等[20]研究出SUMO-1修饰TGF-β1及TGF-β2的复合物, 被修饰的复合物作用于Smad3, 进而增强TGF-β1的作用; Imoto等[21]则研究出SUMO-1修饰Smad, 进而也增强了TGF-β1对肝纤维化的促进作用.
血小板衍化生长因子(platele derived growth factor, PDGF)近年来发现PDGF可以促进Ito细胞DNA合成及生长, 并合成胶原, TGF-β可加强这种作用. 肝受损时, 大量分泌的PDGF刺激HSCs增殖, 转化为肝纤维样母细胞, 肌纤维样母细胞合成大量细胞外基质沉积于肝细胞间质, 促进肝纤维化发生; PDGF能够促进肌纤维样母细胞产生胶原, 尤其是Ⅰ型及Ⅲ型胶原; PDGF通过上调组织金属蛋白酶抑制剂抑制胶原酶的作用,以减少细胞外基质的降解[22].
PDGF激活的是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号途径, 包括JNK、ERK和P38. JNK和ERK途径的激活能诱导HSC增殖, P38激活则抑制HSC增殖. PI32K信号途径在PDGF诱导的HSC活化过程中也能被激活, 导致Akt和P70激酶活性增加, 引起HSC增殖和化学吸引[23].
Reigstad等[24]研究表明SUMO-1可以大量修饰PDGF, 增加PDGF的表达. 细胞因子分别经TGF-β/Smad通路、MAPK通路、PI23K通路、JAK/STAT信号通路、Wnt信号通路、NF-κB信号通路、Rho-ROCK信号通路、Vitmin A类信号通路等[25-28], 将刺激信号传递至效应细胞, 使基因表达改变. 不同因素造成的肝损伤模型及肝损伤的不同阶段, 信号通路的作用可能不同, 吴文娟等[29]指出p38MAPK信号传导通路可能通过诱导HSC的活化、增殖, 促进HF的形成. SUMO-1通过诱导NF-κB p100位点磷酸化, 从而NF-κB表达加强[30].
本研究发现, 正常大鼠肝脏SUMO-1 mRNA表达为弱阳性, 且蛋白表达也为弱阳性, 说明SUMO-1的mRNA表达及蛋白质翻译过程被抑制在极低的水平, 伴随着肝纤维化进展, SUMO-1 mRNA表达逐渐增强, Western blot显示其蛋白质表达和mRNA表达一致, 也是逐渐增强, 说明SUMO-1参与了肝纤维化的进程.
总之, SUMO-1的表达在肝纤维化的形成以及进展过程中发挥很大作用. SUMO-1可能通过大量增强TGF-β1以及PDGF的表达, 进而促进HSC的增殖和活化, 促进其分泌大量胶原, 并减少胶原降解而导致的大量胶原异常沉积, 表现出促进肝纤维化的作用. 甚至通过增强NF-κB通路的表达, 导致肝纤维化的结果. 总之SUMO-1是TGF-β1及其他各种生长因子受体的重要修饰因子, SUMO-1甚至可以修饰其他的生长因子, 维持其蛋白质稳定性, 从而调控肝纤维化甚至是肝癌的发展过程. 因此, 如能通过分子生物学手段抑制SUMO-1的表达, 将有可能成为肝纤维化的又一治疗手段.
肝纤维化(HF)已成为一个危害人类生命健康的世界性问题, 如果能阻止其发生, 肝硬化及其并发症就能得到有效控制. 随着分子生物学的发展, 许多研究进一步阐明了HF发病的分子机制, 对HF的信号转导通路的研究结果显示有多条通路参与了HF的发生发展. SUMO-1是小泛素相关修饰物(SUMO)一员,他在HF发生、发展的过程中起着重要的作用.
马红, 主任医师, 首都医科大学附属北京友谊医院肝病中心; 秦成勇, 教授, 山东省立医院消化内科
SUMO-1是参与肝纤维化的重要细胞因子之一, 而且可以修饰众多导致肝纤维化的细胞因子, 肝组织SUMO-1表达的上调是导致细胞外基质过度合成、沉积的重要原因. 通过干预SUMO-1分子表达有望成为抗肝纤维化的有效途径.
本文用RT-PCR和Western blot的方法直接检测肝纤维化进展过程中肝组织中SUMO-1表达量的变化, 分析其与肝纤维化发生的可能关系.
SUMO-1: 小泛素相关修饰物(SUMO)是泛素(Ubiquitin)类蛋白家族的重要成员之一, 其与蛋白的共价连接是一种新的蛋白质翻译后加工形式. SUMO化能够使蛋白质更加稳定并参与细胞核内的一系列生理过程, 如核运输、信号传递、细胞周期调控及基因表达调控, SUMO-1参与蛋白质与蛋白质之间的相互作用, 调控靶蛋白在细胞内的分布, 还参与DNA的复制修复以及转录调控过程.
本研究选题较好, 设计合理, 结果可靠, 有一定参考价值.
编辑: 曹丽鸥 电编: 何基才
| 1. | Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007;46:922-938. [PubMed] [DOI] |
| 2. | Runyon BA. A pill a day can improve survival in patients with advanced cirrhosis. Gastroenterology. 2007;133:1029-1031. [PubMed] [DOI] |
| 3. | Salerno F, Gerbes A, Ginès P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310-1318. [PubMed] |
| 4. | Treuter E, Gustafsson JA. Wrestling rules in transrepression: as easy as SUMO-1, -2, -3? Mol Cell. 2007;25:178-180. [PubMed] [DOI] |
| 5. | Eladad S, Ye TZ, Hu P, Leversha M, Beresten S, Matunis MJ, Ellis NA. Intra-nuclear trafficking of the BLM helicase to DNA damage-induced foci is regulated by SUMO modification. Hum Mol Genet. 2005;14:1351-1365. [PubMed] [DOI] |
| 6. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 8. | Miyahara T, Schrum L, Rippe R, Xiong S, Yee HF, Motomura K, Anania FA, Willson TM, Tsukamoto H. Peroxisome proliferator-activated receptors and hepatic stellate cell activation. J Biol Chem. 2000;275:35715-35722. [PubMed] [DOI] |
| 9. | Zheng S, Chen A. Activation of PPARgamma is required for curcumin to induce apoptosis and to inhibit the expression of extracellular matrix genes in hepatic stellate cells in vitro. Biochem J. 2004;384:149-157. [PubMed] [DOI] |
| 13. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] |
| 14. | Lin WC, Kuo SC, Lin WL, Fang HL, Wang BC. Filtrate of fermented mycelia from Antrodia camphorata reduces liver fibrosis induced by carbon tetrachloride in rats. World J Gastroenterol. 2006;12:2369-2374. [PubMed] [DOI] |
| 15. | Robert K, Nehmé J, Bourdon E, Pivert G, Friguet B, Delcayre C, Delabar JM, Janel N. Cystathionine beta synthase deficiency promotes oxidative stress, fibrosis, and steatosis in mice liver. Gastroenterology. 2005;128:1405-1415. [PubMed] [DOI] |
| 17. | Chen YW, Li DG, Wu JX, Chen YW, Lu HM. Tetrandrine inhibits activation of rat hepatic stellate cells stimulated by transforming growth factor-beta in vitro via up-regulation of Smad 7. J Ethnopharmacol. 2005;100:299-305. [PubMed] [DOI] |
| 18. | Kharbanda KK, Rogers DD, Wyatt TA, Sorrell MF, Tuma DJ. Transforming growth factor-beta induces contraction of activated hepatic stellate cells. J Hepatol. 2004;41:60-66. [PubMed] [DOI] |
| 19. | Miyazono K, Kamiya Y, Miyazawa K. SUMO amplifies TGF-beta signalling. Nat Cell Biol. 2008;10:635-637. [PubMed] [DOI] |
| 20. | Kang JS, Saunier EF, Akhurst RJ, Derynck R. The type I TGF-beta receptor is covalently modified and regulated by sumoylation. Nat Cell Biol. 2008;10:654-664. [PubMed] [DOI] |
| 21. | Imoto S, Ohbayashi N, Ikeda O, Kamitani S, Muromoto R, Sekine Y, Matsuda T. Sumoylation of Smad3 stimulates its nuclear export during PIASy-mediated suppression of TGF-beta signaling. Biochem Biophys Res Commun. 2008;370:359-365. [PubMed] [DOI] |
| 22. | 王 萍. 血小板衍生生长因子与肝纤维化. 国外医学·消化疾病分册. 2000;20:40. |
| 23. | Reif S, Lang A, Lindquist JN, Yata Y, Gabele E, Scanga A, Brenner DA, Rippe RA. The role of focal adhesion kinase-phosphatidylinositol 3-kinase-akt signaling in hepatic stellate cell proliferation and type I collagen expression. J Biol Chem. 2003;278:8083-8090. [PubMed] [DOI] |
| 24. | Reigstad LJ, Martinez A, Varhaug JE, Lillehaug JR. Nuclear localisation of endogenous SUMO-1-modified PDGF-C in human thyroid tissue and cell lines. Exp Cell Res. 2006;312:782-795. [PubMed] [DOI] |
| 25. | Bièche I, Asselah T, Laurendeau I, Vidaud D, Degot C, Paradis V, Bedossa P, Valla DC, Marcellin P, Vidaud M. Molecular profiling of early stage liver fibrosis in patients with chronic hepatitis C virus infection. Virology. 2005;332:130-144. [PubMed] [DOI] |
| 26. | Takahara Y, Takahashi M, Zhang QW, Wagatsuma H, Mori M, Tamori A, Shiomi S, Nishiguchi S. Serial changes in expression of functionally clustered genes in progression of liver fibrosis in hepatitis C patients. World J Gastroenterol. 2008;14:2010-2022. [PubMed] [DOI] |
| 27. | Töx U, Scheller I, Kociok N, Kern MA, Klanac D, Daudi SM, Laue O, Schirmacher P, Goeser T, Schulte S. Expression of angiotensin II receptor type 1 is reduced in advanced rat liver fibrosis. Dig Dis Sci. 2007;52:1995-2005. [PubMed] [DOI] |
| 28. | Utsunomiya T, Okamoto M, Hashimoto M, Yoshinaga K, Shiraishi T, Tanaka F, Mimori K, Inoue H, Watanabe G, Barnard GF. A gene-expression signature can quantify the degree of hepatic fibrosis in the rat. J Hepatol. 2004;41:399-406. [PubMed] [DOI] |