修回日期: 2010-04-06
接受日期: 2010-04-13
在线出版日期: 2010-05-08
目的: 探讨Bmi-1和S100A4蛋白在食管鳞状细胞癌(ESCC)组织中的表达及其临床病理意义.
方法: 采用免疫组织化学法分别检测68例食管鳞状细胞癌、45例癌旁异型增生及36例正常食管黏膜组织中Bmi-1及S100A4蛋白的表达, 并分析两者的表达水平与临床病理因素的关系. 采用χ2检验进行统计学分析.
结果: Bmi-1蛋白在食管鳞状细胞癌、癌旁异型增生及正常黏膜组织中的阳性表达率分别为57.4%、48.9%、25.0%; S100A4蛋白的阳性表达率分别为48.6%、26.7%、13.9%, 两者在组间的表达差异有统计学意义(P<0.01). 食管鳞癌组织中Bmi-1和S100A4的蛋白表达与淋巴结转移及TNM分期均密切有关(P<0.05), 而S100A4的蛋白表达还与肿瘤浸润深度有关(P<0.05). 两者在食管鳞状细胞癌组织中的表达呈正相关(r = 0.302, P<0.05).
结论: Bmi-1及S100A4的蛋白表达与食管鳞状细胞癌发生发展密切相关, 联合检测Bmi-1及S100A4两蛋白指标对食管鳞癌的预后判断具有重要的意义.
引文著录: 符仲标, 张蕾, 李颖霞, 张同贞, 张云汉, 温洪涛. Bmi-1和S100A4蛋白在食管鳞状细胞癌中的表达及其临床病理意义. 世界华人消化杂志 2010; 18(13): 1344-1349
Revised: April 6, 2010
Accepted: April 13, 2010
Published online: May 8, 2010
AIM: To detect the expression of Bmi-1 and S100A4 proteins in esophageal squamous cell carcinoma (ESCC) and to analyze their clinicopathological significance.
METHODS: The expression of Bmi-1 and S100A4 proteins was detected by immunohistochemistry in 68 ESCC specimens, 45 tumor-adjacent dysplastic tissue specimens and 36 normal esophageal mucosa specimens. Statistical analysis was performed using the chi-square test.
RESULTS: The positive rates of Bmi-1 and S100A4 protein expression differed significantly among ESCC, dysplasia and normal esophageal mucosa (Bmi-1: 57.4%, 48.9%, and 25.0%; S100A4: 48.6%, 26.7%, and 13.9%; all P < 0.01). Overexpression of Bmi-1 and S100A4 protein was related with lymph node metastasis and TNM stage in ESCC (all P < 0.05). S100A4 protein expression was found to be correlated with the depth of tumor invasion (P < 0.05). A positive correlation was also noted between the expression of Bmi-1 and that of S100A4 in ESCC (r = 0.302, P < 0.05).
CONCLUSION: Overexpression of Bmi-1 and S100A4 proteins is associated with ESCC invasion and metastasis. Combined detection of Bmi-1 and S100A4 protein expression is helpful for evaluation of the prognosis of ESCC.
- Citation: Fu ZB, Zhang L, Li YX, Zhang TZ, Zhang YH, Wen HT. Clinicopathological significance of Bmi-1 and S100A4 expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1344-1349
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1344.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1344
Bmi-1(B-cell specific Moloney murine leukaemia virus insertion site 1, Bmi-1)基因, 是在研究转基因鼠白血病过程中发现的一种原癌基因, 他可协同c-myc基因共同促进细胞转化和肿瘤形成, 对肿瘤细胞逃逸凋亡具有重要作用, 并直接参与干细胞的自我更新[1-3]. 文献报道, 在人类鼻咽癌、胃癌、大肠癌、乳腺癌等多种肿瘤中Bmi-1均呈现高表达[4-7], 且与肿瘤的发生发展及患者的预后有关, 但其在食管癌中的作用仅有He等[8]的1篇报道. S100A4(钙离子结合调节蛋白)是S100蛋白家族成员之一, 其与肿瘤的侵袭转移密切相关[9]. 有关其与肿瘤浸润转移的研究虽有报道, 但联合检测Bmi-1和S100A4蛋白在食管鳞状细胞癌中的表达及相关性研究, 迄今国内外均未见报道. 本实验采用免疫组织化学法分别检测Bmi-1及S100A4蛋白在36例正常食管黏膜、45例异型增生和68例食管鳞状细胞癌组织中的表达, 探讨他们与ESCC发生发展的关系及其临床病理意义.
郑州大学第一附属医院2006-2008年手术切除的68例食管癌标本. 患者术前均未接受化疗放疗及免疫治疗. 其中男39例, 女29例, 年龄37-81岁. 病理学均确诊为鳞状细胞癌. 其中有淋巴结转移25例, 无淋巴结转移43例; 浸润深度: 浅层(黏膜固有层或黏膜下层)20例, 深层(肌层或外膜)48例; 据2002年国际抗癌联盟(UICC)食管癌TNM分期: Ⅰ-ⅡA 43例, ⅡB-Ⅲ 25例. 所有标本分别在癌灶、癌旁3 cm以内及手术远端正常黏膜组织3处取材, 均经100 g/L甲醛溶液固定, 石蜡包埋, 4 μm厚的连续切片. 兔抗人Bmi-1多克隆抗体购于Abcam公司. 即用型兔抗人S100A4多克隆抗体、SP免疫组织化学试剂盒均购自北京中杉金桥公司.
免疫组织化学染色采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxiase, SP). Bmi-1抗体稀释度为1:50, S100A4为工作液, DAB显色, 苏木素复染, 操作步骤严格按照说明书进行. 实验中以已知的阳性组织(Bmi-1: 乳腺癌组织; S100A4: 扁桃体组织)作阳性对照, PBS代替一抗作阴性对照. 参考冯艳等[10]计分方法并做适当的修改: 以胞质和/或胞核出现棕黄或黄褐色颗粒为阳性细胞, 随机选取5个高倍视野计数, 以阳性细胞数和着色强度综合判断结果, 其中阳性细胞数记分: <5%为0分, ≥5%且<25%为1分, ≥25%且<50%为2分, ≥50%且<75%为3分, ≥75%为4分; 着色强度计分: 阴性染色1分, 弱染色2分, 中等强度染色3分, 强染色4分. 两者得分相乘结果: ≤3分者为(-); 4-8分者为(+); >8分者(++), 以+和++视为阳性.
统计学处理 采用SPSS16.0统计软件进行数据分析, 统计方法采用χ2检验, 检验水准α = 0.05.
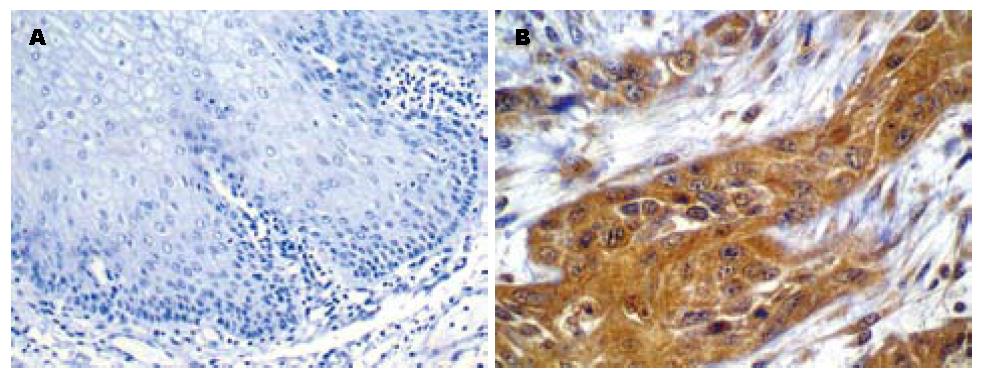
Bmi-1蛋白主要在胞质中表达, 呈棕黄或黄褐色颗粒, 少数细胞的胞质和胞核可同时表达(图1). 在肿瘤组织中Bmi-1蛋白呈灶性或弥漫性分布, 以弥漫性为主. Bmi-1蛋白在鳞癌、异型增生及正常食管黏膜组织的阳性表达率分别为: 57.4%、48.9%和25.0%, 组间差异有统计学意义(P<0.01, 表1). Bmi-1蛋白在ESCC中的表达与患者的性别、年龄及肿瘤的分化程度、浸润深度均无关(P>0.05), 但与淋巴结转移及TNM分期有关(P<0.05, 表2).
| 组织类别 | n | Bmi-1 | χ2值 | P值 | S100A4 | χ2值 | P值 | ||||||
| - | + | ++ | 阳性率(%) | - | + | ++ | 阳性率(%) | ||||||
| 鳞癌 | 68 | 29 | 17 | 22 | 57.4 | 9.986 | 0.007 | 35 | 19 | 14 | 48.6 | 14.041 | 0.001 |
| 异型性增生 | 45 | 23 | 12 | 10 | 48.9 | 33 | 10 | 2 | 26.7 | ||||
| 正常黏膜 | 36 | 27 | 8 | 1 | 25.0 | 31 | 4 | 1 | 13.9 | ||||
| 因素 | n | Bmi-1 | χ2值 | P值 | S100A4 | χ2值 | P值 | ||||||
| - | + | ++ | 阳性率(%) | - | + | ++ | 阳性率(%) | ||||||
| 性别 | |||||||||||||
| 男 | 39 | 18 | 10 | 11 | 53.8 | 0.4600 | 0.498 | 18 | 12 | 9 | 53.8 | 1.035 | 0.309 |
| 女 | 29 | 11 | 7 | 11 | 62.1 | 17 | 7 | 5 | 41.4 | ||||
| 年龄(岁) | |||||||||||||
| >60 | 35 | 17 | 8 | 10 | 51.4 | 1.0350 | 0.309 | 16 | 9 | 10 | 54.3 | 0.957 | 0.328 |
| <60 | 33 | 12 | 9 | 12 | 63.6 | 19 | 10 | 4 | 42.4 | ||||
| 分化程度 | |||||||||||||
| 高 | 12 | 7 | 3 | 2 | 41.7 | 1.4750 | 0.478 | 8 | 4 | 0 | 33.3 | 2.567 | 0.227 |
| 中 | 31 | 12 | 9 | 10 | 61.3 | 17 | 12 | 2 | 45.1 | ||||
| 低 | 25 | 10 | 5 | 10 | 60.0 | 10 | 3 | 12 | 60.0 | ||||
| 浸润深度 | |||||||||||||
| 浅层 | 20 | 11 | 4 | 5 | 45.0 | 1.7868 | 0.184 | 15 | 3 | 2 | 25.0 | 6.280 | 0.012 |
| 深层 | 48 | 16 | 13 | 17 | 62.5 | 20 | 16 | 12 | 58.3 | ||||
| 淋巴结转移 | |||||||||||||
| 有 | 25 | 6 | 8 | 11 | 76.0 | 5.6200 | 0.018 | 8 | 7 | 10 | 68.0 | 6.000 | 0.014 |
| 无 | 43 | 23 | 9 | 11 | 46.5 | 27 | 12 | 4 | 37.2 | ||||
| TNM分期 | |||||||||||||
| Ⅰ-ⅡA | 43 | 24 | 7 | 12 | 44.2 | 8.2900 | 0.004 | 27 | 10 | 6 | 37.2 | 6.000 | 0.014 |
| ⅡB-Ⅲ | 25 | 5 | 10 | 10 | 80.0 | 8 | 9 | 8 | 68.0 | ||||
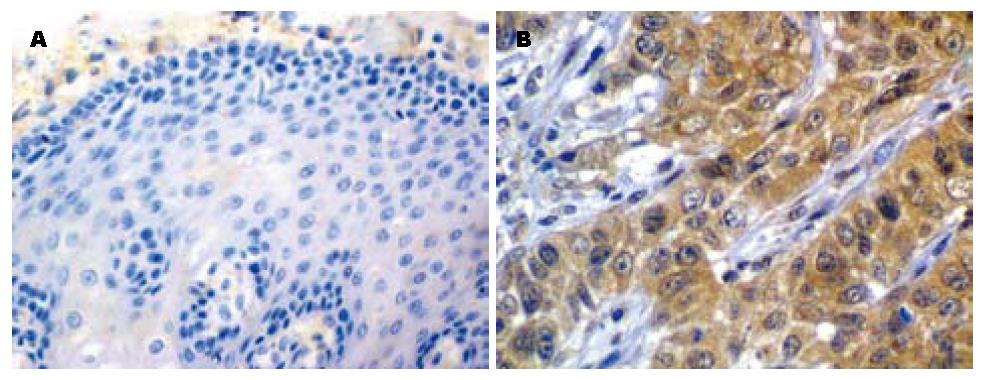
S100A4蛋白在正常食管黏膜可见弱着色, 以胞质为主. 在癌细胞的胞质中有较强表达, 呈棕黄颗粒, 少数位于胞核(图2). S100A4蛋白在鳞癌、异型增生和正常黏膜组织中的阳性表达率分别为48.6%、26.7%及13.9%, 组间差异有统计学意义(P<0.01, 表1). S100A4蛋白在ESCC中的表达水平与患者性别、年龄及肿瘤分化程度无关(P>0.05), 但与肿瘤的浸润深度、淋巴结转移和TNM分期均有关(P<0.05, 表2).
食管癌是世界上常见的恶性消化系肿瘤之一, 因其侵袭转移而严重影响患者的治疗及预后, 因此找到食管癌发生及侵袭转移的早期主要相关因子, 对食管癌的防治及预后将具有重要的意义. 多梳基因(PcG)是转录抑制因子, 调控细胞的增殖和分化, 他们的调节障碍往往导致细胞异型增生. Bmi-1属于PcG成员, 目前对其作用的研究已有较大的进展. Bmi-1主要是通过负调控其下游靶基因INK4a-ARF来发挥作用的[11-14]. 过表达的Bmi-1可以抑制P16INK4a和P19ARF(人类P14ARF)的表达, 从而减少了P16INK4a对细胞周期的抑制作用, 促进细胞的增殖生长; 同时也减弱了P19ARF保护抑癌蛋白P53降解的作用, 使得P53抑癌的作用减弱, 促进肿瘤发生; 相反, 若Bmi-1表达下调或失活, 那么就减弱或失去了对INK4a-ARF基因转录的抑制作用, 引起细胞的过早衰老和凋亡[12]. 对体外细胞研究发现缺失Bmi-1的鼠成纤维细胞在培养中表现出早熟并易老化, 无法正常自我更新与繁殖; 但过度表达Bmi-1的鼠成纤维细胞则出现细胞无法正常凋亡, 过度增殖并进而永生化[11], 证明了Bmi-1的缺失或过表达对个体的生长发育都是不利的. 此外过表达的Bmi-1还能增加端粒酶的活性, 维持端粒的长度, 导致细胞永生化[4,15]. 这都提示Bmi-1过表达在肿瘤的发生中具有重要的作用. 迄今Bmi-1在人类多种实体瘤中高表达已得到证实[4-8]. 本实验结果发现Bmi-1蛋白在正常食管黏膜、癌旁异型增生和ESCC组织中的表达呈增高趋势, 组间比较有明显差异, 与He等[8]研究的研究结果基本一致. 提示了Bmi-1蛋白参与了食管鳞状细胞癌的癌变过程, Bmi-1蛋白的高表达也许能为食管鳞癌的早期病变提供依据.
高表达Bmi-1的肿瘤细胞被认为肿瘤存在的"癌症干细胞"[12], 据此认为高表达Bmi-1蛋白的肿瘤会具有更强的侵袭力[16], 在胃癌中研究发现Bmi-1蛋白的高表达与TNM分期、浸润深度和淋巴结转移呈正相关[17]. 我们研究发现Bmi-1蛋白的表达与TNM分期和淋巴结转移密切相关, 随着TNM分期和淋巴结转移的增加而增加. 提示Bmi-1蛋白不仅在食管的早期癌变中就呈现高表达状态, 而且其过表达在食管癌的侵袭转移过程中可能起着重要的作用, 高表达者提示肿瘤极有可能已发生了转移. He等[8]报道Bmi-1的mRNA表达水平与ESCC的组织分级、临床分期以及淋巴结转移有高度的正相关性, 但其蛋白水平与上述因素无任何相关性, 这与我们的研究结果有些不符有待进一步的探讨. 作者还认为Bmi-1的表达状态与患者的预后有关, 高表达者预后差[4,6,8,18]. 这也许能为我们提供一个判断患者预后的新的分子标志物.
本研究还发现Bmi-1蛋白的主要定位在胞质中[5,8], 说明了Bmi-1蛋白发挥功能的场所主要是在胞质, 与已有多数研究发现其主要定位于胞核中的现象不符[6,7,17]. 与多梳基因家族主要是在胞核内通过调控核内的相关基因(如: INK4a-ARF基因)来发挥作用的假说不一致, 这有待进一步研究[19].
S100A4蛋白是钙结合蛋白(S100)家族成员之一, 是由101个氨基酸的多肽组成的, 相对分子质量约为11.5 kDa. 其主要通过钙离子信号转导途径参与细胞增殖分化、细胞黏附运动, 基因表达, 细胞凋亡及血管生成等过程[20,21]. 目前研究表明S100A4蛋白在胃癌、膀胱癌、乳腺癌、结直肠癌等多种肿瘤中高表达, 且其表达状态与肿瘤的侵袭、转移密切相关[22-26]. 本研究发现在ESCC癌变过程中, S100A4蛋白的表达在正常食管黏膜、异型增生及ESCC组织中依次增高, 组间差异存在统计学意义, 提示了S100A4蛋白与食管癌的发生密切相关. 在癌组织中, S100A4蛋白的表达随肿瘤的浸润深度、淋巴结转移和TNM分期增高而增高, 差异有统计学意义. 郑献召等[9]对食管癌的研究也得出了类似的结果. 这说明了S100A4蛋白不仅参与了食管癌的癌变过程, 而且在食管癌的侵袭转移中具有重要的作用. 有学者将S100A4基因转染至本无转移性的大鼠乳腺癌细胞系后, 发现该细胞系出现转染现象, 而高转移性的肿瘤细胞系经过RNA干扰处理后可明显抑制其转移性[20]. 证实了S100A4作为癌肿浸润转移的分子基础之一, 也给了我们提示S100A4基因可作为控制肿瘤侵袭转移的基因治疗靶点之一. 对胰腺癌的研究发现S100A4蛋白的高表达除了与肿瘤的浸润转移有关外, 还是影响患者预后的独立危险因素[27,28]. 可能是过表达的S100A4蛋白通过增强肿瘤的侵袭转移能力而导致患者预后不良之故. 使得通过检测S100A4蛋白来判断食管癌预后有了依据.
在恶性肿瘤发生机制的研究中, 许多学者提出了基因协同作用假说, 认为在恶性肿瘤发生、发展和转移的各阶段, 至少存在两个或两个以上功能不同的基因异常激活, 并在时间和空间上相互配合, 协同促进了细胞的癌变和转移. 本研究显示Bmi-1与S100A4的蛋白在ESCC组织中的表达呈正相关(r = 0.302, P<0.05), 且随着TNM分期、淋巴结转移的增加, 两者的表达均在升高, 说明了Bmi-1和S100A4蛋白的过表达共同促进ESCC的发生及侵袭转移, 但其相互作用机制仍不清, 有待研究.
总之, ESCC组织中Bmi-1和S100A4的蛋白表达均明显高于正常组织且与食管癌的转移密切相关, 两者可以作为评估食管癌发生及侵袭转移的有效指标. 联合检测两者对食管癌的诊断及预后判断具有重要的意义.
食管癌为我国最常见的消化系恶性肿瘤之一, 尽管人们对食管癌的防治做出了种种努力, 但近几十年来食管癌的5年生存率没有得到明显改善, 这是其早期不易诊断且又易发生侵袭转移的原因. 因此, 找到食管癌早期发生及其侵袭与转移的主要调控因子, 将直接影响食管癌的治疗与预后. 也是目前人们对食管癌临床和基础研究的主要方向.
李增山, 副教授, 中国人民解放军第四军医大学病理教研室.
Bmi-1基因属于多疏基因家族中的重要成员, 在细胞生长、增殖和干细胞自我更新的过程中发挥着重要的作用. 研究发现该基因与人类多种肿瘤的发生、发展密切相关, 并极有可能作为判断恶性肿瘤进展和预后的新的指标. 迄今, 有关Bmi-1在食管鳞癌中的研究报道极少.
Kim等应用RT-PCR和免疫组织化学技术对乳腺癌研究发现, 与对照组相比, 癌组织中的Bmi-1 mRNA水平明显升高.
本实验应用免疫组织化学法联合检测Bmi-1和S100A4蛋白在食管鳞状细胞癌、癌旁异型增生及癌旁正常黏膜组织中的表达情况, 从而在蛋白水平上探讨Bmi-1和S100A4蛋白与食管癌各项临床病理参数之间的关系, 为Bmi-1和S100A4作为判断食管癌生物学行为的重要参考指标提供理论依据.
本实验证实了Bmi-1和S100A4蛋白在食管鳞癌表达的状况及二者的相关性. 联合监测两种蛋白的表达, 对食管癌的诊断及预后判断具有重要的意义. 为食管癌的防治提供新的思路和理论依据.
本文研究设计较为合理, 结果明确, 论述有据, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Park IK, Morrison SJ, Clarke MF. Bmi1, stem cells, and senescence regulation. J Clin Invest. 2004;113:175-179. [PubMed] [DOI] |
| 2. | Liu S, Dontu G, Wicha MS. Mammary stem cells, self-renewal pathways, and carcinogenesis. Breast Cancer Res. 2005;7:86-95. [PubMed] [DOI] |
| 3. | Molofsky AV, Pardal R, Iwashita T, Park IK, Clarke MF, Morrison SJ. Bmi-1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation. Nature. 2003;425:962-967. [PubMed] [DOI] |
| 4. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 5. | Zhao J, Luo XD, Da CL, Xin Y. Clinicopathological significance of B-cell-specific Moloney murine leukemia virus insertion site 1 expression in gastric carcinoma and its precancerous lesion. World J Gastroenterol. 2009;15:2145-2150. [PubMed] [DOI] |
| 7. | Kim JH, Yoon SY, Jeong SH, Kim SY, Moon SK, Joo JH, Lee Y, Choe IS, Kim JW. Overexpression of Bmi-1 oncoprotein correlates with axillary lymph node metastases in invasive ductal breast cancer. Breast. 2004;13:383-388. [PubMed] [DOI] |
| 8. | He XT, Cao XF, Ji L, Zhu B, Lv J, Wang DD, Lu PH, Cui HG. Association between Bmi1 and clinicopathological status of esophageal squamous cell carcinoma. World J Gastroenterol. 2009;15:2389-2394. [PubMed] [DOI] |
| 9. | 郑 献召, 李 珊珊, 轩 小燕, 李 娜, 王 丰. 食管鳞癌组织中S100A4和MMP2蛋白表达与临床病理学特征的关系. 世界华人消化杂志. 2007;15:3338-3342. [DOI] |
| 11. | Jacobs JJ, Kieboom K, Marino S, DePinho RA, van Lohuizen M. The oncogene and Polycomb-group gene bmi-1 regulates cell proliferation and senescence through the ink4a locus. Nature. 1999;397:164-168. [PubMed] [DOI] |
| 12. | Jacobs JJ, Scheijen B, Voncken JW, Kieboom K, Berns A, van Lohuizen M. Bmi-1 collaborates with c-Myc in tumorigenesis by inhibiting c-Myc-induced apoptosis via INK4a/ARF. Genes Dev. 1999;13:2678-2690. [PubMed] [DOI] |
| 13. | Spike BT, Macleod KF. The Rb tumor suppressor in stress responses and hematopoietic homeostasis. Cell Cycle. 2005;4:42-45. [PubMed] [DOI] |
| 14. | Molofsky AV, He S, Bydon M, Morrison SJ, Pardal R. Bmi-1 promotes neural stem cell self-renewal and neural development but not mouse growth and survival by repressing the p16Ink4a and p19Arf senescence pathways. Genes Dev. 2005;19:1432-1437. [PubMed] [DOI] |
| 15. | Dimri GP, Martinez JL, Jacobs JJ, Keblusek P, Itahana K, Van Lohuizen M, Campisi J, Wazer DE, Band V. The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells. Cancer Res. 2002;62:4736-4745. [PubMed] |
| 16. | Dirks P. Bmi1 and cell of origin determinants of brain tumor phenotype. Cancer Cell. 2007;12:295-297. [PubMed] [DOI] |
| 18. | Wang H, Pan K, Zhang HK, Weng DS, Zhou J, Li JJ, Huang W, Song HF, Chen MS, Xia JC. Increased polycomb-group oncogene Bmi-1 expression correlates with poor prognosis in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:535-541. [PubMed] [DOI] |
| 19. | Shilatifard A. Chromatin modifications by methylation and ubiquitination: implications in the regulation of gene expression. Annu Rev Biochem. 2006;75:243-269. [PubMed] [DOI] |
| 20. | Mazzucchelli L. Protein S100A4: too long overlooked by pathologists? Am J Pathol. 2002;160:7-13. [PubMed] [DOI] |
| 21. | Semov A, Moreno MJ, Onichtchenko A, Abulrob A, Ball M, Ekiel I, Pietrzynski G, Stanimirovic D, Alakhov V. Metastasis-associated protein S100A4 induces angiogenesis through interaction with Annexin II and accelerated plasmin formation. J Biol Chem. 2005;280:20833-20841. [PubMed] [DOI] |
| 22. | Yoon CS, Hyung WJ, Lee JH, Chae YS, Won NH, Yeom BW, Choi JS. Expression of S100A4, E-cadherin, alpha- and beta-catenin in gastric adenocarcinoma. Hepatogastroenterology. 2008;55:1916-1920. [PubMed] |
| 23. | 于 观贞, 王 杰军, 陈 颖, 倪 灿荣, 朱 明华. 转移相关基因nm23和P53及S100A4在晚期胃癌中的表达及与侵袭转移的相关性研究. 中华胃肠外科杂志. 2006;9:165-169. |
| 25. | Cabezón T, Celis JE, Skibshøj I, Klingelhöfer J, Grigorian M, Gromov P, Rank F, Myklebust JH, Maelandsmo GM, Lukanidin E. Expression of S100A4 by a variety of cell types present in the tumor microenvironment of human breast cancer. Int J Cancer. 2007;121:1433-1444. [PubMed] [DOI] |
| 26. | Cho YG, Kim CJ, Nam SW, Yoon SH, Lee SH, Yoo NJ, Lee JY, Park WS. Overexpression of S100A4 is closely associated with progression of colorectal cancer. World J Gastroenterol. 2005;11:4852-4856. [PubMed] [DOI] |
| 28. | Rudland PS, Platt-Higgins A, Renshaw C, West CR, Winstanley JH, Robertson L, Barraclough R. Prognostic significance of the metastasis-inducing protein S100A4 (p9Ka) in human breast cancer. Cancer Res. 2000;60:1595-1603. [PubMed] |