修回日期: 2010-04-10
接受日期: 2010-04-20
在线出版日期: 2010-05-08
目的: 探讨氧化苦参碱对大鼠慢性胰腺炎的治疗作用及其机制.
方法: Wistar大鼠40只, 按照随机数字表分为:阴性对照组(NC组, n = 10), 以300 mg/kg隔日腹腔内注射生理盐水; 模型组(CP组, n = 10), 以700 mg/kg隔日腹腔内注射二乙基二硫代氨基甲酸钠(DDC); OM治疗组(OT组, n = 10), 以700 mg/kg隔日腹腔内注射DDC, 1 wk后开始每日腹腔注射OM 100 mg/kg; OM预防组(OP组, n = 10), 依照模型组方法注射DDC的同时每日腹腔内注射OM 100 mg/kg. 到30 d时停止注射DDC, 但仍继续注射OM. 将上述4组分别在20 d、40 d处死大鼠(n = 5), 用Masson染色的方法观察胶原纤维增生, 用免疫组织化学的方法观察Ⅰ型胶原、α-SMA在胰腺组织的定位及表达, 用Western blot方法检测α-SMA在胰腺组织表达量的变化.
结果: Masson染色可见胶原纤维面积百分比, 分别在20、40 d时CP组(22.54%±4.45%、35.14%±3.27%)高于其余各组(P<0.05), OP组(13.16%±1.84%、25.14%±3.67%)与OT组(19.58%±2.78%、28.68%±2.55%)较CP组降低(P<0.05), NC组(3.0%±0.32%、2.45%±0.24%)低于其余各组(P<0.05), CP组与OT组在40 d时的胶原纤维面积百分比较20 d时增高
(P<0.05). Ⅰ型胶原与α-SMA在胰腺组织的定位: 用免疫组织化学的方法发现NC组胰腺组织α-SMA在血管壁平滑肌表达阳性, 其余部位未见表达; CP组α-SMA在血管周围和腺泡间有阳性表达; 在OT、OP组, α-SMA在腺泡间有少量表达. Ⅰ型胶原在NC组主要位于胰腺组织周边; CP组除在上述部位外, 还表达于腺泡间及小叶周围. 用Western blot方法检测胰腺组织中α-SMA与β-actin的相对表达量分别在20、40 d时CP组(1.06±0.04、1.16±0.03)高于其余各组(P<0.05), NC组(0.73±0.06、0.78±0.06)低于其余各组(P<0.05), OT组与OP组比较无差别(P>0.05).
结论: 慢性胰腺炎时Ⅰ型胶原和α-SMA表达增强, 主要位于血管和腺泡周围以及小叶间. OM可以通过减少胰腺组织内胶原的生成及PSC的活化抑制胰腺纤维化的发展.
引文著录: 王昱良, 郑永青, 夏时海, 汪海燕, 苏丽婷, 吴双. 氧化苦参碱对慢性胰腺炎胰腺组织中Ⅰ型胶原及α-SMA的影响. 世界华人消化杂志 2010; 18(13): 1331-1336
Revised: April 10, 2010
Accepted: April 20, 2010
Published online: May 8, 2010
AIM: To investigate the treatment effects of oxymatrine (OM) against chronic pancreatitis in rats and to explore the potential mechanisms involved.
METHODS: Forty healthy Wistar rats were randomly and equally divided into four groups: negative control group (NC group), CP model group (CP group), OM treatment group (OT group), and OM pretreatment group (OP group), which received saline qod, diethyldithiocarbamate (DDC) at 700 mg/kg qod, diethyldithiocarbamate (DDC) at 700 mg/kg qod and OM at 100 mg/kg a week later, and diethyldithiocarbamate (DDC) at 700 mg/kg qod and OM at 100 mg/kg simultaneously, respectively. Thirty days later, DDC injection was discontinued, while OM treatment continued. Rats were executed on days 20 and 40 (n = 5 at each time point). Collagen fibers were stained by Masson's trichrome. The localization and expression of collagen I and α-SMA in chronic pancreatitis were examined by immunohistochemistry.
RESULTS: Collage I was localized in the periphery of the pancreas in the NC group. In the CP group, collagen I could also be seen in periacinar and perilobular areas. The immunoreactivity of α-SMA was detected in the blood vessel wall in the NC group, and in the blood vessel wall and periacinar area in the CP group. The expression of collagen I and α-SMA in periacinar area was significantly lower in the OP and OT groups than in the CP group. The percentages of collagen area on days 20 and 40 were significantly lower in the NC group (3.0% ± 0.32% and 2.45% ± 0.24%) than in the other groups (all P < 0.05), but significantly higher in the CP group (22.54% ± 4.45% and 35.14% ± 3.27%) than in the OP group (13.16% ± 1.84% and 25.14% ± 3.67%) and the OT group (19.58% ± 2.78% and 28.68% ± 2.55%). The percentages of collagen areas on day 40 in the CP and OT groups were significantly higher than those on day 20 (both P < 0.05). The relative expression levels of α-SMA on days 20 and 40 were significantly higher in the CP group (1.06 ± 0.04 and 1.16 ± 0.03) than in other groups (all P < 0.05). The NC group had the lowest relative expression level of α-SMA (0.73 ± 0.06 and 0.78 ± 0.06). No significant difference was noted in the relative expression level of α-SMA between the OT and OP groups.
CONCLUSION: The expression of collagen I and α-SMA is enhanced in rat CP, predominantly localized in perivascular, periacinar and perilobular areas. OM can decrease collagen production and pancreatic stellate cell activation and thereby inhibit the development of pancreatic fibrosis.
- Citation: Wang YL, Zheng YQ, Xia SH, Wang HY, Su LT, Wu S. Oxymatrine enhances the expression of collagen I and α-SMA in rat chronic pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1331-1336
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1331.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1331
慢性胰腺炎的病理改变主要以纤维化为主, 目前认为胰腺星状细胞(pancreatic stellate cell, PSC)是胰腺纤维化的效应细胞, 在各种因素作用下, 造成胰腺实质损伤坏死伴发炎症反应, 继而各种炎症因子释放并激活PSC转变为α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)染色阳性的类成纤维细胞, 细胞外基质的合成分泌增多, 导致胰腺纤维化. 胰腺纤维化的治疗仍在探索阶段, 氧化苦参碱(oxymatrine, OM)系药用苦参的干燥根中提取的生物碱, 有多方面的药理作用. 近年大量研究结果表明OM具有明显的抗器官纤维化作用, 且在治疗慢性肝炎和肝纤维化等方面已经得到了广泛的应用, 而肝星状细胞与PSC生物学特性极其相似. 本文通过观察OM对大鼠胰腺胶原纤维及α-SMA的影响探讨了OM对胰腺纤维化的治疗作用.
Wistar大鼠, ♂, 体质量220 g±30 g, 购于军事医学科学院动物中心. 二乙基二硫代氨基甲酸钠(DDC)购于上海国药集团化学试剂公司. OM由正大天晴公司惠赠. 兔抗大鼠Ⅰ型胶原多克隆抗体、小鼠抗大鼠α-SMA单克隆抗体、SABC试剂盒(生物素化羊抗小鼠IgG、SABC、正常山羊封闭液)均购于南京博士德公司. 生物素标记的羊抗兔IgG(即用型)、HRP标记的链霉卵白素(即用型), HRP标记的羊抗小鼠IgG均购于北京中杉生物技术有限公司.
1.2.1 分组: ♂ Wistar大鼠40只, 参照Matsumura等[1]所述造模方法, 按照随机数字表分为: 阴性对照组(NC组, n = 10), 以300 mg/kg隔日腹腔内注射生理盐水; 模型组(CP组, n = 10), 以700 mg/kg隔日腹腔内注射DDC; OM治疗组(OT组, n = 10), 以700 mg/kg隔日腹腔内注射DDC, 1 wk后注射OM 100 mg/kg. OM预防组(OP组, n = 10), 依照模型组方法注射DDC的同时每日腹腔内注射OM 100 mg/kg. 到30 d时停止注射DDC, 但仍继续注射OM. 将上述4组分别依20 d、40 d处死大鼠(n = 5), 取胰腺组织.
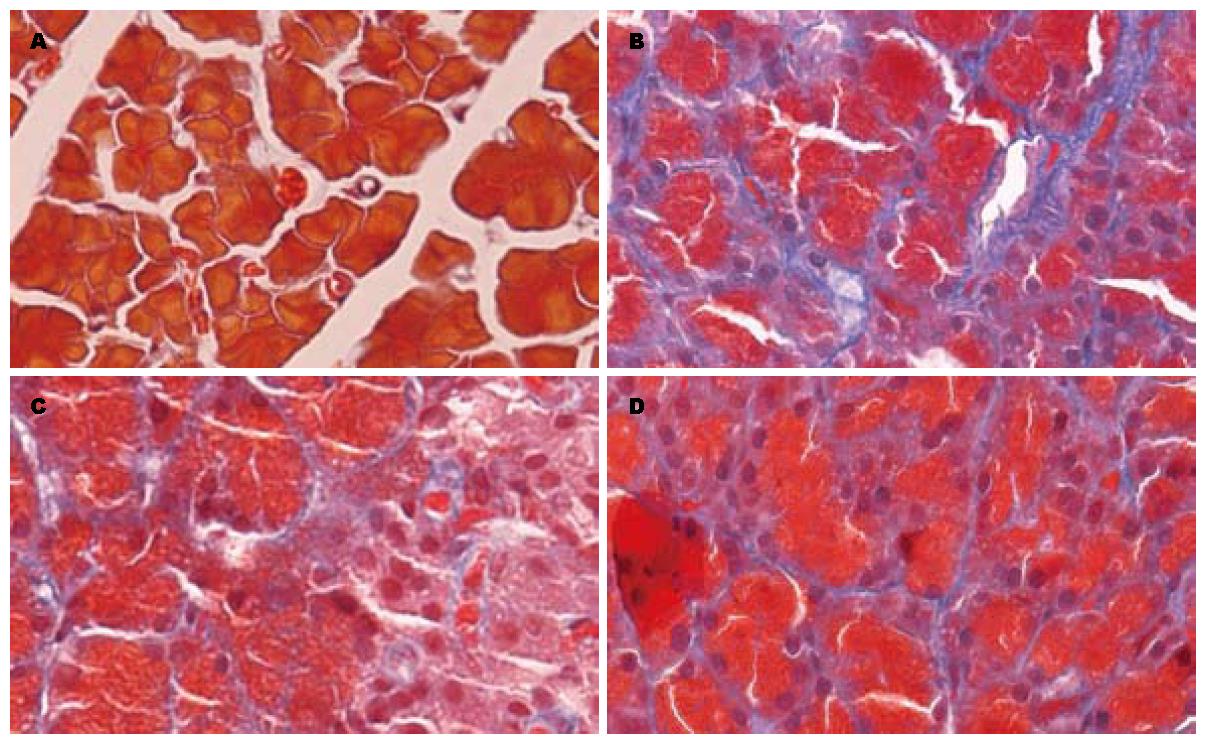
1.2.2 病理学观察: Masson染色法对胰腺组织进行染色, 镜下观察腺泡及红细胞呈红色, 胶原纤维呈蓝色丝状, 计算胶原纤维在400倍镜下标本四角及中央5个视野中的面积百分比, 以纤维占视野面积的百分比表示胶原含量, 取平均值进行统计分析.
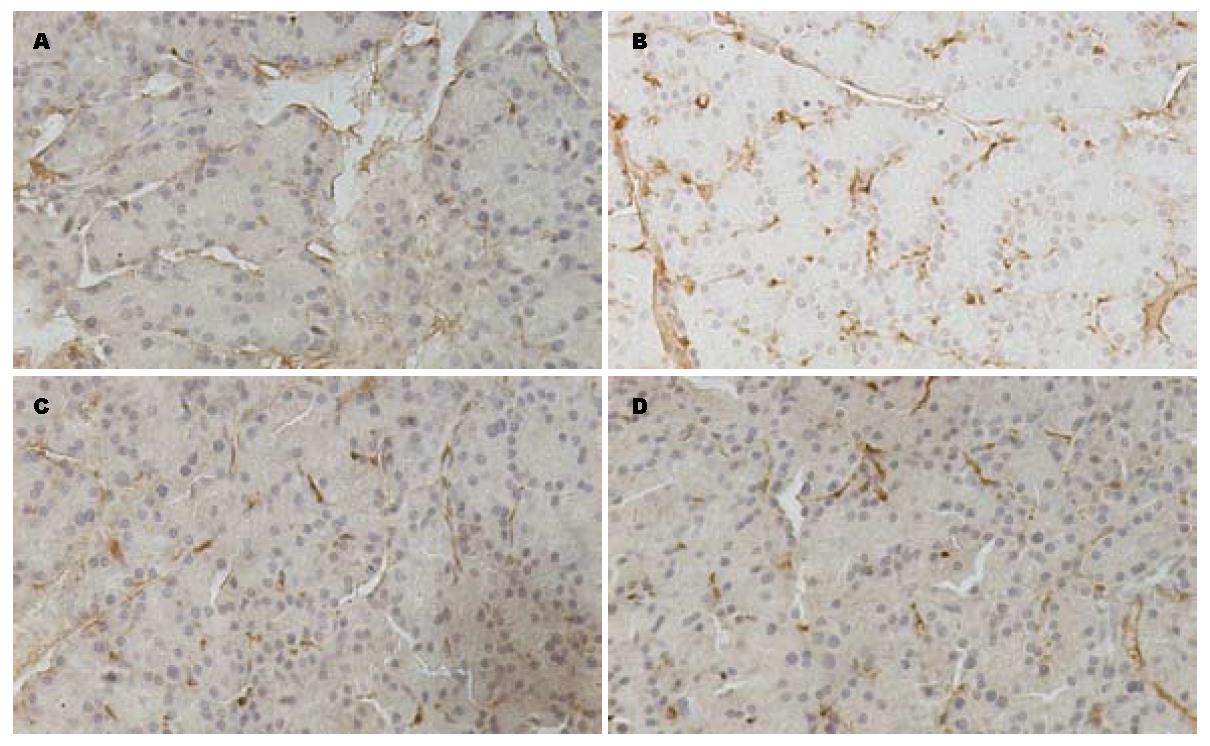
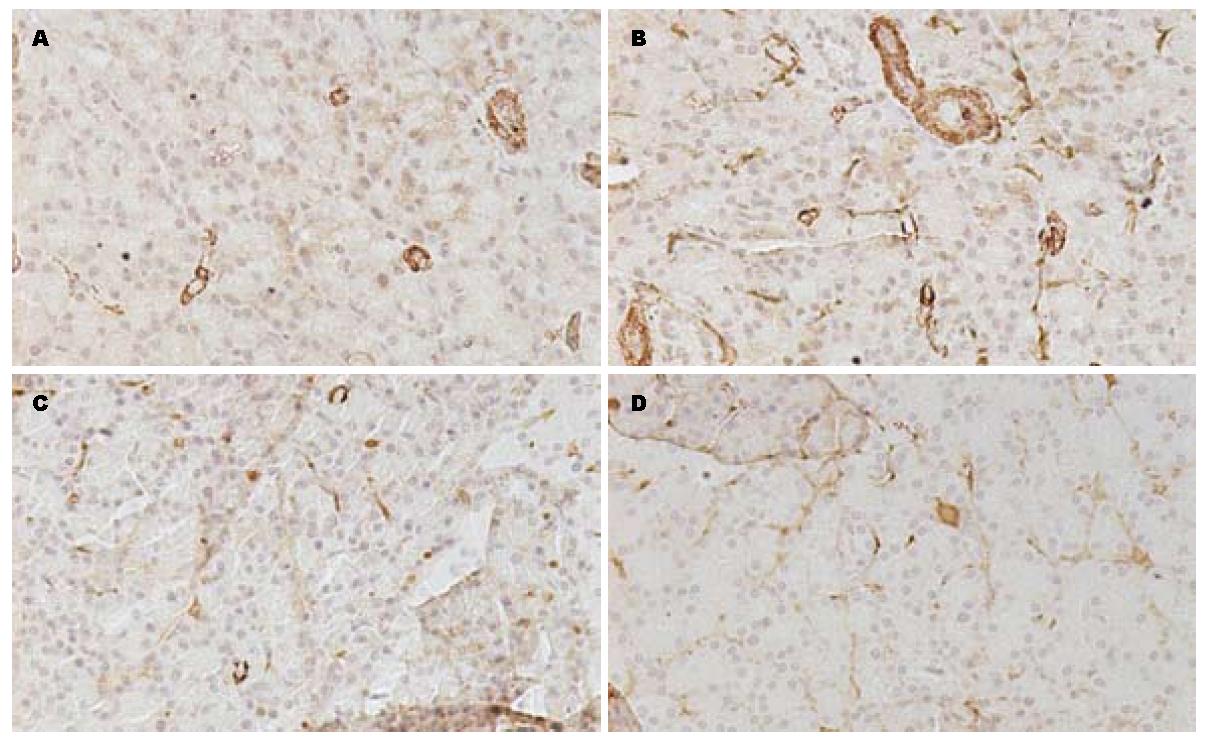
1.2.3 免疫组织化学法观察Ⅰ型胶原、α-SMA在胰腺组织的定位: 多聚赖氨酸石蜡切片脱蜡至水, 3% H2O2 20 min去除内源性过氧化物酶, 漂洗后浸入0.01 mol/L pH6.0的枸橼酸钠缓冲液中微波修复, 漂洗后用5%正常小牛血清封闭20 min, 滴加PBS 1:50稀释的兔抗大鼠Ⅰ型胶原多克隆抗体/小鼠抗大鼠α-SMA单克隆抗体50 μL, 实验对照组切片以PBS代替一抗, 37 ℃水浴上孵育2 h. PBS冲洗后, 滴加生物素化山羊抗兔IgG(即用型)/生物素化羊抗小鼠IgG, 37 ℃孵育20 min. PBS冲洗, HRP标记的链霉卵白素(即用型)/SABC, 37 ℃孵育20 min, PBS冲洗, 将DAB显色液按顺序(A、B、C)各1滴混合, 用1 mL双蒸水稀释, DAB显色观察到有黄色出现后(约10 s), 用蒸馏水冲洗. 苏木素复染, 乙醇梯度脱水, 封片, 镜下观察.
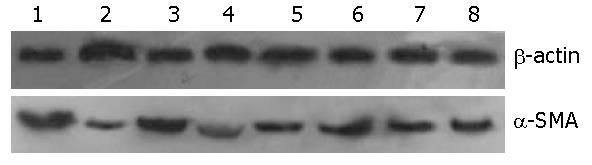
1.2.4 Western blot法检测α-SMA含量: 将提取的蛋白样品用BCA蛋白浓度测定试剂盒测定总蛋白浓度, 稀释到总蛋白浓度为5 g/L, 用聚丙烯酰胺凝胶电泳法(积层胶为5%, 分离胶为10%)分离, 积层胶电压80 V, 持续20 min, 分离胶电压120 V, 持续100 min; 将PVDF膜平衡后在14 V恒压下转印250 min; 将PVDF膜用5%脱脂奶粉PBS液封闭; 小鼠抗大鼠α-SMA单克隆抗体(用封闭液稀释, 比例1:300)孵育120 min; 漂洗后以辣根过氧化物酶标记的羊抗小鼠IgG(用封闭液稀释, 比例1:500)室温下震荡孵育80 min, ECL化学发光显色, 暗室中拍片. 以β-actin作为内参. 将结果扫描成电子图像, 以Image Pro Plus 5.0图像分析软件分析, 计算出吸光度值, 取前后两者的比值作为α-SMA蛋白的相对表达量.
统计学处理 所有的数值均用mean±SD表示, 各组之间比较采用单因素方差分析法, LSD法进行两两比较, 采用检验水准P = 0.05. 全部数据的统计学处理均采用SPSS 12.0 for windows分析软件.
Masson染色可见胶原纤维面积百分比在20 d时CP组、OP组、OT组和NC组分别为22.54%±4.45%, 13.16%±1.84% 19.58%±2.78%, 2.45%±0.24%; 在40 d时CP组、OP组、OT组、NC组分别为35.14%±3.27%, 25.14%±3.67%, 28.68%±2.55%, 3.0%±0.32%(表1, 图1).
免疫组织化学切片显示在NC组Ⅰ型胶原主要位于胰腺组织周边; CP组除在上述部位外, Ⅰ型胶原还表达于腺泡间及小叶周围; NC组α-SMA在血管壁平滑肌表达阳性, 其余部位未见表达; CP组α-SMA在腺泡间有阳性表达; 在OT、OP组的免疫组织化学切片中Ⅰ型胶原、α-SMA在腺泡间的有少量表达(图2, 图3).
α-SMA与β-actin的相对表达量在20 d时CP组、OP组、OT组、NC组分别为1.06±0.04, 0.92±0.05, 0.95±0.03, 0.73±0.06; 在40 d时CP组、OP组、OT组、NC组分别为1.16±0.03, 0.97±0.02, 0.99±0.05, 0.78±0.06(表2, 图4).
酗酒[2]、吸烟[2]、病毒感染[3]、氧自由基[4,5]、胰腺导管内压力增高[6]等均可活化PSC. 活化后的PSC体积变大, 数量增多, 转变为α-SMA染色阳性的类成纤维细胞, 细胞外基质的合成分泌增多[7].
研究表明, 氧自由基在活化PSC的过程中发挥重要作用, 过多的氧自由基可以活化有丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路, 诱导Ⅰ型前胶原基因表达, 可以活化PSC, 增加α-SMA阳性细胞的数量, 增加Ⅰ型胶原、基质金属蛋白酶(matrix metalloproteinase, MMP)的分泌及TGF-β1的分泌[4,5,8,9]. 本实验中二乙基硫代氨基甲酸盐(DDC)是超氧化物歧化酶(SOD)抑制剂, 可以抑制SOD, 减少组织中氧自由基的清除, 参照Matsumura等[1]所述造模方法给予大鼠腹腔注射700 mg/kg的DDC制备慢性胰腺炎模型, 发现分别在20、40 d时, 正常大鼠胰腺组织间质中极少量存在的纤维组织在模型组明显增多, 并随着用药的延长, 纤维化程度逐渐加重. 用Masson染色法可清楚看到模型组胰腺组织的小叶周围有大量丝状蓝染的胶原纤维组织, 炎症细胞浸润, 本实验模型未发现胰腺腺泡细胞大量的坏死、萎缩, 考虑原因可能有: (1)造模时间短, 纤维化程度轻, 可以延长造模时间来观察其能否发展为重度纤维化. (2)DDC诱导大鼠胰腺组织纤维化不遵循胰腺组织坏死-纤维化的顺序, 其机制可能与氧自由基增多直接导致PSC活化后表达ECM增多有关. 在本实验中用免疫组织化学的方法发现, Ⅰ型胶原在腺泡间及小叶周围表达增多; 同时, α-SMA的表达增强, 主要表达于血管周围, 腺泡间及小叶周围. 与文献报道一致[4,5,7].
近期研究发现, 血管紧张素转换酶抑制剂可以减少胰腺腺泡细胞的凋亡及PSC的生成, 减轻炎症反应及纤维化[10]; 别嘌呤醇可以减少胶原沉积和小叶的萎缩, 抑制PSC的活化, 阻止纤维化的形成[11]; vit-A可以抑制PSC活化及α-SMA、Ⅰ型胶原、纤维连接蛋白、层粘连蛋白的表达[12]. Troglitazone是PSC活化的体外拮抗物, 可以减少细胞增殖和α-SMA的表达[13], 减轻胰腺炎症及纤维化[14], 阻抑ECM合成与促炎因子产生[15,16]. OM有多方面的药理作用, 尤其在抗肝纤维化有显著疗效[17,18], 近期研究表明OM还可以抑制体外培养的细胞株所携带的乙型肝炎病毒[19]. 用30、60、100 mg/kg OM给大鼠灌胃或者腹腔内注射可以预防大鼠肝纤维化发生[20]. 本实验用100 mg/kg OM分别于同时、1 wk后干预模型组大鼠发现, 经OM干预后, 小叶间蓝染的胶原纤维明显减少, 胰腺纤维化程度减轻, Ⅰ型胶原及α-SMA的表达较模型组减少. 为进一步验证OM对α-SMA表达的影响, 用Western blot法检测胰腺组织中α-SMA的相对含量发现, α-SMA在模型组较对照组显著增高, OM干预后可降低其表达, 说明OM可以抑制PSC从静止向活化的转化, 通过减少胰腺组织内胶原的生成及α-SMA的表达抑制胰腺纤维化的发展.
慢性胰腺炎主要以胰腺纤维化为病理特征, 临床表现为腹痛、脂肪泻和糖尿病等症状. 国内外的发病率呈上升趋势, 目前尚无针对胰腺纤维化的治疗措施, 对于慢性胰腺炎的治疗仍是一个世界级难题.
田字彬, 教授, 青岛大学医学院附属医院消化内科.
各种损伤因子通过多种细胞内信号通路激活PSC, 活化后的PSC增殖合成细胞外基质, 促进纤维化的形成.目前针对各种信号通路, 已有多种试剂与药物包括抗氧化剂、PPAR-γ配体曲格列酮、curcumin、蛋白酶抑制剂、血管紧张素Ⅱ受体拮抗剂等在动物模型上取得令人鼓舞的抗纤维化与抗炎效果, 为治疗胰腺纤维化与炎症带来广阔的前景.
Tanioka等用二甲基二硫代氨基甲酸盐(DDC)可以活化PSC, 增加α-SMA阳性细胞的数量, 增加Ⅰ型胶原和MMP的分泌, TGF-β1的分泌也增加.
OM在治疗慢性肝炎和肝纤维化等方面已经得到了广泛的应用, 抑制肝星状细胞的增殖为其作用机制之一, 而肝星状细胞与胰腺星形细胞生物学特性极其相似, 本实验研究了OM对胰腺纤维化的治疗作用并初步探讨了其作用机制.
OM可以抑制PSC从静止向活化的转化, 通过减少胰腺组织内胶原的生成及α-SMA的表达抑制胰腺纤维化的发展, 为OM在抗纤维化的应用方面提供依据.
有丝分裂原活化蛋白激酶(MAPK): 是丝氨酸/色氨酸特异性蛋白酶家族, 在调节细胞基因表达、增生、细胞存活与凋亡以及细胞死亡等方面有广泛的生物学作用.
本研究科学性、创新性均较好, 有一定的基础研究水平.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Matsumura N, Ochi K, Ichimura M, Mizushima T, Harada H, Harada M. Study on free radicals and pancreatic fibrosis--pancreatic fibrosis induced by repeated injections of superoxide dismutase inhibitor. Pancreas. 2001;22:53-57. [PubMed] [DOI] |
| 2. | Yadav D, Hawes RH, Brand RE, Anderson MA, Money ME, Banks PA, Bishop MD, Baillie J, Sherman S, DiSario J. Alcohol consumption, cigarette smoking, and the risk of recurrent acute and chronic pancreatitis. Arch Intern Med. 2009;169:1035-1045. [PubMed] [DOI] |
| 3. | Jerrells TR, Vidlak D, Strachota JM. Alcoholic pancreatitis: mechanisms of viral infections as cofactors in the development of acute and chronic pancreatitis and fibrosis. J Leukoc Biol. 2007;81:430-439. [PubMed] [DOI] |
| 4. | Kikuta K, Masamune A, Satoh M, Suzuki N, Satoh K, Shimosegawa T. Hydrogen peroxide activates activator protein-1 and mitogen-activated protein kinases in pancreatic stellate cells. Mol Cell Biochem. 2006;291:11-20. [PubMed] [DOI] |
| 5. | Tanioka H, Mizushima T, Shirahige A, Matsushita K, Ochi K, Ichimura M, Matsumura N, Shinji T, Tanimoto M, Koide N. Xanthine oxidase-derived free radicals directly activate rat pancreatic stellate cells. J Gastroenterol Hepatol. 2006;21:537-544. [PubMed] [DOI] |
| 6. | Watanabe S, Nagashio Y, Asaumi H, Nomiyama Y, Taguchi M, Tashiro M, Kihara Y, Nakamura H, Otsuki M. Pressure activates rat pancreatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1175-G1181. [PubMed] [DOI] |
| 7. | Neuschwander-Tetri BA, Bridle KR, Wells LD, Marcu M, Ramm GA. Repetitive acute pancreatic injury in the mouse induces procollagen alpha1(I) expression colocalized to pancreatic stellate cells. Lab Invest. 2000;80:143-150. [PubMed] [DOI] |
| 8. | Asaumi H, Watanabe S, Taguchi M, Tashiro M, Otsuki M. Externally applied pressure activates pancreatic stellate cells through the generation of intracellular reactive oxygen species. Am J Physiol Gastrointest Liver Physiol. 2007;293:G972-G978. [PubMed] [DOI] |
| 10. | Madro A, Korolczuk A, Czechowska G, Celiński K, Słomka M, Prozorow-Król B, Korobowicz E. RAS inhibitors decrease apoptosis of acinar cells and increase elimination of pancreatic stellate cells after in the course of experimental chronic pancreatitis induced by dibutyltin dichloride. J Physiol Pharmacol. 2008;59 Suppl 2:239-249. [PubMed] |
| 11. | Tasci I, Deveci S, Isik AT, Comert B, Akay C, Mas N, Inal V, Yamanel L, Mas MR. Allopurinol in rat chronic pancreatitis: effects on pancreatic stellate cell activation. Pancreas. 2007;35:366-371. [PubMed] [DOI] |
| 12. | McCarroll JA, Phillips PA, Santucci N, Pirola RC, Wilson JS, Apte MV. Vitamin A inhibits pancreatic stellate cell activation: implications for treatment of pancreatic fibrosis. Gut. 2006;55:79-89. [PubMed] [DOI] |
| 13. | Masamune A, Kikuta K, Satoh M, Sakai Y, Satoh A, Shimosegawa T. Ligands of peroxisome proliferator-activated receptor-gamma block activation of pancreatic stellate cells. J Biol Chem. 2002;277:141-147. [PubMed] [DOI] |
| 14. | Shimizu K, Shiratori K, Hayashi N, Kobayashi M, Fujiwara T, Horikoshi H. Thiazolidinedione derivatives as novel therapeutic agents to prevent the development of chronic pancreatitis. Pancreas. 2002;24:184-190. [PubMed] [DOI] |
| 15. | Shimizu K, Shiratori K, Kobayashi M, Kawamata H. Troglitazone inhibits the progression of chronic pancreatitis and the profibrogenic activity of pancreatic stellate cells via a PPARgamma-independent mechanism. Pancreas. 2004;29:67-74. [PubMed] [DOI] |
| 16. | Hisada S, Shimizu K, Shiratori K, Kobayashi M. Peroxisome proliferator-activated receptor gamma ligand prevents the development of chronic pancreatitis through modulating NF-kappaB-dependent proinflammatory cytokine production and pancreatic stellate cell activation. Rocz Akad Med Bialymst. 2005;50:142-147. [PubMed] |
| 17. | Lu LG, Zeng MD, Mao YM, Fang JY, Song YL, Shen ZH, Cao AP. Inhibitory effect of oxymatrine on serum hepatitis B virus DNA in HBV transgenic mice. World J Gastroenterol. 2004;10:1176-1179. [PubMed] |
| 18. | Liu J, Manheimer E, Tsutani K, Gluud C. Medicinal herbs for hepatitis C virus infection: a Cochrane hepatobiliary systematic review of randomized trials. Am J Gastroenterol. 2003;98:538-544. [PubMed] [DOI] |