修回日期: 2010-03-30
接受日期: 2010-04-07
在线出版日期: 2010-05-08
目的: 探讨食管鳞癌细胞和组织中STMN1的表达与食管鳞癌病理分级的关系.
方法: 一维(1-D)Western blot分析8种食管鳞癌细胞的STMN1表达, 二维(2-D)Western blot分析KYSE180食管鳞癌细胞中STMN1的表达与修饰状态. 免疫组织化学分析食管鳞癌组织及其配对样本食管上皮STMN1表达和定位, 以及卡方检验统计分析食管癌组织STMN1表达与临床分级的关系.
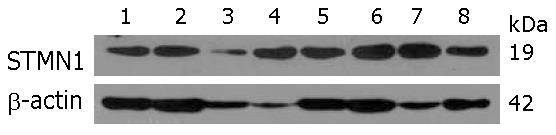
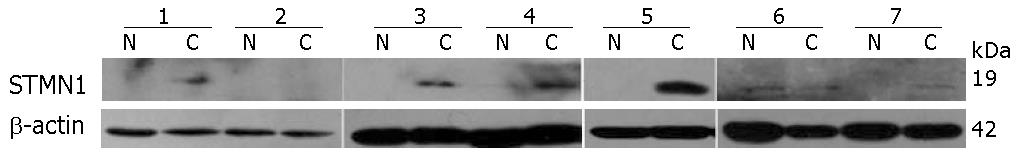
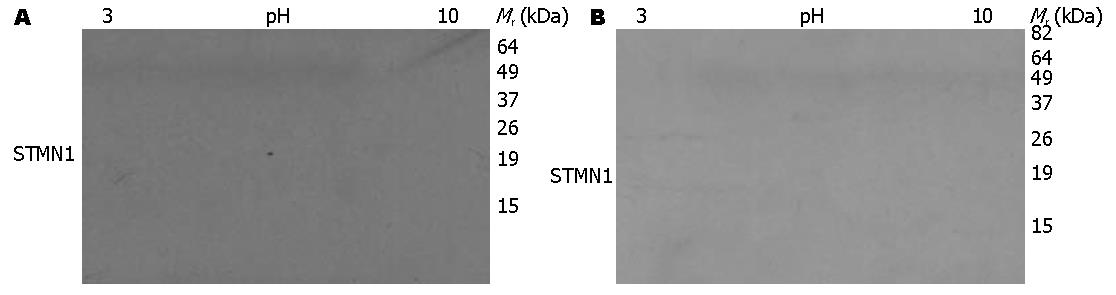
结果: STMN1在人食管鳞癌细胞WHCO1、EC0156、KYSE510、KYSE180、KYSE170、KYSE150、KYSE140和KYSE30中广泛表达. 2-D Western blot结果表明STMN1在食管癌细胞KYSE180中呈现为一个具有较强信号的蛋白点和另一个具有较弱信号的, 等电点偏碱性的蛋白点, 提示STMN1可能存在特定修饰状态. Western blot结果显示, 与正常食管上皮相比, 食管癌组织中STMN1表达升高(69.2%, 9/13). 食管癌组织芯片免疫组织化学分析结果显示STMN1在72%(13/18)肿瘤组织中高表达较STMN1在17.6%(3/17)癌旁食管上皮表达具有统计学意义(P<0.05), 但与组织病理分级无关(P = 0.646).
结论: STMN1蛋白在食管鳞癌细胞和组织表达上调并伴随部分修饰, 提示在食管鳞癌组织中STMN1具有癌基因的作用, 参与食管癌变进程.
引文著录: 刘飞, 刘芳, 孙玉琳, 赵晓航. 微管不稳定蛋白在食管癌细胞和组织中的表达及意义. 世界华人消化杂志 2010; 18(13): 1306-1312
Revised: March 30, 2010
Accepted: April 7, 2010
Published online: May 8, 2010
AIM: To investigate the expression of Stathmin 1 (STMN1) protein in esophageal squamous cell carcinoma (ESCC) tissue and cell lines and to evaluate its correlation with the clinicopathologic parameters of ESCC.
METHODS: One-dimensional (1-D) Western blot was performed to determine the expression of STMN1 in 8 ESCC cell lines. Two-dimensional (2-D) Western blot was used to determine modified STMN1 in KYSE180 cells. Western blot and immunohistochemistry (IHC) were employed to determine the expression of STMN1 in ESCC specimens. The chi-square test was used to analyze IHC results.
RESULTS: STMN1 was widely expressed in ESCC cells, including WHCO1, EC0156, KYSE510, KYSE180, KYSE170, KYSE150, KYSE140 and KYSE30 cell lines. Two STMN1 protein spots were detected in KYSE180 cells on 2-D Western blot: one stronger signal and one weaker signal located in more basic area, which suggests that STMN1 protein may be modified in KYSE180 cells. Western blot analysis showed that STMN1 was overexpressed in 69.2% (9/13) of ESCC specimens compared with their normal epithelial counterparts. IHC assay also demonstrated that the positive rate of STMN1 expression was significantly higher in ESCC tissue than in matched adjacent normal tissue (P < 0.05). STMN1 expression is not correlated with age, gender, differentiation, tumor grade and lymph node metastasis.
CONCLUSION: The expression of STMN1 protein is up-regulated in both ESCC tissue and cell lines and may be modified in some ESCC cell lines. STMN1 might exert an oncogenic function in ESCC. Dynamic measurement of STMN1 expression level might aid to evaluate the progression of ESCC.
- Citation: Liu F, Liu F, Sun YL, Zhao XH. Significance of STMN1 expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1306-1312
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1306
微管不稳定蛋白(stathmin 1, STMN1)是一种重要的微管调节蛋白[1]. STMN1最初在白血病细胞HL60中发现, 又称为p17、p19、19K、metablastin、Prosolin、Protein Pr22、白血病相关磷酸化蛋白p18、原癌蛋白18、LAP18和Op18等. 微管在生物机体细胞内发挥着支架、胞内物质运输和形成纺锤体的重要功能. 而STMN1起着结合α/β微管蛋白从而解聚微管的功能, 因此STMN1通过微管在细胞的生命活动过程中扮演着重要的角色. STMN1在多种恶性肿瘤的发生发展过程中发挥了重要作用. STMN1是一种广泛存在的胞质蛋白, 在哺乳动物神经组织中表达最高. STMN1蛋白含有149个氨基酸, 4个结构域, 分为N端调节部分和C端作用部分, 核心部分位于42至126位氨基酸. STMN1蛋白与α/β微管蛋白结合, 促进微管解聚和抑制微管合成. 研究表明STMN1参与细胞骨架的形成及维持、胞内物质运输、细胞黏附与移行、细胞增殖、分化和死亡[2]. STMN1解聚微管的功能受其磷酸化水平的严格调控[3]. 磷酸化的STMN1结合游离α/β微管蛋白的功能消失, 微管随之延长. STMN1与恶性肿瘤发生发展密切相关, 在白血病、淋巴瘤、成神经细胞瘤、卵巢癌、前列腺癌、乳腺癌、肺癌和间皮瘤等恶性肿瘤中STMN1蛋白表达升高[4-6]. 食管癌是我国常见消化系恶性肿瘤, 以食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)为主. 目前关于STMN1在食管癌发病中作用的研究报道较少. 本研究采用1-D和2-D Western blot方法, 分析STMN1在8种人食管鳞癌细胞系和食管鳞癌组织中的表达和修饰改变; 免疫组织化学分析食管鳞癌组织及其配对食管上皮STMN1的表达和定位改变, 以及与食管癌病理分期的关系, 对认识STMN1在食管鳞癌中作用机制具有重要意义.
人食管鳞癌细胞系ECO156由本实验室建系[7], WHCO1由南非开普敦大学Hendricks博士惠赠[8], KYSE510、KYSE180、KYSE170、KYSE150、KYSE140和KYSE30由日本京都大学Shimada Y博士惠赠. STMN1抗体购自Cell Signaling Technology公司. β-actin抗体购自Sigma公司. 7 cm(pH3-10, 线性)固相pH梯度干胶条(IPGs)购自Amersham Biosciences公司. 13对食管鳞状细胞癌/癌旁远端配对组织样本取自中国医学科学院肿瘤医院胸外科单纯手术治疗患者, 并经病理证实. 组织标本一经分离, 迅速去除坏死及结缔组织, 经预冷的生理盐水多次清洗后液氮速冻, 转入-80 ℃冰箱保存. 患者平均年龄58.1(32-72)岁, 其中男10例, 女3例. 病例取材得到患者本人知情同意, 患者术前未接受输血和放化疗. 含有31对食管癌组织微阵列芯片购自上海芯超生物科技有限公司. EliVision plus试剂盒购自福建迈新生物有限公司.
1.2.1 细胞培养: EC0156和WHCO1细胞培养于含100 mL/L胎牛血清的DMEM培养基中. KYSE510、KYSE180、KYSE170、KYSE150、KYSE140和KYSE30细胞培养于含100 mL/L胎牛血清的RPMI 1640培养基中. 上述两种培养基在使用前添加100 IU/mL青霉素和100 g/L链霉素. 所有细胞均置于含50 mL/L CO2的37 ℃孵育箱内培养, 每3-5 d传代1次.
1.2.2 总蛋白提取: 使用直径10 cm的培养皿培养细胞, 待细胞数达到约1×107时备用. 使用4 ℃预冷的1×PBS洗2次, 每次5 mL. 在培养皿中加入预冷的细胞裂解液1 mL, 用细胞刮子迅速刮下细胞并收集至2 mL离心管中. 冰上超声, 4 ℃离心, 12 000 g×15 min, 收集上清, 分装后于-80 ℃保存. 上清中吸出20 μL, 用Bradford法进行蛋白定量.
1.2.3 双向电泳(2-DE): 将80-100 μg蛋白加入到155 μL水化液(8 mol/L脲; 2% CHAPS; 65 mmol/L DTT; 0.5% IPG 缓冲液, pH3-10; 痕量溴酚蓝)中使蛋白充分溶解后, 缓慢加入到IPG沟槽内, 将7 cm的线性IPG胶条(pH3-10)胶面朝上缓慢插入其中, 胶条阳性端靠近槽底部, 避免产生气泡, 用胶带封闭上样孔和底部的透气孔, 室温水化10-12 h后行等电聚焦分离. 电压条件设置为0 V, 4 h; 50 V, 8 h; 500 V, 1 h; 1 000 V, 1 h; 4 000 V, 1 h; 8 000 V, 1 h; 8 000 V, 2 h. IPG胶条经平衡液(50 mmol/L Tris-Cl, pH8.8; 6 mol/L脲; 30%甘油; 2% SDS; 65 mmol/L DTT; 痕量溴酚蓝)平衡15 min. 将胶条转入烷基化平衡液(50 mmol/L Tris-Cl, pH8.8, 6 mol/L脲, 30%甘油; 2% SDS; 140 mmol/L碘乙酰胺; 痕量溴酚蓝)中烷化15 min. 经等电聚焦分离后的IPG胶条水平放置于12%的聚丙烯酰胺凝胶上方, 用0.5%琼脂糖密封胶条后, 行SDS-PAGE分离, 电泳条件为80 V电泳2.5-3 h.
1.2.4 蛋白质印迹方法检测STMN1: 取提取的细胞系和食管癌组织部分总蛋白经15% SDS-PAGE电泳分离, 湿转法将蛋白转印至PVDF膜, 10%脱脂奶粉-PBS室温封闭3 h, 然后与1:200比例稀释的STMN1抗体室温孵育3 h或4 ℃过夜, 再与辣根过氧化物酶(HRP)标记二抗孵育1 h后, ECL化学发光作用3 min后曝光、显影和定影.
1.2.5 免疫组织化学分析: 按EliVision plus试剂盒说明书操作. 主要步骤如下: 组织芯片经二甲苯脱蜡, 梯度乙醇水化, 用1×PBS(pH7.4)洗3次, 每次3 min. 经10 mmol/L pH6.0枸橼酸盐缓冲液, 100 ℃孵育10 min后, 1×PBS洗3次, 每次3 min; 3%过氧化氢溶液(H2O2)室温孵育10 min, 后1×PBS洗3次, 每次3 min; 增强液孵育20 min, 1×PBS洗3次, 每次3 min; 酶标聚合物孵育30 min, 1×PBS洗3次, 每次3 min; DAB染色, 复染, 脱水, 透明, 封片. 相同含量无关免疫球蛋白替代一抗, 作为阴性对照. 结果判断: 高倍镜下, 胞质出现黄色颗粒判断为阳性, 如无明显变化则视为阴性.
统计学处理 数据分析使用SPSS16.0统计软件. 采用行×列表χ2检验进行统计分析, 当P<0.05时认为差异有统计学意义.
不同食管 食管癌细胞系中均表达(图1).
食管癌与癌旁食管上皮配对组织蛋白Western blot分析, 结果显示STMN1相对分子质量约为19 kDa(图2), 食管癌组织中STMN1蛋白表达水平较癌旁食管上皮升高69.2%(9/13).
采用2-D Western blot分析了食管癌与癌旁配对组织蛋白样本. 结果显示, STMN1在癌组织表达, 其相对分子质量约为19 kDa, 等电点约为5.7(图3), 与STMN1的理论相对分子质量和等电点一致. 与此对应的正常食管上皮组织中没有检测到该蛋白信号.
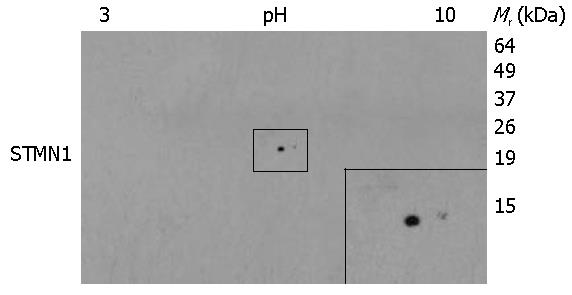
食管癌细胞KYSE180中STMN1表达的2-D Western blot分析(图4), 结果表明, STMN1共有两个蛋白点, 信号较强的蛋白点相对分子质量稍大(约19 kDa), 而信号较弱蛋白点的等电点偏碱性, 提示在KYSE180细胞中, STMN1具有特定修饰.
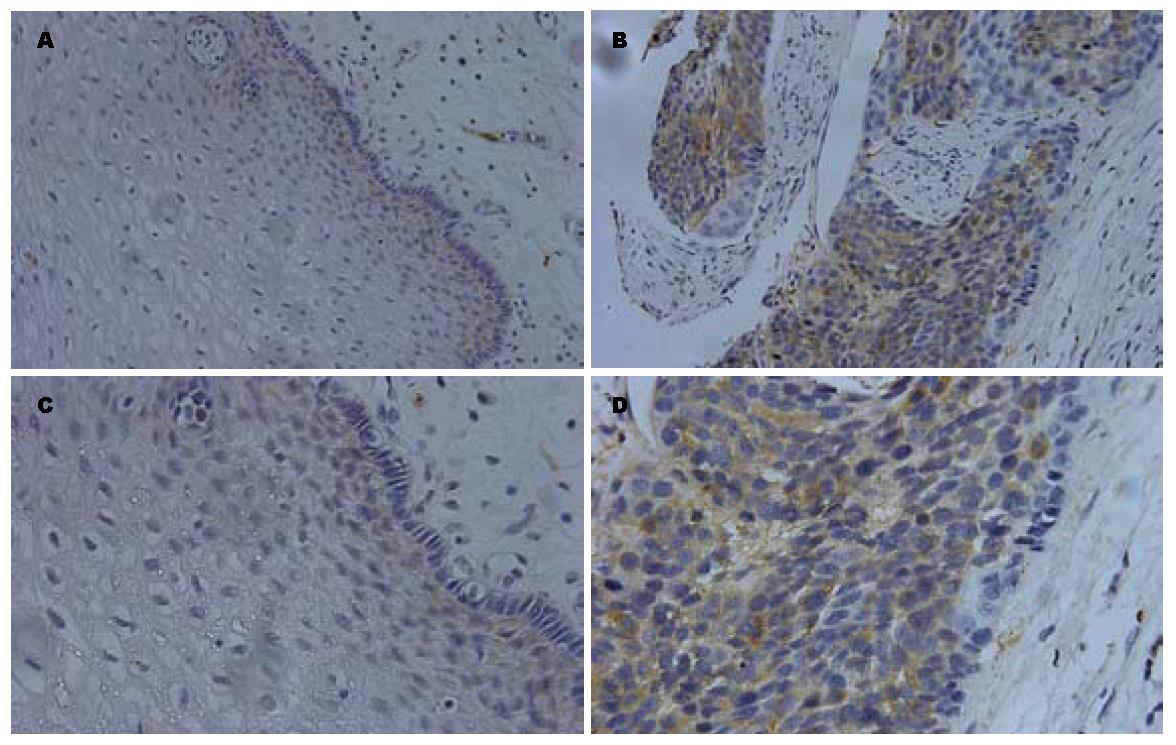
食管癌多组织阵列上STMN1免疫组织化学染色后, 食管癌有效例数为18例、癌旁食管上皮有效例数为17例、癌与癌旁匹配(同一患者来源)的有效例数为13例(表1, 表2). STMN1在3例正常食管上皮组织中呈弱阳性表达(图5A, C), 阳性率为17.6%(3/17); 食管癌组织中有13例STMN1表达阳性(图5B, D), 阳性率为72%(13/18). STMN1在食管癌和癌旁食管上皮中均位于胞质(图5). 四格表Fisher确切检验(P = 0.002)显示差异有统计学意义(P<0.05), 表明STMN1在食管癌中表达升高.
| 分组 | 阳性 | 阴性 | 有效 |
| 癌 | 13 | 5 | 18 |
| 正常 | 3 | 14 | 17 |
| 分组 | 阳性 | 阴性 | 有效 |
| 高分化组 | 3 | 1 | 4 |
| 中分化组 | 6 | 3 | 9 |
按照食管癌组织芯片病理分级进行阳性例数统计列表(表2), 经Fisher确切概率法计算P = 0.471, 表明STMN1表达与食管癌组织病理分级无关.
STMN1蛋白全长149个氨基酸, 是一种重要的微管功能调节蛋白. STMN1通过结合α/β微管蛋白而解聚微管, 在细胞的生命活动过程中扮演重要的角色. 微管解聚与聚合发生在微管末端, STMN1主要作用于微管"+"末端, 通过捕获微管蛋白异二聚体和减少游离的微管蛋白的浓度, 减慢微管末端的聚合速度[9].
STMN1的功能与磷酸化水平密切相关.未磷酸化的STMN1既促进微管解聚, 同时也结合至α/β微管蛋白, 形成三元复合物, 结合过程可逆, 最终形成比较稳定的STMN1-α/β复合物. 当STMN1发生磷酸化后, 其解聚微管主要功能受到抑制, 而去磷酸化后, 蛋白功能迅速恢复而发挥解聚微管的作用. 磷酸化的STMN1解聚微管功能消失, 三元复合物解体, 释放微管二聚体, 参加微管多聚化, 使微管不断延长[10,11].
STMN1蛋白共有4个磷酸化位点, 分别位于Ser-16、Ser-25、Ser-38和Ser-63, 其磷酸化受到一系列蛋白激酶作用[12]. Ser-25和Ser-38是MAP激酶的磷酸化位点, Ser-16是钙离子依赖激酶的磷酸化位点. Ser-63是cAMP依赖蛋白激酶的靶点[4]. 当细胞进入有丝分裂后, Ser-16发生磷酸化, 抑制其解聚微管的功能. 分裂完成后Ser-16则去磷酸化, STMN1解聚微管. Manna等[3]发现只要磷酸化STMN1 16或者63位Ser, 就会强烈降低STMN1结合游离微管蛋白的能力. 而即使同时磷酸化Ser-25和Ser-38丝毫不影响STMN1结合游离微管的能力, 微管照样缩短. 相比而言, Ser-16和Ser-63对于STMN1的作用转换更为关键, 只要能磷酸化Ser-16和Ser-63的激酶就能完全调节微管的功能[4]. Chen等[13]发现BGLF4能磷酸化STMN1的Ser-16、Ser-25和Ser-38, 而且与BGLF4的表达水平呈剂量依赖性, 但是BGLF4对Ser-63的磷酸化作用非常弱. 本文2-D Western blot结果发现在KYSE180细胞中检测到两个STMN1信号点, 信号较强的蛋白点相对分子质量稍大, 而信号较弱蛋白点的等电点偏碱性, 提示在KYSE180细胞中STMN1受到某种特定修饰.
与其他许多重要蛋白一样, STMN1的功能在细胞内受到严格调控. 研究发现STMN1受Rac/Cdc42调节. Rac/Cdc42是1种Rho GTPase相关蛋白, 参与调控肌动蛋白细胞骨架[14]. STMN1的活性还受到p53和E2F的调节. p53升高, STMN1则迅速降低, 有人推测p53是STMN1的一个抑制因子. 在恶性神经胶质瘤中, 高表达p53导致STMN1降低, 使细胞分裂停滞在分裂的关键时期G2/M期, G2/M期细胞数量大大增加[15]. E2F也能引起STMN1的明显降低[16]. 据此推测, STMN1可能参与了细胞周期检验点控制. 抑制细胞STMN1会导致出现多倍体也是另一个佐证. Baldassarre等[17]发现上调p27能抑制STMN1参与解聚微管的功能, 肿瘤细胞的迁移、分裂与增殖能力均有明显降低. 肺腺癌细胞A549中内源或外源表达Egr1蛋白后, STMN1的启动子活性明显降低同时STMN1蛋白表达水平随之降低. 因此Egr1是一个新的调节STMN1的蛋白因子[18]. 转移生长因子诱导早期基因1(Transforming growth factor-beta inducible early gene 1, TIEG1)是一种通过TGF-beta通路诱发凋亡的蛋白, 下调STMN1明显与TIEG1相关联, 同时异位高表达STMN1抑制肿瘤细胞TIEG1介导的生长抑制, siRNA STMN1会抑制胰腺癌细胞生长, 因此STMN1可能是TIEG1的一个下游靶蛋白[19]. 内皮细胞内HIF累积与STMN1表达有关, 是通过PI3K/Akt信号通路实现的, 下调STMN1, 会抑制AKT的活性, 使磷酸化水平降低[20]. Verma等发现STAT3活化后大量结合STMN1, 竞争性抑制STMN1与微管蛋白的结合, 游离微管蛋白大量增加, 微管得以延长[21]. Lin等[22]发现由EBV病毒编码的LMP1能间接的磷酸化STMN1, 促进M期纺锤体的形成.
STMN1对细胞周期和细胞的正常分裂有着非常重要的作用. Balehandran等发现反义阻抑STMN1表达导致红白血病K56细胞增殖率显著降低. Mistry等[23]发现抑制STMN1表达可使白血病细胞失去转化表型, 并抑制其成瘤倾向. 运用反义寡核苷酸抑制Eca109细胞中STMN1表达, Eca109细胞胞体凝缩, 增殖能力减弱, 细胞生长及目的基因表达明显受抑(P<0.05). 细胞分裂阻滞在分裂期的中期, G2/M期细胞比例由12.2±1.0%升至36.5±5.8%[24]. 目前认为, STMN1在有丝分裂期不发挥作用, 使纺锤体正常组装; STMN1在其他细胞周期中均抑制纺锤体的形成.
研究表明, STMN1在包括乳腺癌、肺癌、宫颈癌、卵巢癌和嗜铬细胞瘤等多种恶性肿瘤中高表达. STMN1高表达可作为乳腺癌的预测因子[25]. Alli等[26]发现含有突变型p53基因的人乳腺癌细胞系中STMN1表达增加. Chen等[27]通过免疫组织化学发现中低分化肺腺癌中STMN1阳性率高达70%之多, 而高分化肺腺癌STMN1阳性率不到50%. Xi等发现永生化和宫颈癌细胞中STMN1 mRNA和蛋白水平明显高于正常宫颈上皮组织, 免疫组织化学分析结果也表明宫颈癌组织中STMN1的表达水平明显升高, 而且STMN1的表达与宫颈癌的临床分期、肿块大小、区域淋巴结转移和血液转移都成正相关. 因此, Xi等[28]认为STMN1可以作为宫颈癌的预后预测因子. Su等[29]研究分析了178例卵巢癌病例, 结果表明STMN1高表达的患者比低表达患者的无进展生存期和总生存期明显缩短. 而Sadow等[30]比较了48例嗜铬细胞瘤和28例恶性嗜铬细胞瘤中STMN1的表达水平, 结果表明恶性嗜铬细胞瘤的STMN1表达明显高于良性嗜铬细胞瘤, 良性嗜铬细胞瘤STMN1的表达明显高于正常肾上腺组织. Björklund等[31]运用包含7770个cDNA克隆的表达微阵列筛查11例嗜铬细胞瘤的表达, 结果发现与正常肾上腺组织相比, 瘤组织中STMN1 mRNA表达明显升高. RT-PCR验证结果显示, 良性和恶性嗜铬细胞瘤STMN1 mRNA表达水平分别升高6倍和8倍, 而转移病例中STMN1 mRNA表达水平则升高达16倍. 在肉瘤细胞, 当STMN1过表达时, 细胞移行能力加强; STMN1表达被抑制时, 细胞移行能力降低[17]. RNAi人骨肉瘤细胞株Saos-2和MG63下调STMN1后, 明显抑制细胞增殖能力和致瘤性, 细胞停滞在G2/M期最终引发凋亡. Zhang等[32]发现喉癌中STMN1表达升高69%(24/35), 而STMN1在正常组织表达率仅为33.3%(6/18). 高STMN1表达与成神经管细胞瘤的扩散有关, 患者生存率降低, 平均生存期明显减短[33].
STMN1对恶性肿瘤的化疗效果有很大影响. 研究发现siRNA STMN1和药物紫杉烷有协同效应. 因此下调STMN1有潜在的抗肿瘤效果和增敏化疗药物的作用[34]. 用反义核酸抑制白血病细胞K562 STMN1再加入紫杉醇后, 会导致严重的有丝分裂紊乱(染色体数过少或者多核化). 在细胞分裂阶段产生大量的非整倍体, 凋亡细胞的数目大为增加[35].
本文发现STMN1在食管癌细胞中广泛表达, 对比了STMN1在食管癌组织和癌旁食管上皮中的表达, Western blot结果显示STMN1在食管癌组织中表达升高69.2%(9/13). 组织芯片结果表明食管癌组织中STMN1表达水平升高72%(13/18)与文献报道的其他恶性肿瘤中STMN1阳性表达率升高的结果一致, 提示STMN1在食管癌细胞的发生发展中发挥重要作用.
STMN1是一种重要的微管解聚蛋白, STMN1解聚微管的功能受其磷酸化水平的严格调节, 在多种恶性肿瘤的发生发展过程中发挥了重要作用. 关于STMN1在食管癌发病中作用的研究报道比较少. 本文探讨了STMN1在食管鳞癌中的表达和作用.
姚登福, 教授, 南通大学附属医院分子医学中心.
对STMN1的研究重点目前主要集中在相关疾病特别是恶性肿瘤. 目前的热点主要: (1)在恶性肿瘤中的STMN1的表达水平及功能变化; (2)STMN1对恶性肿瘤药物治疗疗效的影响; (3)机体细胞对STMN1的调控机制.
相关文献表明, stathmin在许多恶性肿瘤组织中高表达而且stathmin的表达水平高低与患者预后有关联, stathmin的高表达对化疗效果存在影响, 可能是不良预后和化疗效果的预测指标之一.
本文首先对8种食管癌细胞系进行了STMN1的表达筛选, 并引入了2-D Western blot技术在食管癌中对STMN1进行验证及相关修饰的探索.
本文为STMN1是否能作为食管癌的一个潜在标志物提供了一个可选项. 另外STMN1的功能与其修饰状态关系很大, 本文在这方面做了些预期的探索, 为深入研究提供了线索.
本研究反映了研究工作的科学问题和特定内容, 简明而有特色, 有较好的科学性和可读性, 能较好地反映我国胃肠病学临床和基础研究的先进水平.
编辑: 王天奇 电编: 吴鹏朕
| 1. | Cassimeris L. The oncoprotein 18/stathmin family of microtubule destabilizers. Curr Opin Cell Biol. 2002;14:18-24. [PubMed] [DOI] |
| 2. | Rana S, Maples PB, Senzer N, Nemunaitis J. Stathmin 1: a novel therapeutic target for anticancer activity. Expert Rev Anticancer Ther. 2008;8:1461-1470. [PubMed] [DOI] |
| 3. | Manna T, Thrower DA, Honnappa S, Steinmetz MO, Wilson L. Regulation of microtubule dynamic instability in vitro by differentially phosphorylated stathmin. J Biol Chem. 2009;284:15640-15649. [PubMed] [DOI] |
| 4. | Liu Z, Lu H, Shi H, Du Y, Yu J, Gu S, Chen X, Liu KJ, Hu CA. PUMA overexpression induces reactive oxygen species generation and proteasome-mediated stathmin degradation in colorectal cancer cells. Cancer Res. 2005;65:1647-1654. [PubMed] [DOI] |
| 5. | Kim JY, Harvard C, You L, Xu Z, Kuchenbecker K, Baehner R, Jablons D. Stathmin is overexpressed in malignant mesothelioma. Anticancer Res. 2007;27:39-44. [PubMed] |
| 6. | Nakashima D, Uzawa K, Kasamatsu A, Koike H, Endo Y, Saito K, Hashitani S, Numata T, Urade M, Tanzawa H. Protein expression profiling identifies maspin and stathmin as potential biomarkers of adenoid cystic carcinoma of the salivary glands. Int J Cancer. 2006;118:704-713. [PubMed] [DOI] |
| 7. | Wang Q, Xu Y, Zhao X, Chang Y, Liu Y, Jiang L, Sharma J, Seo DK, Yan H. A facile one-step in situ functionalization of quantum dots with preserved photoluminescence for bioconjugation. J Am Chem Soc. 2007;129:6380-6381. [PubMed] [DOI] |
| 8. | Wang B, Hendricks DT, Wamunyokoli F, Parker MI. A growth-related oncogene/CXC chemokine receptor 2 autocrine loop contributes to cellular proliferation in esophageal cancer. Cancer Res. 2006;66:3071-3077. [PubMed] [DOI] |
| 9. | Segerman B, Holmfeldt P, Morabito J, Cassimeris L, Gullberg M. Autonomous and phosphorylation-responsive microtubule-regulating activities of the N-terminus of Op18/stathmin. J Cell Sci. 2003;116:197-205. [PubMed] [DOI] |
| 10. | Rubin CI, Atweh GF. The role of stathmin in the regulation of the cell cycle. J Cell Biochem. 2004;93:242-250. [PubMed] [DOI] |
| 11. | Devred F, Tsvetkov PO, Barbier P, Allegro D, Horwitz SB, Makarov AA, Peyrot V. Stathmin/Op18 is a novel mediator of vinblastine activity. FEBS Lett. 2008;582:2484-2488. [PubMed] [DOI] |
| 12. | Mistry SJ, Atweh GF. Role of stathmin in the regulation of the mitotic spindle: potential applications in cancer therapy. Mt Sinai J Med. 2002;69:299-304. [PubMed] |
| 13. | Chen PW, Lin SJ, Tsai SC, Lin JH, Chen MR, Wang JT, Lee CP, Tsai CH. Regulation of microtubule dynamics through phosphorylation on stathmin by Epstein-Barr virus kinase BGLF4. J Biol Chem. 2010;285:10053-10063. [PubMed] [DOI] |
| 14. | Daub H, Gevaert K, Vandekerckhove J, Sobel A, Hall A. Rac/Cdc42 and p65PAK regulate the microtubule-destabilizing protein stathmin through phosphorylation at serine 16. J Biol Chem. 2001;276:1677-1680. [PubMed] [DOI] |
| 15. | Johnsen JI, Aurelio ON, Kwaja Z, Jörgensen GE, Pellegata NS, Plattner R, Stanbridge EJ, Cajot JF. p53-mediated negative regulation of stathmin/Op18 expression is associated with G(2)/M cell-cycle arrest. Int J Cancer. 2000;88:685-691. [PubMed] [DOI] |
| 16. | Polager S, Ginsberg D. E2F mediates sustained G2 arrest and down-regulation of Stathmin and AIM-1 expression in response to genotoxic stress. J Biol Chem. 2003;278:1443-1449. [PubMed] [DOI] |
| 17. | Baldassarre G, Belletti B, Nicoloso MS, Schiappacassi M, Vecchione A, Spessotto P, Morrione A, Canzonieri V, Colombatti A. p27(Kip1)-stathmin interaction influences sarcoma cell migration and invasion. Cancer Cell. 2005;7:51-63. [PubMed] [DOI] |
| 18. | Fang L, Min L, Lin Y, Ping G, Rui W, Ying Z, Xi W, Ting H, Li L, Ke D. Downregulation of stathmin expression is mediated directly by Egr1 and associated with p53 activity in lung cancer cell line A549. Cell Signal. 2010;22:166-173. [PubMed] [DOI] |
| 19. | Jiang L, Chen Y, Chan CY, Wang X, Lin L, He ML, Lin MC, Yew DT, Sung JJ, Li JC. Down-regulation of stathmin is required for TGF-beta inducible early gene 1 induced growth inhibition of pancreatic cancer cells. Cancer Lett. 2009;274:101-108. [PubMed] [DOI] |
| 20. | Yoshie M, Miyajima E, Kyo S, Tamura K. Stathmin, a microtubule regulatory protein, is associated with hypoxia-inducible factor-1alpha levels in human endometrial and endothelial cells. Endocrinology. 2009;150:2413-2418. [PubMed] [DOI] |
| 21. | Verma NK, Dourlat J, Davies AM, Long A, Liu WQ, Garbay C, Kelleher D, Volkov Y. STAT3-stathmin interactions control microtubule dynamics in migrating T-cells. J Biol Chem. 2009;284:12349-12362. [PubMed] [DOI] |
| 22. | Lin X, Liu S, Luo X, Ma X, Guo L, Li L, Li Z, Tao Y, Cao Y. EBV-encoded LMP1 regulates Op18/stathmin signaling pathway by cdc2 mediation in nasopharyngeal carcinoma cells. Int J Cancer. 2009;124:1020-1027. [PubMed] [DOI] |
| 23. | Mistry SJ, Bank A, Atweh GF. Synergistic antiangiogenic effects of stathmin inhibition and taxol exposure. Mol Cancer Res. 2007;5:773-782. [PubMed] [DOI] |
| 24. | Wang F, Wang LX, Wang RL, Fan QX, Zhao PR. [Construction and expression of human stathmin gene eukaryotic expression vector and its effect on esophageal cancer cells]. Zhonghua Zhongliu Zazhi. 2008;30:179-183. [PubMed] |
| 25. | Bièche I, Lachkar S, Becette V, Cifuentes-Diaz C, Sobel A, Lidereau R, Curmi PA. Overexpression of the stathmin gene in a subset of human breast cancer. Br J Cancer. 1998;78:701-709. [PubMed] [DOI] |
| 26. | Alli E, Bash-Babula J, Yang JM, Hait WN. Effect of stathmin on the sensitivity to antimicrotubule drugs in human breast cancer. Cancer Res. 2002;62:6864-6869. [PubMed] |
| 27. | Chen G, Wang H, Gharib TG, Huang CC, Thomas DG, Shedden KA, Kuick R, Taylor JM, Kardia SL, Misek DE. Overexpression of oncoprotein 18 correlates with poor differentiation in lung adenocarcinomas. Mol Cell Proteomics. 2003;2:107-116. [PubMed] [DOI] |
| 28. | Xi W, Rui W, Fang L, Ke D, Ping G, Hui-Zhong Z. Expression of stathmin/op18 as a significant prognostic factor for cervical carcinoma patients. J Cancer Res Clin Oncol. 2009;135:837-846. [PubMed] [DOI] |
| 29. | Su D, Smith SM, Preti M, Schwartz P, Rutherford TJ, Menato G, Danese S, Ma S, Yu H, Katsaros D. Stathmin and tubulin expression and survival of ovarian cancer patients receiving platinum treatment with and without paclitaxel. Cancer. 2009;115:2453-2463. [PubMed] [DOI] |
| 30. | Sadow PM, Rumilla KM, Erickson LA, Lloyd RV. Stathmin expression in pheochromocytomas, paragangliomas, and in other endocrine tumors. Endocr Pathol. 2008;19:97-103. [PubMed] [DOI] |
| 31. | Björklund P, Cupisti K, Fryknäs M, Isaksson A, Willenberg HS, Akerström G, Hellman P, Westin G. Stathmin as a marker for malignancy in pheochromocytomas. Exp Clin Endocrinol Diabetes. 2010;118:27-30. [PubMed] [DOI] |
| 32. | Zhang X, Cao H, Gao D. [The expression stathmin gene in laryngeal squamous cell carcinoma]. Lin Chung Erbi Yanhou Toujing Waike Zazhi. 2009;23:872-873, 877. [PubMed] |
| 33. | Kuo MF, Wang HS, Kuo QT, Shun CT, Hsu HC, Yang SH, Yuan RH. High expression of stathmin protein predicts a fulminant course in medulloblastoma. J Neurosurg Pediatr. 2009;4:74-80. [PubMed] [DOI] |
| 34. | Wang R, Dong K, Lin F, Wang X, Gao P, Wei SH, Cheng SY, Zhang HZ. Inhibiting proliferation and enhancing chemosensitivity to taxanes in osteosarcoma cells by RNA interference-mediated downregulation of stathmin expression. Mol Med. 2007;13:567-575. [PubMed] [DOI] |
| 35. | Iancu C, Mistry SJ, Arkin S, Atweh GF. Taxol and anti-stathmin therapy: a synergistic combination that targets the mitotic spindle. Cancer Res. 2000;60:3537-3541. [PubMed] |