修回日期: 2010-03-16
接受日期: 2010-03-23
在线出版日期: 2010-04-28
目的: 探讨大肠癌特异性标志物, 为大肠癌的早期诊断、预后判断和治疗提供帮助, 同时为理解大肠癌的发病机制提供线索.
方法: 收集6例大肠癌患者, 应用高灵敏的二维凝胶电泳和MALDI-TOF-MS技术检测出肿瘤黏膜和邻近正常结肠黏膜之间差异表达的蛋白. 对其中之一热休克蛋白27(HSP27)进行Western blot和免疫组织化学验证.
结果: 筛选出42个具有明显表达差异的蛋白质点, 质谱鉴定出10个差异表达蛋白, 包括HSP27、二硫异构酶、核不均一核糖核蛋白A2/B1、磷酸丙糖异构酶、丙酮酸激酶等. Western blot和免疫组织化学结果证实HSP27在大肠癌中有过度表达, 提示其可能为重要的肿瘤标志物.
结论: 大肠癌肿瘤组织与大肠正常黏膜之间存在差异表达蛋白, HSP27在大肠癌中有异常表达, 可能作为大肠癌发生、发展的候选生物标志物.
引文著录: 刘伟杰, 秦环龙, 马延磊, 彭佳远. 大肠癌潜在标志物-热休克蛋白27. 世界华人消化杂志 2010; 18(12): 1237-1243
Revised: March 16, 2010
Accepted: March 23, 2010
Published online: April 28, 2010
AIM: To find specific biomarkers for colorectal carcinoma using a proteomic method to provide clues to early diagnosis, prognosis and therapy of colorectal carcinoma as well as to understanding the molecular mechanisms governing cancer progression.
METHODS: Six colorectal carcinoma patients were included in the study. High-resolution two-dimensional gel electrophoresis (2-DE) and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS) were utilized for the identification of proteins differentially expressed between cancer and adjacent non-cancerous tissue. The differential expression of heat shock protein 27 (HSP27) was further verified by Western blot and immunohistochemistry.
RESULTS: Comparative analysis of 2-DE maps revealed 42 differentially expressed proteins between the two groups. Ten differential proteins were further identified by mass spectrometry, including HSP27, disulfide isomerase (DI), heterogeneous nuclear ribonucleoprotein A2/B1 (HnRNP A2/B1), triosephosphate isomerase (TIM), pyruvate kinase, etc. Western blot and immunohistochemistry analyses confirmed the overexpression of HSP27 in colorectal carcinoma. These results indicate that HSP27 may be a potential biomarker for colorectal cancer.
CONCLUSION: Many differential proteins are identified between cancer and adjacent non-cancerous tissue in patients with colorectal carcinoma. HSP27 might be a potential biomarker for early diagnosis, therapy and prognosis of colorectal carcinoma.
- Citation: Liu WJ, Qin HL, Ma YL, Peng JY. Heat shock protein 27: a potential biomarker for colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1237-1243
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1237
大肠癌(colorectal carcinoma, CRC)是第三大最常见的癌症类型, 全世界癌症引起死亡位居第4位. 全球每年有近100万大肠癌新发病例, 492 000人因该病而死亡[1]. 大肠癌患者累计生存风险达6%[2]. 最近的研究关注于肿瘤发生的遗传变化. 但是, 一些独立的研究已表明, 转录水平的研究存在明显缺点[3-5]. mRNA定量并不能精确反应蛋白水平的差异[6]. 因此, 直接比较正常组织与肿瘤间的差异蛋白质似乎更精确. 随着后基因组时代的到来, 蛋白质组学被认为是在整体蛋白表达分析中的一种重要技术并有助了解基因功能[7]. 蛋白质组学借助一种高通量的鉴定方式, 可研究由疾病过程中整体蛋白质的变化, 因为他能够同时分析成千上万的修饰或未修饰的蛋白质[8,9]. 所以蛋白质组学常应用于多种癌症的标志物检测[10-17]. 虽然已有蛋白质组学研究报道[18-20]结果略有差异, 原因可能是由于种族差异、不同程度的质谱分析能力, 或特定的蛋白质的技术问题. 二维凝胶电泳(2-dimension electrophoresis, 2-DE)仍然是许多研究蛋白质组学的首选技术[21]. 因为他简单, 可靠性高, 所包含信息量大以及便于掌握, 是最常用的方法. 在合适条件下, 数千种蛋白质可以溶解在单一的2-DE凝胶上, 便于大规模的研究差异表达分子[22]. 本研究目的是使用2-DE和MALDI-TOF/TOF质谱技术检测新的大肠癌相关分子.
选取在上海交通大学附属第六人民医院普外科进行手术的大肠癌患者(术前未经任何放、化疗, 无明显其他系统疾病者)6例, 对该组患者的大肠黏膜组织进行蛋白质组学研究. 于术中切除肿瘤标本后剪取肿瘤处黏膜组织和距肿瘤10 cm以上结肠黏膜组织(病理证实无肿瘤浸润转移)各约2 g作为肿瘤组(Ca组)和正常黏膜组(N组), 并立即转移至-70 ℃冰箱中保存.
1.2.1 蛋白提取和定量: 将患者的组织样品自超低温冰箱取出、化冻后, 各取1 g左右, 用生理盐水清洗干净后, 剪成1 mm×1 mm×1 mm小块, 加入500 µL lysis Buffer(9.5 mol/L Urea, 4% CHAPS, 65 mmol/L DTT, 0.2% carrier ampholyte(3-10NL), 罗氏cooktail酶抑制剂, 使用DOUNCE匀浆器进行匀浆, 然后超声破碎. 整个过程在冰浴进行. 离心14 000 r/min, 1 h, 收集上清. 使用Bio-Rad protein assay reagent定量, 采用Bradford法. 将每组内6个样品等量合并, 重新定量后分装成100 μg一管, 置于500 μL离心管中, -70 ℃低温保存.
1.2.2 双向电泳: 将等量合并后的样品各作三块凝胶, 每个样品上样100 μg. 第一向, 等电聚焦, EF为pH3-10非线性胶条, 电泳条件: 30 V 12 h, 500 V 1 h, 1 000 V 1 h, 8 000 V 8 h, 500 V 4 h; 第二向SDS-PAGE电泳, SDS-PAGE为12.5%的胶(15 mA/胶 30 min, 30 mA/胶至溴酚蓝离胶下沿0.5 cm).
1.2.3 染色: 银染, 水洗5 min, 400 mL/L乙醇、100 mL/L乙酸重复固定15 min, 重复2遍. 300 mL/L乙醇、0.2%硫代硫酸钠、6.8%乙酸钠30 min. 水洗5 min, 重复3遍. 2.5%碳酸钠, 0.04%的甲醛溶液, 显影至背景出现, 1.46% EDTA溶液停显10 min. 水洗3 min, 重复3遍.
1.2.4 扫描、凝胶图像分析及统计分析: 凝胶通过UMax Powerlook 2110XL扫描获得6张2-DE图谱(每组3张, 共2组, 分别为正常黏膜组、肿瘤组). 利用ImageMaster软件分析图谱, 将以上2组图谱作比较, 蛋白点按照他们的相对体积 (relative volume)进行定量分析, 据此来比较2组2-D图谱上相同位置蛋白点的表达强度的差异. 选取有至少1.5倍量变的蛋白斑点作为鉴定的差异候选蛋白. 统计方法: 计算每组中同一蛋白点在3张2-D图谱上相对体积(relative volume)的均值, 统计分析2组的均值, 2组间的比较采用t检验. 相对体积的计算按照如下方法: 每个点的体积/胶上所有点的体积. 为了验证重复性, 2-DE分别重复3次.
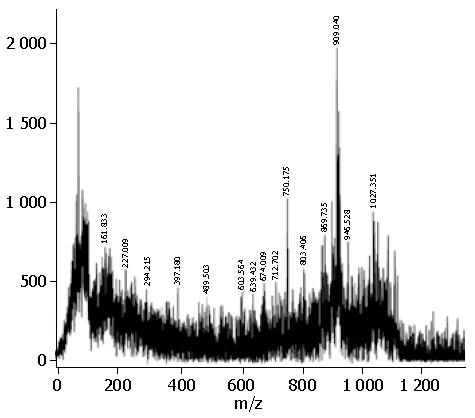
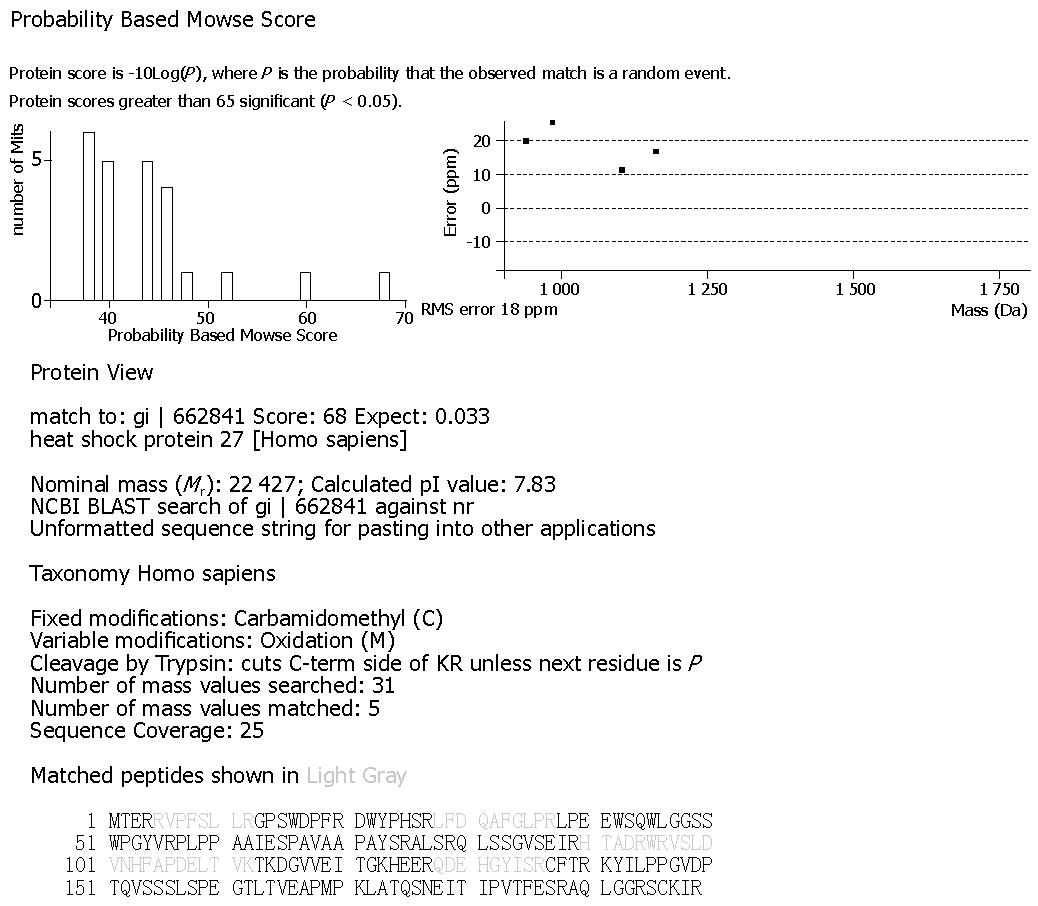
1.2.5 质谱及生物信息学分析: 选取图像分析得到的差异蛋白点, 切下差异点, 做胶内酶解, 通过MALDI-TOF分析, 获得蛋白点的相应肽质量指纹图谱, 将肽质量指纹数据通过因特网在蛋白质序列库中进行搜索, 搜索软件为Mascot, 数据库选择为NCBInr, 物种为人类(human), 以Mowse分值为基础的概率(P)评价数据库搜寻结果的质量, 分值大小表示鉴定蛋白属于随机匹配的可能性, >63表明具有显著性意义.
1.2.6 Western blot分析: 利用方法1.2.1所抽提定量的蛋白质(各6个), 每份抽提的蛋白提取10 μL, 加等体积的2×上样缓冲液(50 mmol/L Tris-HCl pH6.8, 2% SDS, 10%甘油, 0.1%溴酚蓝, 1 mol/L DTT), 沸水浴煮3 min点样于10%聚丙烯酰胺凝胶进行SDS-PAGE电泳, 20 mA稳流电泳3 h. SDS-PAGE电泳后, 剪取与凝胶大小一致的硝酸纤维素膜及6张Whatman 3 mm滤纸, 浸于转移缓冲液(48 mmol/L Tris-HCl pH8.3, 39 mmol/L甘氨酸, 0.037% SDS)中5 min, 进行转膜. 将硝纤膜取出置一平皿中, 加封闭液封闭后, 加入经稀释的一抗(兔抗人HSP27, 多抗, 1:1 000稀释, abCAM公司), 4 ℃反应过夜, TBST漂洗3次. 加入二抗(1:10 000稀释, Santa Cruz公司), 室温作用2 h. 取出膜后TBST充分漂洗, 加入ECL显色液, 置于柯达活体成像仪中观察结果, 条件设置为曝光5 min, CCD自动获取图片结果. 蛋白表达值为条带的灰度值以β-actin(1:1 000稀释, Santa Cruz公司43 kDa)内参照校正. 待测蛋白相对含量计算如下: 灰度值 = 条带面积×(条带灰度-背景灰度); 相对含量 = 待测蛋白灰度值/β-actin(内参)灰度值.
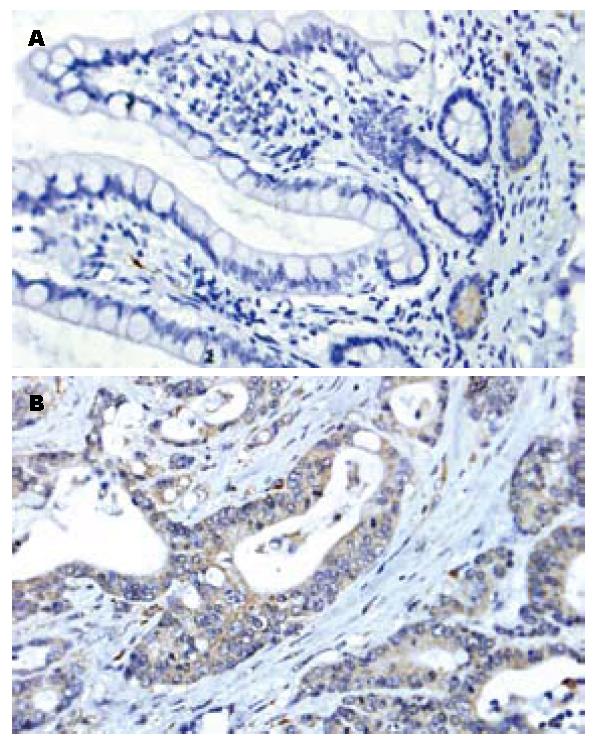
1.2.7 免疫组织化学分析: 4 µm石蜡切片贴在涂有切片黏合剂的载玻片上, 58 ℃烤24 h, 常规脱蜡. 1% H2O2作用20 min或3% H2O2作用5-10 min以消除内源性过氧化物酶的活性; 抗原修复或酶消化(将切片置于0.01 mol/L pH6.0 CB(柠檬酸缓冲液)中, 微波Ⅲ档(98 ℃), 10 min×2次, 自然冷却至室温; PBS洗3 min×3次, 1%二抗(1:400稀释)正常血清室温下封闭20 min. 然后加适当稀释一抗(兔抗人HSP27, 多抗, 1:50稀释, abCAM公司), 37 ℃ 1-2 h; PBS洗3 min×3次; 阴性对照组加入PBS代替一抗, EnVision试剂37 ℃, 10-15 min; PBS洗3 min×3次; 0.04% DAB+0.03% H2O2显色8 min左右, 镜下控制显色程度, 即时终止; 自来水洗3 min, 复染(苏木素衬染30 s, 水洗, 盐酸乙醇蓝化2 S, 水洗, 微波蓝化), 常规树脂封片; 结果, 阳性产物为棕黄色或棕褐色, 背景为蓝色.
统计学处理 统计学分析采用SPSS11.5版本软件.
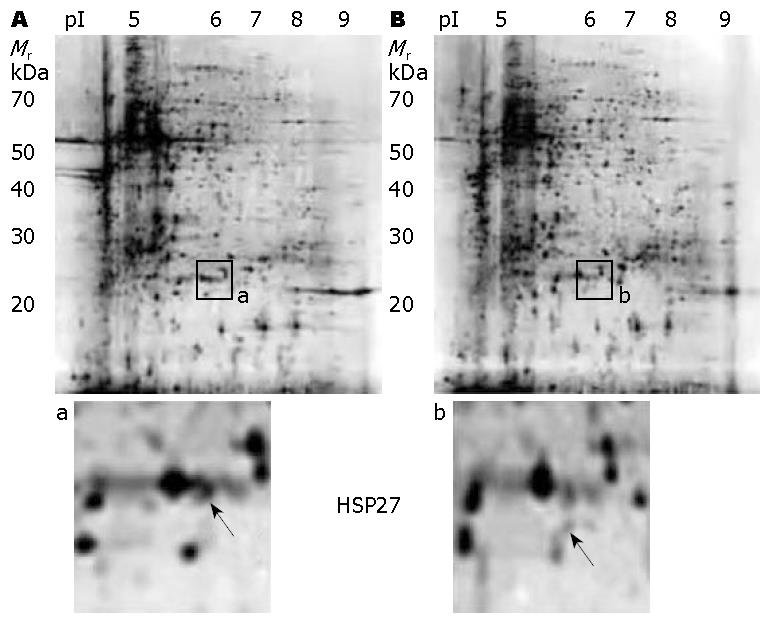
通过2-DE技术, 得到大肠癌蛋白质及邻近正常组织蛋白表达谱. 对肿瘤和相应正常组织的蛋白质谱进行比较, 检测出多种差异表达蛋白. 应用Computer-assisted Image Master软件(GE healthcare)对差异表达蛋白进行定量和定性分析, 蛋白表达强度差异在1.5倍以上者, 被认为差异蛋白, 做进一步质谱分析(图1).
筛选出42个具有明显表达差异的蛋白质点, 对其中表达差异最显著的13个点作MALDI-TOF质谱分析, 按照质谱分析所得的肽指纹图谱及相对分子量和等电点, 通过对比网上数据库共检测出10个蛋白, 包括HSP27、α-肌动蛋白(α-actin)、二硫异构酶(disulfide isomerase, DI)、平滑肌蛋白(smooth muscle protein)2个、核不均一核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoproteins A2/B1, HnRNP A2/B1)、磷酸丙糖异构酶(triosephosphate isomerase, TIM)、丙酮酸激酶(pyruvate kinase)、角蛋白9(Keratin 9)、角蛋白复合体1(Keratin mixture 1). 表1列举了上述10个蛋白的信息.
| 差异点号 | Mowse分值 | 相对分子质量(Da) | 蛋白名称 | 序列覆盖率(%) | pI |
| 706 | 78 | 57 043 | 二硫异构酶 | 16 | 6.10 |
| 1627 | 69 | 31 144 | 核不均一核糖核蛋白A2/B1 | 20 | 9.14 |
| 1741 | 72 | 42 480 | α-肌动蛋白 | 12 | 5.23 |
| 1777 | 83 | 58 441 | 丙酮酸激酶 | 23 | 7.58 |
| 1794 | 127 | 57 754 | 角蛋白复合体1 | 32 | 6.95 |
| 2139 | 188 | 62 255 | 角蛋白9 | 28 | 5.14 |
| 2282 | 68 | 22 826 | 热休克蛋白27 | 25 | 5.98 |
| 2300 | 66 | 22 518 | 平滑肌蛋白 | 9 | 8.56 |
| 2396 | 79 | 26 894 | 磷酸丙糖异构酶 | 10 | 7.10 |
| 2412 | 77 | 22 518 | 平滑肌蛋白 | 9 | 8.56 |
上述差异蛋白中, 有5种蛋白在过去的大肠癌蛋白组学研究未见报道, 他们是: HSP27、DI、HnRNP A2/B1、TIM、丙酮酸激酶, 而HSP27差异最为显著, 在癌组织中的表达量是正常组织中的2.93倍. 图2、图3为HSP27的质谱检测结果, 其在肿瘤中的表达水平较正常组织中显著升高.
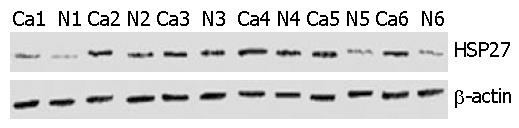
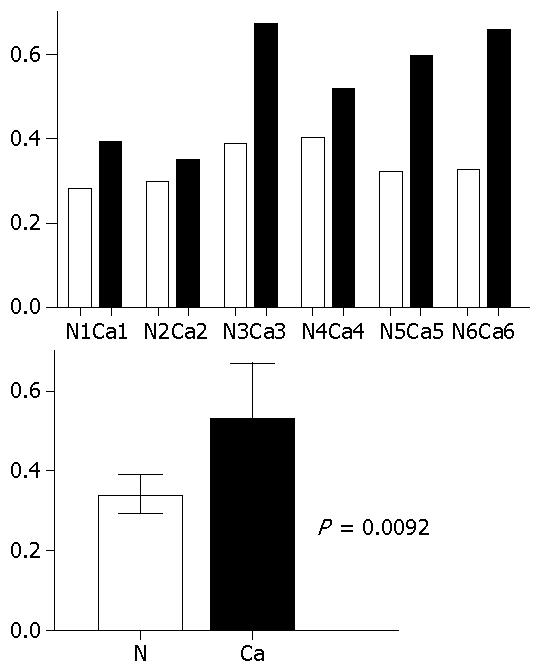
Western blot验证结果显示, 大肠癌组织中, HSP27明显升高, 癌组织为0.5345±0.1364, 正常组织为0.3403±0.0482(P = 0.0092, 图4, 图5). 这结果与2-DE结果相符. 同时, 免疫组织化学证实, 大肠癌细胞质及细胞核中可见HSP27的强染色, 周围间质中却很少见相似的染色(图6), 这也从另一方面证实了蛋白组学的研究结果.
大肠癌是消化系统常见的肿瘤, 其发病率和死亡率无论在发达国家还是在发展中国家都呈上升趋势, 而大肠癌的早期诊断及复发的早期检测是其有效治疗的关键. 由于细胞的功能分子是蛋白质, 所以蛋白分析较cDNA芯片更具临床价值[30]. 对于肿瘤和正常组织, 比较蛋白组学能检测出候选差异蛋白分子, 有助于肿瘤的诊断、治疗等. 本研究的目的旨在找寻这些分子, 为未来大肠癌的发病机制、诊断及治疗奠定基础. 本研究中, 通过蛋白组学技术, 我们建立了大肠癌及临近正常组织之间的差异表达蛋白谱, 并且检测出了10个候选分子、大多数分子参与细胞的生物学过程, 包括细胞增殖、转化、凋亡、代谢、蛋白折叠, 构建细胞骨架等功能. 其中的5个蛋白包括: HSP27、DI、HnRNP A2/B1、TIM、丙酮酸激酶在其他器官的恶性肿瘤中有报道, 但在大肠癌中的表达未见报道. 由于研究表明HSP27可能与大肠癌基因突变相关[23-29], 所以随后的研究更多关注于HSP27.
HSP27属于热休克蛋白, 相对分子质量27 kDa, 依据不同的磷酸化状态, 其在细胞内存在不同的聚合体状态, 如单聚体、两聚体或多聚体, 磷酸化则发生于丝裂原赖的蛋白激酶/p38途径. HSP27在细胞生物学过程中参与细胞信号转导, 从而影响细胞的分化、凋亡等. HSP27在大肠癌的致癌过程中所起的作用仍然不清, 但其表达水平在包括神经母细胞瘤[24], 肝癌[25], 食管腺癌[26]和胃癌[29]中增加. 作为不依赖ATP的分子伴侣, HSP27通过抑制应激诱导及死亡受体诱导的细胞凋亡途径而实现抗细胞凋亡作用[31]. 热休克蛋白是一种多功能的细胞凋亡调节因子, 在凋亡途径的多个节点进行调节[32]. HSP27的表达水平增加可能引起肿瘤的抗宿主防御机制, 提高肿瘤细胞转移潜力. 这也支持Parcellier等的研究[33], 他们的结果提示HSP27能够促进磷酸化IκBa水解和增强NF-κB的活性, 这可能说明其具有抗凋亡的特性. 因此, HSP27具有致肿瘤作用也不足为奇.
高通量蛋白组学技术的出现, 将检测出更多的新的分子生物标志物或蛋白质生物标志物, 使恶性肿瘤的早期诊断更可靠, 并预测其进展[34]. 在本研究中, 通过比较蛋白组学来寻找大肠癌及相对正常大肠黏膜之间的差异表达蛋白, 取得了一定的结果. 肿瘤标志物(tumor biomarker)是在肿瘤细胞或其周围组织中一系列基因表达改变的结果, 例如病毒基因的插入、DNA甲基化、染色体移位等导致细胞内分子水平的改变, 从而产生肿瘤标志物. 肿瘤标志物检测已成为继影像诊断和病理诊断之后临床最常用的肿瘤诊断方法之一. 理想肿瘤标志物应具有较强的肿瘤特异性, 并可检测出最小的病灶, 能定量反映肿瘤负荷. 免疫印迹分析进一步证实HSP27的双向电泳结果, 显示其在大肠癌组织中显著高于正常大肠组织. 同时, 免疫组织化学证实HSP27的细胞定位主要位于肿瘤细胞的细胞质和细胞核内, 并不表达于周围间质. 以上研究结果表明, 蛋白质组学研究结果可靠, 并认为HSP27可能参与大肠癌癌变过程, 为大肠癌的一种潜在标志物.
通过差异蛋白质组学研究, 我们检测出HSP27为大肠癌变过程的一个标志分子. 通过HSP27及其他相关分子的深入研究, 将会为解释"大肠腺瘤及腺癌序列"提供依据, 为大肠癌早期诊断, 判断预后、协助治疗提供依据. 未来的研究涉及通过干扰RNA技术阻断其表达, 来观察细胞株的变化. 同时需要进一步研究来阐明HSP27在肿瘤的发生中的具体作用, 并确认他是否是针对肿瘤应激的快速反应分子, 或是大肠癌进展的生物学标志物.
大肠癌是最常见的癌症类型之一, 其肿瘤标志物为研究热点, 蛋白质组学被认为是在整体蛋白表达分析中的一种重要技术并有助了解基因功能.
王正康, 教授, 北京中日友好医院普外科
HSP27在大肠癌的致癌过程中所起的作用仍然不清, 但其表达水平在包括神经母细胞瘤, 肝癌, 食管腺癌和胃癌中增加.
肿瘤差异蛋白组已经成为研究肿瘤潜在标志物的重要手段之一, 其能够一次性筛选出多种蛋白以供研究. 目前, 部分研究已经通过肿瘤差异蛋白组方法, 检测出了多种与恶性肿瘤发病、进展及转移相关的差异蛋白.
本研究利用高通量的蛋白质组学技术, 结合Western blot与免疫组织化学, 筛选出了HSP27作为候选标志物.
本研究结果提示HSP27为大肠癌的一种潜在标志蛋白, 为深入了解大肠癌的发病机制及抗凋亡能力提供有价值的信息.
本研究方法有一定先进性, 提供了一定有参考价值的信息, 但仍需进一步研究.
编辑: 李军亮 电编: 何基才
| 1. | Weitz J, Koch M, Debus J, Höhler T, Galle PR, Büchler MW. Colorectal cancer. Lancet. 2005;365:153-165. [PubMed] [DOI] |
| 2. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 3. | Anderson L, Seilhamer J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 1997;18:533-537. [PubMed] [DOI] |
| 4. | Cole AR, Ji H, Simpson RJ. Proteomic analysis of colonic crypts from normal, multiple intestinal neoplasia and p53-null mice: a comparison with colonic polyps. Electrophoresis. 2000;21:1772-1781. [PubMed] [DOI] |
| 5. | Gordon JI, Smith DP, Alpers DH, Strauss AW. Cloning of a complementary deoxyribonucleic acid encoding a portion of rat intestinal preapolipoprotein AIV messenger ribonucleic acid. Biochemistry. 1982;21:5424-5431. [PubMed] [DOI] |
| 6. | Mazzanti R, Solazzo M, Fantappié O, Elfering S, Pantaleo P, Bechi P, Cianchi F, Ettl A, Giulivi C. Differential expression proteomics of human colon cancer. Am J Physiol Gastrointest Liver Physiol. 2006;290:G1329-G1338. [PubMed] [DOI] |
| 7. | Li C, Tan YX, Zhou H, Ding SJ, Li SJ, Ma DJ, Man XB, Hong Y, Zhang L, Li L. Proteomic analysis of hepatitis B virus-associated hepatocellular carcinoma: Identification of potential tumor markers. Proteomics. 2005;5:1125-1139. [PubMed] [DOI] |
| 8. | Petricoin EF, Zoon KC, Kohn EC, Barrett JC, Liotta LA. Clinical proteomics: translating benchside promise into bedside reality. Nat Rev Drug Discov. 2002;1:683-695. [PubMed] [DOI] |
| 9. | Li Z, Zhao X, Bai S, Wang Z, Chen L, Wei Y, Huang C. Proteomics identification of cyclophilin a as a potential prognostic factor and therapeutic target in endometrial carcinoma. Mol Cell Proteomics. 2008;7:1810-1823. [PubMed] [DOI] |
| 10. | Herrmann PC, Liotta LA, Petricoin EF. Cancer proteomics: the state of the art. Dis Markers. 2001;17:49-57. [PubMed] [DOI] |
| 11. | Byrne JC, Downes MR, O'Donoghue N, O'Keane C, O'Neill A, Fan Y, Fitzpatrick JM, Dunn M, Watson RW. 2D-DIGE as a strategy to identify serum markers for the progression of prostate cancer. J Proteome Res. 2009;8:942-957. [PubMed] [DOI] |
| 12. | Park HJ, Kim BG, Lee SJ, Heo SH, Kim JY, Kwon TH, Lee EB, Ryoo HM, Cho JY. Proteomic profiling of endothelial cells in human lung cancer. J Proteome Res. 2008;7:1138-1150. [PubMed] [DOI] |
| 13. | Dowling P, O'Driscoll L, Meleady P, Henry M, Roy S, Ballot J, Moriarty M, Crown J, Clynes M. 2-D difference gel electrophoresis of the lung squamous cell carcinoma versus normal sera demonstrates consistent alterations in the levels of ten specific proteins. Electrophoresis. 2007;28:4302-4310. [PubMed] [DOI] |
| 14. | Sun W, Xing B, Sun Y, Du X, Lu M, Hao C, Lu Z, Mi W, Wu S, Wei H. Proteome analysis of hepatocellular carcinoma by two-dimensional difference gel electrophoresis: novel protein markers in hepatocellular carcinoma tissues. Mol Cell Proteomics. 2007;6:1798-1808. [PubMed] [DOI] |
| 15. | Huang HL, Stasyk T, Morandell S, Dieplinger H, Falkensammer G, Griesmacher A, Mogg M, Schreiber M, Feuerstein I, Huck CW. Biomarker discovery in breast cancer serum using 2-D differential gel electrophoresis/ MALDI-TOF/TOF and data validation by routine clinical assays. Electrophoresis. 2006;27:1641-1650. [PubMed] [DOI] |
| 16. | Qi YJ, He QY, Ma YF, Du YW, Liu GC, Li YJ, Tsao GS, Ngai SM, Chiu JF. Proteomic identification of malignant transformation-related proteins in esophageal squamous cell carcinoma. J Cell Biochem. 2008;104:1625-1635. [PubMed] [DOI] |
| 17. | Yoo C, Zhao J, Pal M, Hersberger K, Huber CG, Simeone DM, Beer DG, Lubman DM. Automated integration of monolith-based protein separation with on-plate digestion for mass spectrometric analysis of esophageal adenocarcinoma human epithelial samples. Electrophoresis. 2006;27:3643-3651. [PubMed] [DOI] |
| 18. | Roessler M, Rollinger W, Mantovani-Endl L, Hagmann ML, Palme S, Berndt P, Engel AM, Pfeffer M, Karl J, Bodenmüller H. Identification of PSME3 as a novel serum tumor marker for colorectal cancer by combining two-dimensional polyacrylamide gel electrophoresis with a strictly mass spectrometry-based approach for data analysis. Mol Cell Proteomics. 2006;5:2092-2101. [PubMed] [DOI] |
| 19. | Alfonso P, Núñez A, Madoz-Gurpide J, Lombardia L, Sánchez L, Casal JI. Proteomic expression analysis of colorectal cancer by two-dimensional differential gel electrophoresis. Proteomics. 2005;5:2602-2611. [PubMed] [DOI] |
| 20. | Olesen SH, Christensen LL, Sørensen FB, Cabezón T, Laurberg S, Orntoft TF, Birkenkamp-Demtröder K. Human FK506 binding protein 65 is associated with colorectal cancer. Mol Cell Proteomics. 2005;4:534-544. [PubMed] [DOI] |
| 21. | Rabilloud T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2002;2:3-10. [PubMed] [DOI] |
| 22. | Friedman DB, Hill S, Keller JW, Merchant NB, Levy SE, Coffey RJ, Caprioli RM. Proteome analysis of human colon cancer by two-dimensional difference gel electrophoresis and mass spectrometry. Proteomics. 2004;4:793-811. [PubMed] [DOI] |
| 23. | Xiao G, Lu Q, Li C, Wang W, Chen Y, Xiao Z. Comparative proteome analysis of human adenocarcinoma. Med Oncol. 2010;27:346-356. [PubMed] |
| 24. | Pei H, Zhu H, Zeng S, Li Y, Yang H, Shen L, Chen J, Zeng L, Fan J, Li X. Proteome analysis and tissue microarray for profiling protein markers associated with lymph node metastasis in colorectal cancer. J Proteome Res. 2007;6:2495-2501. [PubMed] [DOI] |
| 25. | Zanini C, Pulerà F, Carta F, Giribaldi G, Mandili G, Maule MM, Forni M, Turrini F. Proteomic identification of heat shock protein 27 as a differentiation and prognostic marker in neuroblastoma but not in Ewing's sarcoma. Virchows Arch. 2008;452:157-167. [PubMed] [DOI] |
| 26. | Luk JM, Lam CT, Siu AF, Lam BY, Ng IO, Hu MY, Che CM, Fan ST. Proteomic profiling of hepatocellular carcinoma in Chinese cohort reveals heat-shock proteins (Hsp27, Hsp70, GRP78) up-regulation and their associated prognostic values. Proteomics. 2006;6:1049-1057. [PubMed] [DOI] |
| 27. | Langer R, Ott K, Specht K, Becker K, Lordick F, Burian M, Herrmann K, Schrattenholz A, Cahill MA, Schwaiger M. Protein expression profiling in esophageal adenocarcinoma patients indicates association of heat-shock protein 27 expression and chemotherapy response. Clin Cancer Res. 2008;14:8279-8287. [PubMed] [DOI] |
| 28. | Guo K, Kang NX, Li Y, Sun L, Gan L, Cui FJ, Gao MD, Liu KY. Regulation of HSP27 on NF-kappaB pathway activation may be involved in metastatic hepatocellular carcinoma cells apoptosis. BMC Cancer. 2009;9:100. [PubMed] [DOI] |
| 29. | Doshi BM, Hightower LE, Lee J. The role of Hsp27 and actin in the regulation of movement in human cancer cells responding to heat shock. Cell Stress Chaperones. 2009;14:445-457. [PubMed] [DOI] |
| 30. | Giaginis C, Daskalopoulou SS, Vgenopoulou S, Sfiniadakis I, Kouraklis G, Theocharis SE. Heat Shock Protein-27, -60 and -90 expression in gastric cancer: association with clinicopathological variables and patient survival. BMC Gastroenterol. 2009;9:14. [PubMed] [DOI] |
| 31. | Mosser DD, Morimoto RI. Molecular chaperones and the stress of oncogenesis. Oncogene. 2004;23:2907-2918. [PubMed] [DOI] |
| 32. | Concannon CG, Gorman AM, Samali A. On the role of Hsp27 in regulating apoptosis. Apoptosis. 2003;8:61-70. [PubMed] [DOI] |
| 33. | Parcellier A, Schmitt E, Gurbuxani S, Seigneurin-Berny D, Pance A, Chantôme A, Plenchette S, Khochbin S, Solary E, Garrido C. HSP27 is a ubiquitin-binding protein involved in I-kappaBalpha proteasomal degradation. Mol Cell Biol. 2003;23:5790-5802. [PubMed] [DOI] |
| 34. | Melle C, Bogumil R, Ernst G, Schimmel B, Bleul A, von Eggeling F. Detection and identification of heat shock protein 10 as a biomarker in colorectal cancer by protein profiling. Proteomics. 2006;6:2600-2608. [PubMed] [DOI] |