修回日期: 2010-04-01
接受日期: 2010-04-07
在线出版日期: 2010-04-28
目的: 探讨Wnt-5a基因在胃癌发生发展过程中的表达及意义.
方法: 采用实时定量RT-PCR方法对10例胃癌和癌旁组织Wnt-5a mRNA进行检测; 免疫组织化学SP法检测84例胃癌、癌旁组织及20例正常胃黏膜Wnt-5a和β-catenin蛋白的表达.
结果: 胃癌和癌旁组织中Wnt-5a mRNA表达的相对含量分别为5.919±1.869和1.281±0.744(P<0.05); Wnt-5a蛋白在胃癌和癌旁组织的表达阳性率分别为40.54%(34/84)和14.29%(12/84), 差异具有统计学意义(P<0.01), 肿瘤中Wnt-5a上调表达相关于高的TNM分期和淋巴结转移(P<0.01). β-catenin在胃癌及癌旁组织中异常表达率分别为70.23%(59/84)、38.1%(32/84), 两者差异表达具有统计学意义(P<0.01), 癌组织中β-catenin的异常表达相关于肿瘤的TNM分期和淋巴结转移(P<0.05). 胃癌中Wnt-5a和β-catenin蛋白表达呈负相关关系(P<0.05).
结论: Wnt-5a在胃癌中可能发挥癌基因样作用, 其异常活化可能部分参与了胃癌发生的始动过程, 并可能相关于肿瘤差的预后. Wnt-5a与β-catenin在胃癌发生过程可能经由不同的信号途径在胃癌进展中发挥作用.
引文著录: 刘晓红, 曹智新, 耿明, 曹永成, 王义, 辛萱, 王翠翠, 毕利泉. Wnt-5a基因在胃癌中的表达及意义. 世界华人消化杂志 2010; 18(12): 1222-1226
Revised: April 1, 2010
Accepted: April 7, 2010
Published online: April 28, 2010
AIM: To detect Wnt-5a expression in gastric carcinoma (GC) and explore its role in the development and progression of GC.
METHODS: The expression of Wnt-5a mRNA in 10 fresh GC and matched tumor-adjacent tissue samples was detected by real-time reverse transcription-polymerase chain reaction (RT-PCR). The expression of Wnt-5a and β-catenin proteins in 84 GC and matched tumor-adjacent tissue samples as well as 20 normal gastric mucosa tissue samples was examined by immunohistochemistry using the streptavidin-peroxidase method.
RESULTS: Real time RT-PCR analysis showed that the relative level of Wnt-5a mRNA was significantly higher in GC than in tumor-adjacent tissue (5.919 ± 1.869 vs 1.281 ± 0.744, P < 0.05). The positive rate of Wnt-5a protein expression was also significantly higher in GC than in tumor-adjacent tissue (40.54% vs 14.29%, P < 0.05). Wnt-5a expression was significantly associated with advanced TNM stage and lymph node metastasis (both P < 0.01). The rate of aberrant β-catenin expression was significantly higher in GC than in tumor-adjacent tissue (70.23% vs 38.10%, P < 0.01). Aberrant β-catenin expression was associated with advanced tumor stage and lymph node metastasis (both P < 0.05). The expression of Wnt-5a was correlated with that of β-catenin (P < 0.01).
CONCLUSION: Wnt-5a may exert oncogenic functions in GC. Wnt-5a may be activated in the early stage of gastric tumorigenesis and be related to the poor prognosis of GC. Wnt-5a and β-catenin might play an important role in the development of GC via different signal pathways.
- Citation: Liu XH, Cao ZX, Geng M, Cao YC, Wang Y, Xin X, Wang CC, Bi LQ. Significance of Wnt-5a expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1222-1226
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1222.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1222
胃癌是我国常见的恶性肿瘤之一, 其发病率和死亡率居各类肿瘤之首. Wnt途径是一种对控制胚胎发育起重要作用的信号传导通路, 其不恰当地活化参与人类多种肿瘤的发生. 两者间的相关性研究是当今的热点领域[1]. 本研究采用实时定量RT-PCR及免疫组织化学方法检测胃癌中Wnt-5a基因的表达, 初步探讨Wnt-5a在胃癌发生发展过程中的作用及意义.
收集中国人民解放军济南军区总医院2008-08-12手术切除的胃癌新鲜标本及正常切缘(距肿瘤边缘≥5 cm)10例, -70 ℃低温冰箱保存. 同时收集2008-02-12胃癌石蜡样本及癌旁组织(距肿瘤边缘0.5-1 cm)84例, 20例镜下观察为正常胃黏膜的手术切缘(距肿瘤边缘≥5 cm)作为正常对照. 其中男72例, 女12例, 平均年龄61.8岁±10.2岁; 根据2006年WHO关于胃癌组织病理学分型, 管状腺癌48例, 乳头状腺癌13例, 黏液腺癌7例, 印戒细胞癌16例.
1.2.1 实时定量RT-PCR: (1)总RNA提取: 采用TRIzol总RNA提取液(美国Invitrogen公司), 取50 mg组织提取总RNA, 具体步骤按操作说明. 取样本提取的总RNA, 用紫外吸收测定法和变性琼脂糖凝胶电泳测定其浓度和纯度. (2)cDNA的合成: 以mRNA为模板, 采用Promega公司ImProm-ⅡTM Reverse Transcription System试剂盒进行反转录合成cDNA, 用于以下的PCR扩增模板. (3)扩增Wnt-5a基因: Wnt-5a的引物序列为5'-accacatgcagtacatcggag-3'和5'-gaggtgttatccacagtgctg-3'(上海博彩生物科技有限公司合成), GAPDH的引物序列为5'-ggacctgacctgccgtctag-3'和5'-tagcccaggatgcccttgag-3'. PCR反应条件为94 ℃, 5 min; 45个PCR循环(94 ℃, 15 s; 60 ℃, 5 s; 72 ℃, 15 s; 81 ℃收集荧光5 s). 为了建立PCR产物的熔解曲线, 扩增反应结束后继续从72 ℃缓慢加热到99 ℃(每5 s升高1 ℃). 其中Wnt-5a基因的扩增片段为106 bp, GAPDH基因的扩增片段为203 bp.
1.2.2 免疫组织化学: Wnt-5a, 兔抗人多克隆抗体(Lifespan公司, LS-C47384); β-catenin及SP-9000免疫组织化学检测试剂盒均购自北京中杉金桥生物有限公司. 标本经100 g/L甲醛固定, 常规石蜡包埋, 切片厚4 μm, 脱蜡水化, 乙二胺四乙酸缓冲液微波加热抗原修复, SP法免疫组织化学染色, 二氨联苯胺显色, 苏木精对比染色, 脱水透明, 中性树胶封固. PBS做空白对照.
1.2.3 结果判定: 各样品的目的基因和管家基因分别进行实时定量RT-PCR反应, Ct值直接由机器生成. 目的基因扩增产物的相对含量用2-ΔΔCt计算. Wnt-5a在细胞质出现棕黄色颗粒为阳性; 对样本进行阳性细胞百分比和染色强度综合评分, 10个随机高倍视野阳性细胞平均百分数<1%为0分, 1%-10%为1分, 11%-50%为2分, >50%为3分; 染色强度计分: 未着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 两者之积0为阴性表达, 1-4分为弱-中表达, >4分为高表达. β-catenin蛋白阳性信号主要定位于正常细胞的胞膜, 呈完整清晰的棕黄色线性表达, 胞质和胞核染色多为阴性, 其异常表达为: 细胞膜染色强度减弱或表达中断/消失、胞质和(或)胞核被染成棕黄色[2].
统计学处理 应用SPSS16.0统计软件, mRNA相对含量的计量资料以mean±SD表示, 采用t检验; 蛋白阳性率的比较采用χ2检验.
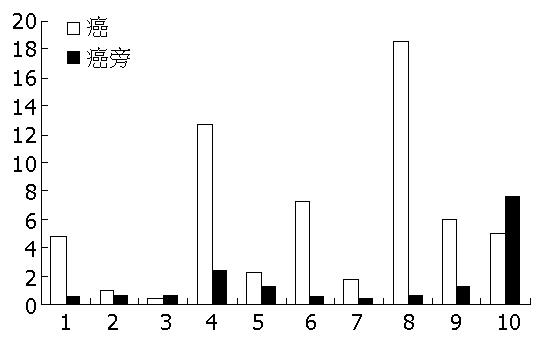
抽提各组织总RNA的A260/A280的比值为1.8-2.1, 变性琼脂糖凝胶电泳显示清晰的28S和18S条带, 前后者亮度比值≥2, 证实提取的总RNA具有良好的完整性和均一性. Wnt-5a PCR扩增产物为单一特异性扩增条带, 约106 bp大小, 与预期大小一致. 实时定量RT-PCR仪检测显示, 各样本CT值呈正态分布, 本实验计算所得的10对扩增效率曲线呈线性关系(r = 1.00). 胃癌和癌旁组织中的Wnt-5a基因相对含量分别为5.919±1.869和1.281±0.744, 差异具有统计学意义(t = 2.033, P = 0.038), 对比癌旁组织, 6例出现明显上调表达(上调大于2倍, 图1).
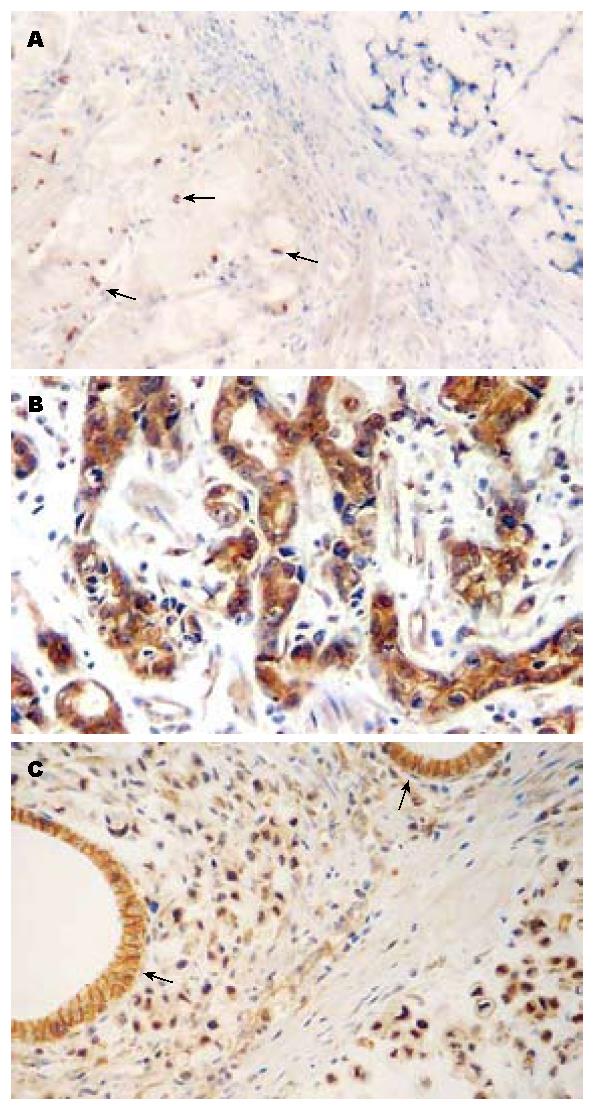
2.2.1 Wnt-5a的表达与胃癌临床病理因素之间的关系: Wnt-5a蛋白在正常胃小凹表层及贲门腺、幽门腺呈阴性表达, 阳性信号定位于肿瘤细胞的胞质. 正常胃底、体腺固有层底部的个别腺体细胞出现Wnt-5a阳性(图2A), 有研究显示其可能为主细胞[3]. Wnt-5a在胃癌(图2B)和癌旁组织中的阳性表达率分别为40.54%(34/84)和14.29%(12/84), 差异具有统计学意义(P<0.01). Wnt-5a在7例黏液腺癌中均为阴性表达(图2A), 与管状腺癌、乳头状腺癌及印戒细胞癌比较, 差异具有统计学意义(P<0.05); 胃癌组织中Wnt-5a高表达与临床病理参数的分析见表1. 10例胃癌组织中Wnt-5a的mRNA和蛋白表达间具有一致性(P<0.01).
2.2.2 β-catenin结果与胃癌临床病理因素之间的关系: β-catenin在正常胃黏膜上皮呈细胞膜线性表达(图2C), 而其出现异常的细胞质或核的表达在胃癌和癌旁组织分别为70.23%(59/84)和38.1%(32/84), 差异具有统计学意义(P<0.01), 癌组织中β-catenin的核阳性率为19.0%(16/84). 不同于Wnt-5a, 6/7例黏液腺癌组织β-catenin阳性表达, 其中1例伴有核阳性表达(图2C). 肿瘤中该蛋白的异常表达相关于TNM分期和淋巴结转移(P<0.05), 但与肿瘤分化程度及类型无关(P>0.05). 肿瘤中Wnt-5a和β-catenin免疫组织化学表达上呈负相关关系(r = -0.367, P<0.05), 尤其体现在黏液腺癌.
Wnt途径的组成框架和活化机制已有相对完整的解释, 人们认识到Wnt途径并不是以前设想的线性通路, 而是一条多环节、多作用位点的开放式途径, 该途径中多种蛋白的作用机制远未明确, 比如Wnt-5a, 对其研究尚处于起步阶段[1,3-8]. 本文对胃癌组织中Wnt-5a基因转录和翻译水平的变化进行检测和分析. 目前相关研究鲜见报道.
本研究实时定量RT-PCR检测结果显示, 胃癌组织中Wnt-5a基因的mRNA水平显著高于癌旁组织(P = 0.038), 提示胃癌中该基因在转录水平上调表达. 本研究结果相似于对人体其他部位原发肿瘤中Wnt-5a基因mRNA检测的报道, 如对比于正常或癌旁组织, 良性和浸润性乳腺肿瘤、甲状腺癌、肺癌、前列腺癌和胃癌等Wnt-5a基因mRNA均呈上调表达, 但也有相反的报道, 如在子宫内膜癌中, Wnt-5a基因mRNA呈下调表达[9-15].
本研究在mRNA水平证实了胃癌中Wnt-5a的高表达, 免疫组织化学染色结果呈现了一致的变化, 胃癌组织中Wnt-5a蛋白明显上调表达, 并相关于淋巴结转移及高的肿瘤TNM分期, 同时癌旁组织也显示一定程度的蛋白高表达. 上述研究结果提示, 胃癌中Wnt-5a基因在转录水平即发生了异常变化, 并进一步导致翻译水平蛋白的高表达, 显示了Wnt-5a蛋白从正常胃黏膜→癌旁组织→胃癌的递增表达趋势, 提示胃癌发生的早期已有Wnt-5a信号通道活化, 表明其可能参与胃癌发生的始动过程. 我们推测Wnt-5a在胃癌的发生发展过程中起到了癌基因样作用, 并相关于胃癌转移和差的预后. 相似的结果亦见于对一些恶性肿瘤的研究[12,14,16-18], Huang等[12]研究发现Wnt-5a的过表达可导致肺非小细胞肺癌的侵袭性增加, COX回归分析显示Wnt-5a的表达与该肿瘤差的预后相关. McDonald等[14]对包含痣、恶黑和转移性恶黑组织的免疫组织化学检测显示, Wnt-5a蛋白表达增加直接相关于高的肿瘤分级, 但负相关于患者的生存. 对不同肿瘤的研究显示Wnt-5a蛋白具有截然相反的作用[10,11,19-22], 如Kremenevskaja等[10]对甲状腺癌和Jönsson等[11]对乳腺癌进行的相关研究, 后者的研究表明, Wnt-5a表达丢失可能是一个独立于淋巴结状态和肿瘤大小的, 有用的预测复发的标志物, Wnt-5a的丢失增加乳腺浸润性导管癌的早期复发和死亡的风险, 他们提出, Wnt-5a蛋白在乳腺发挥肿瘤抑制作用. 目前认为不同肿瘤中Wnt-5a的作用机制可能存在差异[23-30].
β-catenin是wnt信号途径中的重要效应分子, 也是一种研究较为成熟的原癌基因[31-35], 本研究免疫组织化学染色结果证实其在胃癌呈明显的异常表达, 包括从细胞膜至细胞质及细胞核的异位表达, 后者常相关于β-catenin外显子3的突变. 我们的结果支持β-catenin作为原癌基因的异位表达导致经典Wnt信号活化参与肿瘤发生的理论[31-35]. 有意思的是, 本实验数据显示, Wnt-5a与β-catenin在胃癌组织中不同时相的表达, 即Wnt-5a阳性表达的肿瘤β-catenin多未出现异常表达, 而Wnt-5a阴性表达的肿瘤β-catenin却有较高的异常表达率, 这一点在黏液腺癌尤为显著. 推测这两种分子在胃癌发生过程中存在相互竞争或排斥表达现象, 可能涉及了经典与非经典两种不同Wnt信号通路的活化. Wnt-5a在本组黏液腺癌病例中完全阴性的表达提示该肿瘤的发生更可能涉及Wnt经典信号途径的活化.
本文从转录和翻译水平对胃癌和癌旁组织中Wnt-5a的表达进行报道, 研究显示, Wnt-5a高表达是胃癌发生及演进过程中的频发事件, 并与胃癌的临床分期及淋巴结转移相关, 推测Wnt-5a在胃癌的发生中可能起癌基因样作用, 其异常活化可能部分参与了胃癌发生的始动过程, 该蛋白可能成为判断胃癌有用的预后不良指标. 但目前胃癌组织Wnt-5a上调表达的机制及其与肿瘤发生发展间的关系还远未清楚, 其在胃癌的预防和治疗方面的价值还有待更深入的研究.
Wnt途径的组成框架和活化机制已有相对完整的解释, 人们认识到Wnt途径并不是以前设想的线性通路, 而是一条多环节、多作用位点的开放式途径, 该途径中多种蛋白的作用机制远未明确, 比如Wnt-5a, 对其研究尚处于起步阶段. 本文对胃癌组织中Wnt-5a基因转录和翻译水平的变化进行检测和分析. 目前相关研究鲜见报道.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
Wnt途径是一种对控制胚胎发育起重要作用的信号传导通路, 其不恰当地活化参与人类多种肿瘤的发生. 两者间的相关性研究是当今的热点领域.
Huang等研究发现Wnt-5a的过表达可导致肺非小细胞肺癌的侵袭性增加, COX回归分析显示Wnt-5a的表达与该肿瘤差的预后相关.
本研究选题、设计尚可, 具有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Logan CY, Nusse R. The Wnt signaling pathway in development and disease. Annu Rev Cell Dev Biol. 2004;20:781-810. [PubMed] [DOI] |
| 2. | Bachmann IM, Straume O, Puntervoll HE, Kalvenes MB, Akslen LA. Importance of P-cadherin, beta-catenin, and Wnt5a/frizzled for progression of melanocytic tumors and prognosis in cutaneous melanoma. Clin Cancer Res. 2005;11:8606-8614. [PubMed] [DOI] |
| 3. | Thompson MD, Monga SP. WNT/beta-catenin signaling in liver health and disease. Hepatology. 2007;45:1298-1305. [PubMed] [DOI] |
| 4. | Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature. 2005;434:843-850. [PubMed] [DOI] |
| 5. | Katoh M. WNT/PCP signaling pathway and human cancer (review). Oncol Rep. 2005;14:1583-1588. [PubMed] [DOI] |
| 6. | Petersen CP, Reddien PW. Wnt signaling and the polarity of the primary body axis. Cell. 2009;139:1056-1068. [PubMed] [DOI] |
| 7. | Fearon ER. PARsing the phrase "all in for Axin"- Wnt pathway targets in cancer. Cancer Cell. 2009;16:366-368. [PubMed] [DOI] |
| 8. | Oshima H, Oguma K, Du YC, Oshima M. Prostaglandin E2, Wnt, and BMP in gastric tumor mouse models. Cancer Sci. 2009;100:1779-1785. [PubMed] [DOI] |
| 9. | Kurayoshi M, Oue N, Yamamoto H, Kishida M, Inoue A, Asahara T, Yasui W, Kikuchi A. Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion. Cancer Res. 2006;66:10439-10448. [PubMed] [DOI] |
| 10. | Kremenevskaja N, von Wasielewski R, Rao AS, Schöfl C, Andersson T, Brabant G. Wnt-5a has tumor suppressor activity in thyroid carcinoma. Oncogene. 2005;24:2144-2154. [PubMed] [DOI] |
| 11. | Jönsson M, Dejmek J, Bendahl PO, Andersson T. Loss of Wnt-5a protein is associated with early relapse in invasive ductal breast carcinomas. Cancer Res. 2002;62:409-416. [PubMed] |
| 12. | Huang CL, Liu D, Nakano J, Ishikawa S, Kontani K, Yokomise H, Ueno M. Wnt5a expression is associated with the tumor proliferation and the stromal vascular endothelial growth factor--an expression in non-small-cell lung cancer. J Clin Oncol. 2005;23:8765-8773. [PubMed] [DOI] |
| 13. | Yuzugullu H, Benhaj K, Ozturk N, Senturk S, Celik E, Toylu A, Tasdemir N, Yilmaz M, Erdal E, Akcali KC. Canonical Wnt signaling is antagonized by noncanonical Wnt5a in hepatocellular carcinoma cells. Mol Cancer. 2009;8:90. [PubMed] [DOI] |
| 14. | McDonald SL, Silver A. The opposing roles of Wnt-5a in cancer. Br J Cancer. 2009;101:209-214. [PubMed] [DOI] |
| 15. | Blanc E, Roux GL, Bénard J, Raguénez G. Low expression of Wnt-5a gene is associated with high-risk neuroblastoma. Oncogene. 2005;24:1277-1283. [PubMed] [DOI] |
| 16. | Weeraratna AT, Jiang Y, Hostetter G, Rosenblatt K, Duray P, Bittner M, Trent JM. Wnt5a signaling directly affects cell motility and invasion of metastatic melanoma. Cancer Cell. 2002;1:279-288. [PubMed] [DOI] |
| 17. | O'Connell MP, French AD, Leotlela PD, Weeraratna AT. Assaying Wnt5A-mediated invasion in melanoma cells. Methods Mol Biol. 2008;468:243-253. [PubMed] [DOI] |
| 18. | Xavier FC, Rodini CO, Ramalho LM, Mantesso A, Nunes FD. WNT-5A, but not matrix metalloproteinase 3 or beta-catenin protein, expression is related to early stages of lip carcinogenesis. J Oral Pathol Med. 2009;38:708-715. [PubMed] [DOI] |
| 19. | 刘 晓红, 周 航波, 马 恒辉, 周 志毅, 陆 珍凤, 周 晓军. 肝细胞肝癌中Wnt5a、β-catenin和E-cadherin蛋白的表达及临床意义. 临床与实验病理学杂志. 2007;23:400-403. |
| 20. | Liu XH, Pan MH, Lu ZF, Wu B, Rao Q, Zhou ZY, Zhou XJ. Expression of Wnt-5a and its clinicopathological significance in hepatocellular carcinoma. Dig Liver Dis. 2008;40:560-567. [PubMed] [DOI] |
| 21. | Liu X, Wang L, Zhang S, Lin J, Zhang S, Feitelson MA, Gao H, Zhu M. Mutations in the C-terminus of the X protein of hepatitis B virus regulate Wnt-5a expression in hepatoma Huh7 cells: cDNA microarray and proteomic analyses. Carcinogenesis. 2008;29:1207-1214. [PubMed] [DOI] |
| 22. | DeMorrow S, Francis H, Gaudio E, Venter J, Franchitto A, Kopriva S, Onori P, Mancinelli R, Frampton G, Coufal M. The endocannabinoid anandamide inhibits cholangiocarcinoma growth via activation of the noncanonical Wnt signaling pathway. Am J Physiol Gastrointest Liver Physiol. 2008;295:G1150-G1158. [PubMed] [DOI] |
| 23. | Blanc E, Goldschneider D, Douc-Rasy S, Bénard J, Raguénez G. Wnt-5a gene expression in malignant human neuroblasts. Cancer Lett. 2005;228:117-123. [PubMed] [DOI] |
| 24. | Mikels AJ, Nusse R. Purified Wnt5a protein activates or inhibits beta-catenin-TCF signaling depending on receptor context. PLoS Biol. 2006;4:e115. [PubMed] [DOI] |
| 25. | Topol L, Jiang X, Choi H, Garrett-Beal L, Carolan PJ, Yang Y. Wnt-5a inhibits the canonical Wnt pathway by promoting GSK-3-independent beta-catenin degradation. J Cell Biol. 2003;162:899-908. [PubMed] [DOI] |
| 26. | Yamamoto H, Yoo SK, Nishita M, Kikuchi A, Minami Y. Wnt5a modulates glycogen synthase kinase 3 to induce phosphorylation of receptor tyrosine kinase Ror2. Genes Cells. 2007;12:1215-1223. [PubMed] [DOI] |
| 27. | Säfholm A, Tuomela J, Rosenkvist J, Dejmek J, Härkönen P, Andersson T. The Wnt-5a-derived hexapeptide Foxy-5 inhibits breast cancer metastasis in vivo by targeting cell motility. Clin Cancer Res. 2008;14:6556-6563. [PubMed] [DOI] |
| 28. | Pukrop T, Binder C. The complex pathways of Wnt 5a in cancer progression. J Mol Med (Berl). 2008;86:259-266. [PubMed] [DOI] |
| 29. | Bosserhoff AK. Novel biomarkers in malignant melanoma. Clin Chim Acta. 2006;367:28-35. [PubMed] [DOI] |
| 30. | O'Connell MP, Weeraratna AT. Hear the Wnt Ror: how melanoma cells adjust to changes in Wnt. Pigment Cell Melanoma Res. 2009;22:724-739. [PubMed] [DOI] |
| 33. | Akaboshi S, Watanabe S, Hino Y, Sekita Y, Xi Y, Araki K, Yamamura K, Oshima M, Ito T, Baba H. HMGA1 is induced by Wnt/beta-catenin pathway and maintains cell proliferation in gastric cancer. Am J Pathol. 2009;175:1675-1685. [PubMed] [DOI] |
| 34. | Du R, Xia L, Sun S, Lian Z, Zou X, Gao J, Xie H, Fan R, Song J, Li X. URG11 promotes gastric cancer growth and invasion by activation of beta-catenin signalling pathway. J Cell Mol Med. 2010;14:621-635. [PubMed] [DOI] |