修回日期: 2010-03-18
接受日期: 2010-03-23
在线出版日期: 2010-04-28
目的: 探讨食管鳞癌组织clusterin表达和单纯手术治疗前后外周血clusterin含量变化与食管鳞癌临床参数的相关性.
方法: RT-PCR分析5对食管鳞癌及其远端切缘食管上皮中clusterin基因mRNA表达水平; ELISA分析41例单纯手术治疗食管鳞癌患者治疗前后的血清clusterin蛋白表达水平及其与临床特征的相关性.
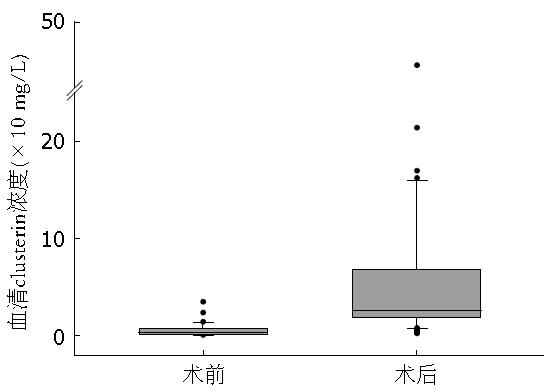
结果: 与正常食管上皮相比食管鳞癌组织中clusterin基因表达显著下降或缺失. 食管鳞癌患者术前血清中clusterin含量明显低于术后血清含量(3.23 mg/L vs 25.71 mg/L, P<0.0001). 食管鳞癌患者术前血清clusterin含量与肿瘤大小相关(P<0.01), 而与年龄、性别、分化程度、肿瘤分期、淋巴结转移, 以及总蛋白、白蛋白、血糖、血脂和总胆红素浓度无关(r = -0.1334, -0.1602, 0.2413, 0.0389, -0.2882, 均P>0.05).
结论: Clusterin基因在食管鳞癌组织中表达明显下调或缺失, 血清clusterin含量明显降低, 提示在食管鳞状细胞癌中clusterin基因可能具有潜在的抑癌基因作用, 动态检测外周血clusterin含量有助于判断食管癌进展.
引文著录: 宋振梅, 孙玉琳, 毛友生, 刘芳, 周兰萍, 赵晓航. 食管鳞癌clusterin表达及其临床意义. 世界华人消化杂志 2010; 18(12): 1217-1221
Revised: March 18, 2010
Accepted: March 23, 2010
Published online: April 28, 2010
AIM: To investigate the expression of clusterin mRNA in esophageal squamous cell carcinoma (ESCC), measure preoperative and postoperative serum clusterin protein levels in ESCC patients, and evaluate their correlations with clinicopathological parameters in ESCC.
METHODS: The expression of full-length clusterin mRNA in ESCC tissue was detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR). Serum clusterin level was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The expression of clusterin mRNA was significantly down-regulated in ESCC tissue compared with matched tumor-adjacent non-cancerous tissue. The median level of serum clusterin in postoperative ESCC patients was significantly higher than that in preoperative patients (25.71 mg/L vs 3.23 mg/L, P < 0.0001). The level of serum clusterin is correlated with tumor size, but not with age, gender, tumor differentiation, tumor grade, lymph node metastasis and biochemical parameters.
CONCLUSION: The expression of clusterin mRNA is down-regulated in ESCC. Serum clusterin level decreases in ESCC patients. Clusterin might be a potential tumor suppressor gene in ESCC. Dynamic measurement of serum clusterin level might aid to evaluate the progression of ESCC.
- Citation: Song ZM, Sun YL, Mao YS, Liu F, Zhou LP, Zhao XH. Clinical significance of clusterin expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1217-1221
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1217
分离和鉴定新的肿瘤相关标志分子, 尤其是血清中的标志分子一直是基础和临床医学的研究热点. 我们在前期工作中, 通过双向电泳(two-dimensional electrophoresis, 2-DE)技术发现食管鳞状细胞癌患者血清clusterin水平与健康对照相比明显降低, 而经手术切除原发肿瘤病灶后, 其表达水平明显回升[1,2]. clusterin, 又称为载脂蛋白J(apoliprotein J, ApoJ)、硫酸化糖蛋白2(sulfated glycoprotein 2, SGP-2)、补体相关蛋白SP-40(complement-associated protein SP-40, SP-40)等[3], Blaschuk等于1983年首次将其从山羊睾丸网液中分离, 因其可引起培养的睾丸支持细胞和红细胞的聚集, 故命名为clusterin[4]. 血清/血浆中的clusterin是一种中高丰度的75-80 kDa异二聚体糖蛋白, 正常成年人的平均浓度约为100 mg/L[5]. 近年来发现, 除了分泌型以外, 正常和转化细胞中clusterin还具有几种其他的表达形式, 涉及多种病理生理过程并参与多种疾病的演进[6]. clusterin在肿瘤发生发展过程中的作用及变化特点也是国内外近年来关注的热点. 本研究采用RT-PCR方法评价了食管鳞癌配对组织中clusterin mRNA的表达变化, 同时采用ELISA方法分析了41例患者手术治疗前后配对血清样本中clusterin的表达变化, 并进一步分析了术前clusterin水平与各种临床参数的相关性, 对深入理解和评价clusterin在食管鳞癌中的表达变化及其机制具有重要意义.
RNeasy mini kit购自美国QIAGEN公司; Superscript First Chain反转录kit购自美国invitrogen公司. 人clusterin ELISA试剂盒购自美国LIFEKEY生物医学技术公司. 食管鳞状细胞癌/癌旁远端配对组织和术前、术后7-10 d的配对血清样本取自中国医学科学院肿瘤医院胸外科单纯手术治疗患者, 并经病理证实. 组织标本一经分离, 迅速去除坏死及结缔组织, 经预冷的生理盐水多次清洗后液氮速冻, 转入-80 ℃冰箱保存. 血清取材后迅速离心, 冰上分离血清, 干冰上分装后转入-80 ℃冰箱保存备用. 患者平均年龄58.2(39-79)岁, 其中男25例, 女16例. 病例取材得到患者本人知情同意, 患者术前未接受输血和放化疗.
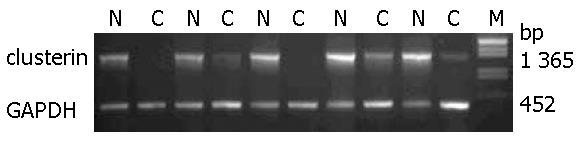
1.2.1 半定量RT-PCR: 食管癌组织及其配对正常食管上皮总RNA的提取按照QIAGEN试剂盒说明书进行. 经1.2%变性甲醛凝胶RNA电泳, 观察RNA质量. 以所提RNA为模板逆转录获得cDNA第一条链. clusterin及内参GAPDH引物参照GenBank基因序列设计. clusterin基因上游引物5'-CCG GAT CCT TAT GAT GAA GAC TCT GCT GCT G-3', 下游引物5'-GCC TCG AGT CAC TCC TCC CGG TGC TTT TTG-3'以及GAPDH上游引物5'-ACC ACA GTC CAT GCC ATC AC-3', 下游引物5'-TCC ACC ACC CTG TTG CTG TA-3'由上海博亚生物技术有限公司合成, 扩增产物大小分别为1 365 bp和452 bp. PCR反应在GeneAmp PCR system 9600基因扩增仪(美国Applied Biosystems公司)上进行. 反应体系25 μL, 反应条件为95 ℃预变性5 min; 95℃变性40 s, 62 ℃退火40 s, 72 ℃延伸 90 s, 35个循环; 72 ℃延伸8 min. 扩增产物经1.2%琼脂糖凝胶电泳分离.
1.2.2 ELISA法分析clusterin血清含量: 血清样品及标准品分别稀释后各10 μL加至反应孔, 室温孵育1 h后每孔加入100 μL酶结合物轻混30 s. 室温孵育45 min, 反复洗涤5次; 加入100 μL TMB显色液轻混10 s; 室温孵育20 min后每孔加入100 μL终止液轻混30 s; 确定颜色由蓝变黄后30 min内, 酶标仪(Bio-rad公司)上读取A450nm. 根据试剂盒标准品的浓度和A值绘制标准曲线. 根据样品A值, 计算血清样品中clusterin浓度并进行统计学分析. 每个样本重复3次, 取平均值作为该样本的血清clusterin浓度.
统计学处理 应用SPSS10.0统计分析软件进行数据的整理与分析, 计数资料根据适用情况选择Student's t检验, Mann-Whitney或Wilcoxon符号秩和检验, 计量资料采用Fisher's精确概率法或配对χ2检验, 两组样本的相关性分析使用Spearman等级相关检验. 其中, 血清clusterin浓度与年龄的相关性使用Spearman等级相关检验, 与性别的关系使用Mann-Whitney秩和检验. P<0.05为具有统计学差异.
提取5对配对食管癌组织的总RNA, 经变性甲醛凝胶电泳分析提示RNA无降解, 质量可靠. 半定量RT-PCR结果表明5对食管鳞癌组织中均存在clusterin基因表达降低或缺失(图1).
食管鳞癌患者术前血清clusterin浓度中位值为3.23 mg/L(浓度范围0.22-34.70 mg/L); 术后血清浓度中位值为25.71 mg/L(浓度范围1.81-490.15 mg/L), 经过Wilcoxon符号秩和检验, 差异具有极显著性(P<0.0001), 表明食管鳞癌患者术前血清clusterin浓度明显降低, 术后1 wk伴有明显回升(图2). 而且, 无论是术前还是术后, 血清clusterin浓度均与年龄和性别无关(P>0.05).
食管癌患者术前血清clusterin含量与肿瘤大小相关(P<0.05), 而与患者性别、年龄、肿瘤浸润深度与分化程度, 以及是否伴有淋巴结转移等因素无关(P>0.05, 表1).
| n | clusterin中位浓度(mg/L) | 范围(mg/L) | P值 | |
| 年龄(岁) | ||||
| ≤60 | 23 | 3.23 | 0.22-23.50 | 0.9476 |
| >60 | 18 | 3.14 | 0.30-34.70 | |
| 性别 | ||||
| 男 | 25 | 3.23 | 0.30-14.38 | 0.968 |
| 女 | 16 | 3.1 | 0.22-34.70 | |
| 肿瘤直径(cm) | ||||
| <5.0 | 17 | 2.54 | 0.22-23.50 | 0.029 |
| ≥5.0 | 24 | 3.91 | 0.71-34.70 | |
| 浸润深度 | ||||
| T1 | 7 | 4.05 | 0.22-23.50 | 0.931 |
| T2-4 | 34 | 3.14 | 0.30-34.70 | |
| 淋巴结转移 | ||||
| 有 | 29 | 3.24 | 0.71-34.70 | 0.2577 |
| 无 | 12 | 1.87 | 0.22-23.50 | |
| 分化程度 | ||||
| 高 | 18 | 2.02 | 0.30-34.70 | 0.112 |
| 中低 | 23 | 3.58 | 0.22-23.50 |
人类clusterin基因定位于8p21-p12, 与脂蛋白脂酶基因座邻近[7], 研究表明多种类型的肿瘤, 包括肝癌、食管癌、前列腺癌、膀胱癌、乳腺癌、卵巢癌、肺癌和白血病等在该区域往往发生高频率的染色体缺失, 因此推测该区可能存在一个或多个抑癌基因[8]. 根据Ensembl基因组数据库和文献的记录, 目前至少发现了3种clusterin的剪切异构体, 编码细胞内前体clusterin(简称psCLU)、成熟分泌型clusterin(简称sCLU)和细胞核型clusterin(nCLU)等多种蛋白形式[9,10]. Clusterin基因在不同物种间具有高度的同源性, 在人体体液和组织细胞中广泛表达, 参与多种重要生理功能, 包括组织分化和重塑、膜再生、脂类转运、细胞-细胞及细胞-细胞外基质相互作用、炎症、细胞运动、分子伴侣、细胞氧化应激、细胞增殖、细胞死亡等[11-15]. 由于其复杂的转录和翻译形式以及亚细胞定位依赖性的多种功能, clusterin被称为"迷样"基因. 近年来认为, clusterin也是一种凋亡相关蛋白, sCLU和nCLU分别促进细胞存活及凋亡过程, 他们的表达变化决定了细胞命运[10]. 因此, clusterin表达水平与肿瘤的关系也受到广泛关注. 目前发现, clusterin在食管鳞状细胞癌、睾丸精原细胞癌、前列腺癌中表达下调, 在胰腺癌、乳腺癌、卵巢癌、结肠癌、前列腺癌、膀胱癌等肿瘤中表达上调[2,10,16-21].
在杂合或纯合缺失clusterin的神经母细胞瘤小鼠模型中, 抑制miR-17-92的表达, 结果发现携带0个或1个clusterin等位基因的小鼠比起具有2个等位基因的小鼠更容易发展为肿瘤并发生肝脏及骨髓转移, 提示clusterin是一种单倍不足的肿瘤抑制基因[22]. 还有学者研究发现clusterin衍生蛋白抑制多种肿瘤细胞系的增殖, 并显著增强肿瘤异种移植物模型中抗细胞增殖药物活性[23]. 而且, 膀胱癌、卵巢癌、食管癌、宫颈癌、前列腺癌、乳腺癌、肺癌等肿瘤中的研究结果还提示组织中psCLU和sCLU表达水平同肿瘤分化程度、病理分级、患者的不良预后和化疗敏感性有关[20,21,24-30]. 最近的研究结果还发现, sCLU是TGF-β诱导的肿瘤细胞上皮间叶转换(epithelial-to-mesenchymal transition)中重要的细胞外中介者, 体内实验显示, 使用其中和抗体治疗后, 明显降低了裸鼠乳腺癌移植瘤模型的肺转移发生率, 提示其在肿瘤转移中具有重要作用, 有望发展为新的抗肿瘤转移药靶[31]. 但是, 血清clusterin浓度在食管癌患者手术治疗前后的变化趋势目前还无深入研究. 我们运用半定量RT-PCR分析了5对配对食管鳞癌及正常食管上皮中clusterin基因的表达情况, 结果显示clusterin在食管鳞癌组织表达降低或缺失. 虽然前面已经提到, clusterin基因转录本具有多种剪切异构体, 但本研究中使用的引物扩增的是clusterin全长转录本. 由于他在食管癌中表达下调, 推测clusterin基因缺失促进了食管肿瘤细胞的癌变和进展.
此外, 本研究初步测定了食管鳞癌患者手术治疗前后的血清clusterin水平, 发现术前血清clusterin水平明显低于文献报道的健康人正常血清clusterin水平, 而手术后的表达量较术前显著增加, 结合临床资料分析, clusterin水平与肿瘤大小相关. 由于clusterin基因所在染色体区段在食管癌中通常发生缺失, 而且在乳腺癌中的研究也表明DNA甲基化是调控clusterin表达的重要表观遗传方式[32], 故而食管癌组织中全长转录本及患者血清中成熟分泌型蛋白的表达下调均提示clusterin在食管癌中可能是一种潜在的抑癌基因. 但是, 也应充分认识到上述结果仍有待于进一步扩大样本以确定合适的血清clusterin检测阈值, 并使结果更趋精确. 而且, 导致clusterin基因在食管癌中表达下调, 以及手术切除肿瘤原发病灶后血清clusterin含量有所回升的机制仍需进一步探索.
近年来发现, clusterin除了分泌型以外, 还具有几种其他的表达形式, 涉及多种病理生理过程并参与多种疾病的演进. 作者前期工作也发现, 食管鳞状细胞癌患者血清clusterin水平与健康对照相比明显降低, 而经手术切除原发肿瘤病灶后, 其表达水平明显回升.
苌新明, 教授, 西安交通大学医学院第一附属医院消化内科
Clusterin具有多种不同的剪切异构体, 在多种肿瘤中存在异常表达. 目前发现, 食管鳞状细胞癌患者血清clusterin水平明显降低, 但其在术前和术后的表达差异以及与临床参数的相关性尚无深入研究.
本研究发现clusterin全长转录本在食管癌中表达下调, 同时术前患者血清clusterin水平明显低于健康人, 而手术后的表达量较术前显著增加, 因此推测其在食管癌中可能是一种潜在的抑癌基因.
Clusterin全长转录本和血清蛋白水平在食管鳞状细胞癌患者中均明显降低, 提示他可能是一种抑癌基因, 同时其血清水平可用于食管癌患者的诊断和治疗效果监测.
1 成熟分泌型clusterin: 简称sCLU, 是相对分子质量约75-80 kDa异二聚体血清/血浆糖蛋白, 由通过二硫键连接的α和β链组成. 2 细胞内前体clusterin: 简称psCLU, 定位于细胞质, 是相对分子质量约60 kDa的单链分子, 不具有信号肽. 3 细胞核型clusterin (nCLU): 是定位于细胞核内的相对分子质量约50 kDa的截短型蛋白形式.
本研究选题新颖, 设计合理, 方法先进, 数据处理可靠, 结论可信, 有一定创新性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Zhang LY, Ying WT, Mao YS, He HZ, Liu Y, Wang HX, Liu F, Wang K, Zhang DC, Wang Y. Loss of clusterin both in serum and tissue correlates with the tumorigenesis of esophageal squamous cell carcinoma via proteomics approaches. World J Gastroenterol. 2003;9:650-654. [PubMed] [DOI] |
| 2. | He HZ, Song ZM, Wang K, Teng LH, Liu F, Mao YS, Lu N, Zhang SZ, Wu M, Zhao XH. Alterations in expression, proteolysis and intracellular localizations of clusterin in esophageal squamous cell carcinoma. World J Gastroenterol. 2004;10:1387-1391. [PubMed] [DOI] |
| 3. | Trougakos IP, Gonos ES. Clusterin/apolipoprotein J in human aging and cancer. Int J Biochem Cell Biol. 2002;34:1430-1448. [PubMed] [DOI] |
| 4. | Blaschuk O, Burdzy K, Fritz IB. Purification and characterization of a cell-aggregating factor (clusterin), the major glycoprotein in ram rete testis fluid. J Biol Chem. 1983;258:7714-7720. [PubMed] |
| 5. | Bettuzzi S, Rizzi F. Chapter 5: Nuclear CLU (nCLU) and the fate of the cell. Adv Cancer Res. 2009;104:59-88. [PubMed] [DOI] |
| 6. | Balantinou E, Trougakos IP, Chondrogianni N, Margaritis LH, Gonos ES. Transcriptional and posttranslational regulation of clusterin by the two main cellular proteolytic pathways. Free Radic Biol Med. 2009;46:1267-1274. [PubMed] [DOI] |
| 7. | Leskov KS, Klokov DY, Li J, Kinsella TJ, Boothman DA. Synthesis and functional analyses of nuclear clusterin, a cell death protein. J Biol Chem. 2003;278:11590-11600. [PubMed] [DOI] |
| 8. | Xiao WH, Liu WW. [Analysis of methylation and loss of heterozygosity of RUNX3 gene in hepatocellular carcinoma and its clinical significance]. Zhonghua Gan Zang Bing Za Zhi. 2004;12:227-230. [PubMed] |
| 9. | Rizzi F, Coletta M, Bettuzzi S. Chapter 2: Clusterin (CLU): From one gene and two transcripts to many proteins. Adv Cancer Res. 2009;104:9-23. [PubMed] [DOI] |
| 10. | Pucci S, Bonanno E, Sesti F, Mazzarelli P, Mauriello A, Ricci F, Zoccai GB, Rulli F, Galatà G, Spagnoli LG. Clusterin in stool: a new biomarker for colon cancer screening? Am J Gastroenterol. 2009;104:2807-2815. [PubMed] [DOI] |
| 11. | Shannan B, Seifert M, Leskov K, Willis J, Boothman D, Tilgen W, Reichrath J. Challenge and promise: roles for clusterin in pathogenesis, progression and therapy of cancer. Cell Death Differ. 2006;13:12-19. [PubMed] [DOI] |
| 12. | Trougakos IP, Lourda M, Agiostratidou G, Kletsas D, Gonos ES. Differential effects of clusterin/apolipoprotein J on cellular growth and survival. Free Radic Biol Med. 2005;38:436-449. [PubMed] [DOI] |
| 13. | Trougakos IP, Gonos ES. Regulation of clusterin/apolipoprotein J, a functional homologue to the small heat shock proteins, by oxidative stress in ageing and age-related diseases. Free Radic Res. 2006;40:1324-1334. [PubMed] [DOI] |
| 14. | Shin YJ, Kim JH, Seo JM, Lee SM, Hyon JY, Yu YS, Wee WR. Protective effect of clusterin on oxidative stress-induced cell death of human corneal endothelial cells. Mol Vis. 2009;15:2789-2795. [PubMed] |
| 15. | Jones SE, Jomary C. Clusterin. Int J Biochem Cell Biol. 2002;34:427-431. [PubMed] [DOI] |
| 16. | Behrens P, Jeske W, Wernert N, Wellmann A. Downregulation of clusterin expression in testicular germ cell tumours. Pathobiology. 2001;69:19-23. [PubMed] [DOI] |
| 17. | Scaltriti M, Brausi M, Amorosi A, Caporali A, D'Arca D, Astancolle S, Corti A, Bettuzzi S. Clusterin (SGP-2, ApoJ) expression is downregulated in low- and high-grade human prostate cancer. Int J Cancer. 2004;108:23-30. [PubMed] [DOI] |
| 18. | Redondo M, Villar E, Torres-Muñoz J, Tellez T, Morell M, Petito CK. Overexpression of clusterin in human breast carcinoma. Am J Pathol. 2000;157:393-399. [PubMed] [DOI] |
| 19. | Xie MJ, Motoo Y, Su SB, Mouri H, Ohtsubo K, Matsubara F, Sawabu N. Expression of clusterin in human pancreatic cancer. Pancreas. 2002;25:234-238. [PubMed] [DOI] |
| 20. | Yang GF, Li XM, Xie D. Overexpression of clusterin in ovarian cancer is correlated with impaired survival. Int J Gynecol Cancer. 2009;19:1342-1346. [PubMed] [DOI] |
| 21. | Miyake H, Gleave M, Kamidono S, Hara I. Overexpression of clusterin in transitional cell carcinoma of the bladder is related to disease progression and recurrence. Urology. 2002;59:150-154. [PubMed] [DOI] |
| 22. | Chayka O, Corvetta D, Dews M, Caccamo AE, Piotrowska I, Santilli G, Gibson S, Sebire NJ, Himoudi N, Hogarty MD. Clusterin, a haploinsufficient tumor suppressor gene in neuroblastomas. J Natl Cancer Inst. 2009;101:663-677. [PubMed] [DOI] |
| 23. | Kliger Y, Levy O, Oren A, Ashkenazy H, Tiran Z, Novik A, Rosenberg A, Amir A, Wool A, Toporik A. Peptides modulating conformational changes in secreted chaperones: from in silico design to preclinical proof of concept. Proc Natl Acad Sci USA. 2009;106:13797-13801. [PubMed] [DOI] |
| 24. | Chen Y, Lim BK, Hashim OH. Different altered stage correlative expression of high abundance acute-phase proteins in sera of patients with epithelial ovarian carcinoma. J Hematol Oncol. 2009;2:37. [PubMed] [DOI] |
| 25. | He LR, Liu MZ, Li BK, Rao HL, Liao YJ, Zhang LJ, Guan XY, Zeng YX, Xie D. Clusterin as a predictor for chemoradiotherapy sensitivity and patient survival in esophageal squamous cell carcinoma. Cancer Sci. 2009;100:2354-2360. [PubMed] [DOI] |
| 26. | Watari H, Kanuma T, Ohta Y, Hassan MK, Mitamura T, Hosaka M, Minegishi T, Sakuragi N. Clusterin expression inversely correlates with chemosensitivity and predicts poor survival in patients with locally advanced cervical cancer treated with cisplatin-based neoadjuvant chemotherapy and radical hysterectomy. Pathol Oncol Res. 2010;16:345-352. [PubMed] [DOI] |
| 27. | Yom CK, Woo HY, Min SY, Kang SY, Kim HS. Clusterin overexpression and relapse-free survival in breast cancer. Anticancer Res. 2009;29:3909-3912. [PubMed] |
| 28. | Miyake H, Muramaki M, Furukawa J, Kurahashi T, Fujisawa M. Serum level of clusterin and its density in men with prostate cancer as novel biomarkers reflecting disease extension. Urology. 2010;75:454-459. [PubMed] [DOI] |
| 29. | Rizzi F, Bettuzzi S. The clusterin paradigm in prostate and breast carcinogenesis. Endocr Relat Cancer. 2010;17:R1-R17. [PubMed] [DOI] |
| 30. | Panico F, Rizzi F, Fabbri LM, Bettuzzi S, Luppi F. Clusterin (CLU) and lung cancer. Adv Cancer Res. 2009;105:63-76. [PubMed] [DOI] |
| 31. | Lenferink AE, Cantin C, Nantel A, Wang E, Durocher Y, Banville M, Paul-Roc B, Marcil A, Wilson MR, O'Connor-McCourt MD. Transcriptome profiling of a TGF-beta-induced epithelial-to-mesenchymal transition reveals extracellular clusterin as a target for therapeutic antibodies. Oncogene. 2010;29:831-844. [PubMed] [DOI] |
| 32. | Serrano A, Redondo M, Tellez T, Castro-Vega I, Roldan MJ, Mendez R, Rueda A, Jimenez E. Regulation of clusterin expression in human cancer via DNA methylation. Tumour Biol. 2009;30:286-291. [PubMed] [DOI] |