修回日期: 2010-03-29
接受日期: 2010-04-06
在线出版日期: 2010-04-18
目的: 测定Pinl抑制剂(Juglone)对食管癌细胞EC1生长增殖的影响, 探讨Juglone的抗肿瘤作用.
方法: 体外培养人食管癌细胞系EC1, 用MTT试验观察细胞生长增殖状况, 流式细胞仪检测细胞周期以及细胞凋亡.
结果: MTT试验表明, Juglone对EC1细胞生长有明显的抑制作用, 且抑制作用随作用浓度和作用时间增加而增强. 流式细胞仪检测表明, 加入Juglone培养48 h后, EC1细胞出现G2期阻滞. Juglone药物(10、20、30 μmol/L)培养48 h后, EC1细胞的凋亡率明显增加, 与对照组相比有统计学意义(9.06%, 32.88%, 53.18% vs 8.77%, 均P<0.05).
结论: Pinl抑制剂Juglone可以通过抑制Pinl表达从而抑制食管癌细胞的增殖, Pinl抑制剂有望成为新型的抗肿瘤治疗靶点.
引文著录: 李玲, 陈平, 连鸿凯, 赵纪敏, 马俊芬, 董子明. Pinl抑制剂Juglone对食管癌EC1细胞增殖的抑制作用. 世界华人消化杂志 2010; 18(11): 1147-1151
Revised: March 29, 2010
Accepted: April 6, 2010
Published online: April 18, 2010
AIM: To investigate whether juglone, an inhibitor of Pin1, inhibits the proliferation of human esophageal carcinoma cells (EC1) in vitro.
METHODS: Cultured EC1 cells were incubated with different concentrations of juglone for different durations. The proliferation of EC1 cells was detected by methyl thiazolyl tetrazolium (MTT) assay. The cell cycle distribution and cell apoptosis were measured by flow cytometry (FCM).
RESULTS: MTT results showed that juglone treatment decreased the proliferation of EC1 cells in a dose- and time-dependent manner. FCM assay indicated that, after treatment of EC1 cells with juglone at doses of 10, 20 and 30 μmol/L, the cell cycle was arrested at G2 phase, and the apoptosis rates increased significantly compared to control cells (9.06%, 32.88% and 53.18% vs 8.77%, respectively; all P < 0.05).
CONCLUSION: Juglone significantly inhibits the proliferation and induces the apoptosis of EC1s in vitro.
- Citation: Li L, Chen P, Lian HK, Zhao JM, Ma JF, Dong ZM. Juglone inhibits the proliferation of human esophageal carcinoma EC1 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1147-1151
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1147.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1147
肽酰-脯氨酰顺反异构酶(peptidyl-prolyl cis/trans isomerase, Pinl)作为一种在磷酸化蛋白水平特异调节的变构酶, 在许多肿瘤组织中过表达[1-3], 通过多条途径促进细胞的异常增殖和肿瘤的发生[4-6]. 阻抑Pinl的功能或减少其表达将能有效地抑制这些致癌途径[7,8]. 天然产物胡桃醌(Juglone)是通过高通量筛选发现的第一个Pinl小分子抑制剂[9]. 1968年Bhargava和Westfall发现胡桃作为药物在白化病小鼠模型上可以抑制乳腺癌的生长[10]. 随后, Sugie等于1998年发现了Juglone可以在F344小鼠上减少肠道肿瘤的形成[7]. 本研究通过体外实验, 研究Juglone对食管癌EC1细胞生长的影响, 证实Pinl在EC1细胞生长增殖中的作用并为Juglone的抗肿瘤机制提供实验依据.
人食管癌细胞系EC1保存于本研究室, 1640培养液和新生牛血清为Gibco公司产品, Juglone购于Calbiochem公司, 四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)和碘化丙啶(PI)购自Sigma公司, Annexin V-FITC凋亡测定试剂盒购于郑州宝赛生物制品公司.
1.2.1 药物配制: 将Juglone配制成终浓度为2 mmol/L的Juglone工作液, 常温避光下保存.
1.2.2 细胞培养及实验分组人食管癌细胞株: EC1在含100 mL/L胎牛血清的1640培养液中, 于37 ℃、50 mL/L CO2饱和湿度培养. 实验分为3组: Juglone组、试剂对照组、空白对照组. 在Juglone组中, 设置不同的浓度组(10、20、30 μmol/L), 每个浓度设3个平行组.
1.2.3 MTT法检测细胞增殖: 取对数生长期食管癌细胞, 接种到96孔培养板上, 分组同上. 细胞贴壁后, 加药继续培养, 分别于12、24 h加入MTT(5 g/L)20 μL, 37 ℃温育4 h后吸去培养液, 加DMSO 200 μL, 振荡10 min, 使结晶完全溶解, 在酶标仪上于570 nm波长测吸光度(A)值, 空白对照调零. 并按照下面公式计算不同浓度Juglone对EC1细胞增殖活力的抑制: 细胞抑制率(%) = (阴性对照组A值-实验组A值/阴性对照组A值)×100%.
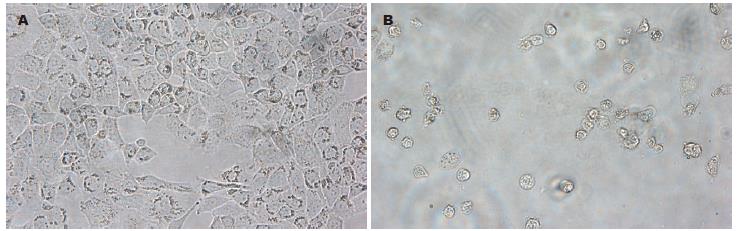
1.2.4 细胞形态学观察: EC1细胞在用30 μmol/L Juglone培养48 h后, 在相差显微镜下观察细胞形态学的变化.
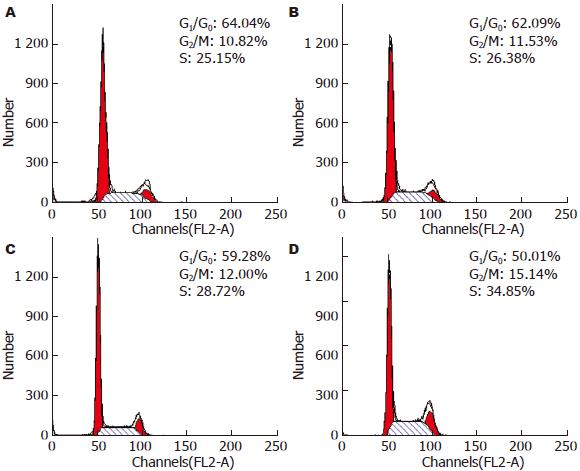
1.2.5 流式细胞仪(FCM)测定细胞周期: 取对数生长期食管癌细胞, 接种到6孔培养板上, 待细胞贴壁后, 用血清饥饿法使细胞同步化, 再换成含l00 mL/L灭活胎牛血清培养液, 并加入不同浓度的Juglone, 48 h后收集细胞. 用PBS清洗2次, 重悬浮于700 mL/L乙醇4 ℃固定过夜, 加入RNA酶(终浓度为100 mg/L), 在37 ℃反应0.5 h. 避光加入PI(浓度为100 mg/L)标记溶液染色20-30 min后, 采用FACSort流式细胞仪(美国BD公司产品)进行检测分析.
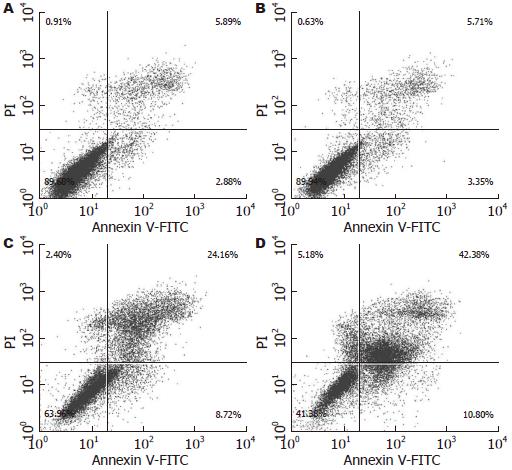
1.2.6 流式细胞仪(FCM)测定细胞凋亡: 取对数生长期食管癌细胞, 接种到6孔培养板上, 待细胞贴壁后, 加入不同浓度的Juglone, 48 h后收集细胞. 按照试剂盒说明书处理细胞. 具体操作如下: 用PBS清洗2次, 尽量去除PBS残留. 重悬细胞于200 μL Binding Buffer中, 加入10 μL Annexin V-FITC和5 μL PI, 轻轻混匀, 4 ℃反应30 min. 实验设置相应的对照组. 之后加入300 μL Binding Buffer, 采用FACSort流式细胞仪(美国BD公司产品)进行检测分析.
统计学处理 采用SPSS12.0统计软件进行数据分析. 多组间的数据比较采用方差分析, 两两比较采用q检验.
EC1细胞经不同浓度的Juglone处理24 h和48 h后, MTT法检测细胞增殖的变化, 结果见表1. 比较不同浓度的用药组, 结果发现Juglone组在加药培养后, 都能不同程度地抑制食管癌细胞的增殖, 对其生长产生明显的抑制作用. 特别是当Juglone浓度达到30 μmol/L时, 24 h和48 h对细胞的抑制率达到了47.4%和55.9%. 与空白对照组比较, 差异均具有统计学意义(均P<0.01).
食管癌细胞在用Juglone(30 μmol/L)培养48 h后, 在相差显微镜下, 可观察到细胞大部分凋亡, 细胞体积缩小、细胞内出现颗粒沉着、细胞皱缩、细胞解离成彼此黏附成簇的圆形小体-凋亡小体, 部分细胞脱壁. 而空白对照组细胞未见明显细胞凋亡现象(图1).
食管癌细胞在用Juglone药物(10、20、30 μmol/L)培养48 h后, G2/M期细胞比例数明显增加, 而G0/G1期细胞比例数却降低(图2). 由此可见, Juglone可造成食管癌细胞在G2/M期的阻滞.
食管癌细胞在用Juglone药物(10、20、30 μmol/L)培养48 h后, 随着药物浓度的增加, EC1细胞的凋亡率明显增加(9.06%, 32.88%, 53.18% vs 8.77%, 图3). 由此可见, Juglone可增加食管癌细胞的凋亡率.
食管癌是最常见的恶性肿瘤之一[11]. 近年来, 随着外科技术水平的发展和放疗、化疗方案的日趋成熟, 食管癌的综合治疗达到了一个新的水平, 但令人遗憾的是其手术后5年生存率仅为25%-40%, 没有显著的提高. 如何寻求一种新型的抗癌靶标, 提高食管癌的化疗效果, 成为当前食管癌研究的一个紧迫问题.
目前的研究报道, Pin1在许多癌症中高表达, 并且还可以作为一些癌症的预后指标, 包括鳞状食管癌[12], 其介导的肽酰-脯氨酰异构化参与肿瘤发生的许多信号通路的调节, 与食管癌关系密切的c-Jun、P53、NF-κB、CyclinD1、β-catenin等均为Pin1的作用底物[5]. Pin1也参与许多重要的细胞致癌事件中, 比如细胞分化, 血管生成以及肿瘤转移等, 对Pin1的抑制可以诱导细胞凋亡. 同时, 一些选择性抑制Pin1的化合物也已经得到了鉴定[13]. 这些研究表明, Pin1介导的磷酸化后调节可以提供一种新的破坏原癌通路的机会, 同时提供了一条新的抗癌治疗途径. 研究报道, Pinl敲除小鼠不仅可以正常发育, 而且对转基因引起的致癌性有很高的抵制能力[14], 提示Pinl抑制剂可能具有小的非特异性毒性. 故本实验引入了Pinl抑制剂Juglone, 在体外实验中用不同的方法研究Juglone对人食管癌细胞生长的影响, 从另一角度进一步证实Pinl在细胞周期调控中的重要作用.
Juglone, 又名5-羟-1, 4-萘醌(5-Hydroxy-1, 4-naphthlenedione), 最先是从胡桃的果皮和叶子中分离和提取出来[9], 是肽酰-脯氨酰同分异构酶家族成员的不可逆抑制剂[9,13]. 作为Pinl的抑制剂, Juglone在实验研究中表现出对肿瘤细胞的抗癌活性[15]. 本研究显示, Pinl抑制剂Juglone组能明显抑制食管癌细胞的生长, 诱导癌细胞凋亡的发生, 并将食管癌细胞的细胞周期阻滞于G2/M期. 这些结果提示, Juglone具有抗肿瘤的作用, 可望成为继传统化疗药物之后的又一新型化疗药物. 这可能为抗肿瘤治疗提供了又一新的途径, 同时也从肿瘤发病机制的角度上进一步证实了Pinl是一个与细胞周期调控高度相关的蛋白, 参与食管癌的发生, 在食管癌的发生发展过程中起着重要作用.
肽酰-脯氨酰顺反异构酶(Pinl)作为一种在磷酸化蛋白水平特异调节的变构酶, 在肿瘤发生中起重要作用. 本文通过阻抑Pinl的功能观察其在食管癌发生中的作用.
张国梁, 主任医师, 天津市第一中心医院消化内科.
Atchison等于2003年发表研究, 指出Pinl敲除小鼠不仅可以正常发育, 而且对转基因引起的致癌性有很高的抵制能力, 提示Pinl抑制剂可能具有小的非特异性毒性. 这为Pin1抑制在临床上的应用提供了理论基础.
文章中通过Juglone阻断Pin1功能的发挥, 从而抑制人食管鳞状细胞的增殖并且增强细胞凋亡率, 为探讨食管癌治疗中特异性信号通路阻断剂的治疗新策略提供了思路与理论依据.
食管癌治疗中产生的耐药问题成为提高食管癌治愈率的一个紧迫问题. 本文通过研究Pin1的抑制剂Juglone对食管癌细胞增殖的影响, 为寻求一种新型的抗癌靶标, 提高食管癌的化疗效果, 提供了理论依据.
本文选题合理, 具有一定先进性, 结果可靠, 讨论深入浅出, 有一定说服力.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lu KP, Zhou XZ. The prolyl isomerase PIN1: a pivotal new twist in phosphorylation signalling and disease. Nat Rev Mol Cell Biol. 2007;8:904-916. [PubMed] |
| 2. | Yeh ES, Means AR. PIN1, the cell cycle and cancer. Nat Rev Cancer. 2007;7:381-388. [PubMed] |
| 3. | Takahashi K, Uchida C, Shin RW, Shimazaki K, Uchida T. Prolyl isomerase, Pin1: new findings of post-translational modifications and physiological substrates in cancer, asthma and Alzheimer's disease. Cell Mol Life Sci. 2008;65:359-375. [PubMed] |
| 4. | Wulf GM, Liou YC, Ryo A, Lee SW, Lu KP. Role of Pin1 in the regulation of p53 stability and p21 transactivation, and cell cycle checkpoints in response to DNA damage. J Biol Chem. 2002;277:47976-47979. [PubMed] |
| 5. | Lu KP. Pinning down cell signaling, cancer and Alzheimer's disease. Trends Biochem Sci. 2004;29:200-209. [PubMed] |
| 6. | Matsuura I, Chiang KN, Lai CY, He D, Wang G, Ramkumar R, Uchida T, Ryo A, Lu K, Liu F. Pin1 promotes transforming growth factor-beta-induced migration and invasion. J Biol Chem. 2010;285:1754-1764. [PubMed] |
| 7. | Sugie S, Okamoto K, Rahman KM, Tanaka T, Kawai K, Yamahara J, Mori H. Inhibitory effects of plumbagin and juglone on azoxymethane-induced intestinal carcinogenesis in rats. Cancer Lett. 1998;127:177-183. [PubMed] |
| 8. | Paulsen MT, Ljungman M. The natural toxin juglone causes degradation of p53 and induces rapid H2AX phosphorylation and cell death in human fibroblasts. Toxicol Appl Pharmacol. 2005;209:1-9. [PubMed] |
| 9. | Hennig L, Christner C, Kipping M, Schelbert B, Rücknagel KP, Grabley S, Küllertz G, Fischer G. Selective inactivation of parvulin-like peptidyl-prolyl cis/trans isomerases by juglone. Biochemistry. 1998;37:5953-5960. [PubMed] |
| 10. | Bhargava UC, Westfall BA, Siehr DJ. Preliminary pharmacology of ellagic acid from Juglans nigra (black walnut). J Pharm Sci. 1968;57:1728-1732. [PubMed] |
| 11. | Metzger R, Schneider PM, Warnecke-Eberz U, Brabender J, Hölscher AH. Molecular biology of esophageal cancer. Onkologie. 2004;27:200-206. [PubMed] |
| 12. | Fukuchi M, Fukai Y, Kimura H, Sohda M, Miyazaki T, Nakajima M, Masuda N, Tsukada K, Kato H, Kuwano H. Prolyl isomerase Pin1 expression predicts prognosis in patients with esophageal squamous cell carcinoma and correlates with cyclinD1 expression. Int J Oncol. 2006;29:329-334. [PubMed] |
| 14. | Atchison FW, Means AR. Spermatogonial depletion in adult Pin1-deficient mice. Biol Reprod. 2003;69:1989-1997. [PubMed] |
| 15. | Aithal BK, Kumar MR, Rao BN, Udupa N, Rao BS. Juglone, a naphthoquinone from walnut, exerts cytotoxic and genotoxic effects against cultured melanoma tumor cells. Cell Biol Int. 2009;33:1039-1049. [PubMed] |