修回日期: 2010-03-18
接受日期: 2010-03-23
在线出版日期: 2010-04-18
目的: 探讨细胞凋亡及相关蛋白的表达与小肠腺癌发生发展的关系.
方法: 研究包括35例正常小肠(空肠)组织和7例手术切除的小肠腺癌组织, 临床资料查阅病历; 用TUNEL法检测细胞凋亡; 用免疫组织化学检测相关蛋白Bid和Bcl-xL的表达.
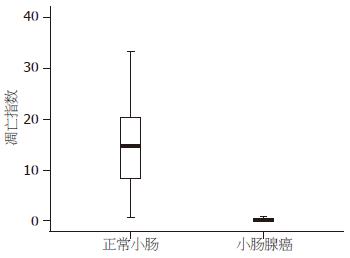
结果: 小肠腺癌的凋亡指数(apoptotic index, AI)明显低于正常小肠组织(0.29% vs 15.78%, t = 6.51, P<0.01); 蛋白Bid在小肠腺癌的表达低于正常小肠组织(28.57% vs 77.14%, P<0.05); 蛋白Bcl-xL在小肠腺癌的表达高于正常组织(86.71% vs 34.29%, P<0.05); Bid/Bcl-xL≥1的样本数在小肠腺癌低于正常小肠(14.29% vs 80.00%, P<0.01). 相关性分析显示AI和蛋白Bid的免疫组织化学得分呈正相关(r = 0.368, P<0.05), 但与蛋白Bcl-xL的免疫组织化学得分之间缺乏相关性(r = 0.017, P>0.05).
结论: 细胞凋亡水平的降低; 蛋白Bid的低表达和Bid/Bcl-xL比值的降低可能在小肠肿瘤的发生和发展过程中发挥重要的作用.
引文著录: 郭文娟, 王爱英, 高春. 小肠腺癌组织的细胞凋亡及相关蛋白Bid和Bcl-xL的表达及意义. 世界华人消化杂志 2010; 18(11): 1127-1133
Revised: March 18, 2010
Accepted: March 23, 2010
Published online: April 18, 2010
AIM: To examine whether apoptosis and expression of apoptosis-related proteins Bid and Bcl-xL are involved in the pathogenesis of small intestinal adenocarcinoma.
METHODS: Forty-two tissue samples, including 7 from human small intestinal adenocarcinoma (of the jejunum and ileum) and 35 from normal small intestine (the jejunum), were examined in our study. Apoptotic index (AI) was assessed by terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling (TUNEL) assay. The expression of Bid and Bcl-xL proteins was detected by immunohistochemistry (IHC).
RESULTS: A significantly higher level of enterocyte apoptosis was observed in normal small intestine tissue compared with small intestinal adenocarcinoma (mean AI, 15.78% vs 0.29%, t = 6.51, P < 0.01). The positive rate of Bid expression in normal small intestine tissue (moderate/strong immunoreactivity in the cytoplasm of villus epithelial cells) was significantly higher (77.14% vs 28.57%, P < 0.05) than that in small intestinal adenocarcinoma, while the positive rate of Bcl-xL expression was significantly lower (34.29% vs 86.71%, P < 0.05) in normal small intestine tissue than in adenocarcinoma. The percentage of samples having a Bid/Bcl-xL ratio ≥ 1 was significantly lower in small intestinal adenocarcinoma compared to normal small intestinal tissue (14.29% vs 80.00%, P < 0.01). A positive correlation was noted between AI and Bid expression level (r = 0.368, P < 0.05), but not between AI and Bcl-xL expression level (r = 0.017, P > 0.05).
CONCLUSION: Decreased apoptosis, Bid expression and Bid/Bcl-xL ratio may play a role in the carcinogenesis of human small intestine adenocarcinoma.
- Citation: Guo WJ, Wang AY, Gao C. Apoptosis and expression of apoptosis-related proteins Bid and Bcl-xL in human small intestinal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1127-1133
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1127.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1127
小肠肿瘤的年发病率不到十万分之一, 仅占消化系恶性肿瘤的2%[1,2], 其中腺癌约占30%-40%, 小肠腺癌的发病率仅为大肠腺癌的1/50[3]. 肿瘤的发生与细胞凋亡关系密切, 凋亡是细胞主动的程序性死亡, 对内环境稳态的维持和机体正常的生长发育有重要意义, 如果凋亡过程受损使得衰老、损伤、畸变的细胞不能及时清除, 大量基因突变的细胞在体内扩增会导致肿瘤的发生[4-6]. Bcl-2家族特别是BH3-only亚家族对细胞凋亡的调节起了关键的作用[7-9]. 由于目前对于小肠腺癌的研究相对较少, 本文从凋亡角度研究小肠腺癌的细胞凋亡及相关蛋白Bid和Bcl-xL在小肠腺癌的表达, 初步探讨细胞凋亡与小肠腺癌发生的关系.
收集北京大学第三医院2003-2007年发生于消化系的腺癌和正常组织42例, 所有入选标本符合如下条件: 均来源于空肠或回肠, 其中正常组织来源于内镜或小肠造影时黏膜活检取材, 腺癌组织来源于外科手术标本; 位于十二指肠和末端回肠的标本从入选中删除; 所有的肿瘤患者均为原发性肿瘤并得到病理诊断, 排除身体其他部位有肿瘤的标本. 最终入选的42例标本中含有35例正常空肠组织和7例小肠腺癌组织(6例空肠和1例回肠). 所有标本取材后立即用40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 每份标本均制作成免疫组织化学用的切片. 细胞凋亡试剂盒(In Situ Cell Death Detection Kit, POD)、DNase Ⅰ(DNase Ⅰ recombinant, grade Ⅰ)、蛋白酶K(proteinase K, recombinant, PCR Grade)和NBT/BCIP显色液均购自德国罗氏公司(Roche, Germany); Bid兔抗人单克隆抗体由Abcam公司提供(1:250); Bcl-xL兔抗人单克隆抗体(1:200)由Cell signaling公司提供. DAB显色液购于DAKO公司. 二抗、多聚赖氨酸、0.01 mol/L磷酸盐(PBS)缓冲液(pH7.2-7.4)、0.01 mol/L枸橼酸盐缓冲液(pH6.0)及其他常规试剂均购自北京中衫公司.
1.2.1 TUNEL检测组织凋亡: 石蜡切片脱蜡、水化后, 蛋白酶K(1:10)37 ℃孵育10 min, PBS冲洗后加入TUNEL反应液, 避光湿盒孵育60 min, PBS冲洗后加入Converter-POD反应液, 湿盒孵育30 min, 最后NBT/BCIP显色, 甲基绿复染. 阴性对照使用Lable Solution取代TUNEL反应液. 结果判定: 每张切片选5-10个高倍镜视野, 计数黏膜及腺管上皮细胞, 核染色阳性者记为TUNEL阳性细胞, 计数阳性细胞占视野总细胞数的百分比, 其均值即为该标本的AI.
1.2.2 免疫组织化学检测蛋白表达: 按照PV两步法进行; 40 g/L甲醛溶液固定, 常规石蜡包埋切片(厚度4 μm), 贴于涂有多聚赖氨酸的玻片上, 常规脱蜡至水, 微波修复高火15 min, 3%过氧化氢甲醇溶液灭活内源性过氧化物酶, 余步骤按照试剂盒说明操作. 对照设立包括阳性对照、阴性空白对照和阴性替代对照; 阳性对照由已知阳性切片做阳性对照, 空白对照由既往实验证实, 阴性替代对照用0.01 mol/L的PBS(pH7.4)代替一抗.
1.2.3 结果判定: 染色强度计分: 无色0分; 淡黄色1分; 黄色2分; 棕褐色3分. 阳性细胞数计分: <25% 1分; 26%-50% 2分; 51%-75% 3分; >75% 4分、根据染色强度和阳性细胞数计分之和进行判断: 0分为阴性(-), 1-2分为弱阳性(+), 3-5分为阳性(++), 6-7分为强阳性(+++). 所有结果均经3位作者在病理医生帮助下分别阅片, 若有异议共同商议后确定.
统计学处理 用SPSS13.0软件处理, 连续变量之间的比较采用Mann-Whitney非参数U检验; 组间阳性率比较用根据样本量大小选用Pearson χ2、continuity χ2或Fisher's exact检验. 应用Spearman等级相关分析处理AI和蛋白表达阳性率、各蛋白表达阳性率之间的相关性. P<0.05表示有统计学意义.
在42例小肠组织中, 年龄、性别、取材部位、影像学诊断等见表1, 统计显示正常小肠组织和小肠腺癌在性别、年龄比较中均未见差异.
| 分组 | 正常小肠(n=35) | 小肠腺癌(n=37) | P值 |
| 年龄(岁) | |||
| ≥55 | 15 | 4 | >0.05 |
| <55 | 20 | 3 | |
| 性别 | |||
| 男 | 16 | 5 | >0.05 |
| 女 | 19 | 2 | |
| 部位 | |||
| 空肠 | 35 | 6 | |
| 回肠 | - | 1 | |
| X线诊断 | |||
| 正常 | 35 | - | |
| 肿瘤 | - | 7 | |
| 病理诊断 | |||
| 正常或少量 | 35 | - | |
| 炎细胞浸润 | |||
| 腺癌 | - | 7 |
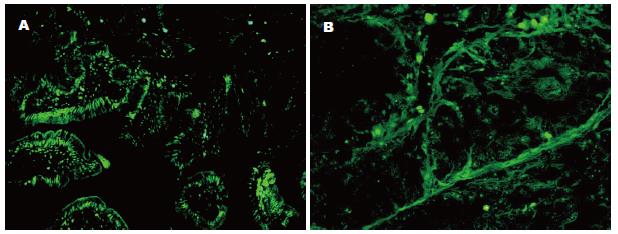
正常小肠组织的细胞凋亡指数(apoptotic index, AI)均值为15.78%, 标准差为14.04%; 小肠腺癌组织的AI均值为0.29%, 标准差为0.30%. AI在正常组织最大为49.86%, 而在腺癌组织仅为0.85%. 因此细胞凋亡水平在小肠腺癌显著低于正常小肠组织(t = 6.51, P<0.01, 图1). 在AI≥5%的正常组织中, 可见大量凋亡细胞分布于整个高倍镜视野, 包括绒毛上皮的顶部和隐窝的基底部; 在AI<5%的正常组织中, 可见凋亡细胞主要分布于绒毛的游离缘(图2A). 在小肠腺癌组织中仅见凋亡细胞稀疏的分布于不同的高倍镜视野(图2B).
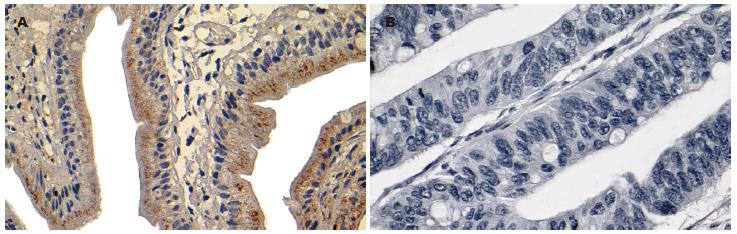
在35例正常小肠组织中, 有27例蛋白Bid表达阳性, 阳性率为77.14%(27/35); 7例小肠腺癌组织中, 有2例蛋白Bid阳性, 阳性率为28.57%(2/7). 在阳性标本中, 正常小肠有7例为强阳性表达(7/35, 20.00%), 小肠腺癌有2例为强阳性表达(2/7, 28.57%); 对于中等强度的表达, 正常小肠有18例(18/35, 51.43%), 而小肠腺癌0例. 因此, 蛋白Bid在小肠腺癌组织的表达低于正常小肠组织且存在统计学差异(P = 0.021<0.05). 但从表达强度上分析, 两组之间没有统计学差异(表2). 蛋白Bid的表达部位主要位于胞质. 在正常小肠组织中, 主要表达于绒毛上皮胞质, 尤其是游离缘表达明显, 细胞核基底部表达强度明显低于游离缘, 腺管上皮表达罕见(图3A). 在小肠腺癌中, 蛋白Bid弥散地分布于癌细胞胞质中或为阴性表达(图3B).
| 分组 | 正常小肠(n=35) | 小肠腺癌(n=37) | P值 |
| Bid | |||
| 阴性 | 8 | 5 | 0.021 |
| 弱阳性 | 2 | 0 | - |
| 中等阳性 | 18 | 0 | - |
| 强阳性 | 7 | 2 | 1.000 |
| Bcl-xL | |||
| 阴性 | 23 | 1 | 0.031 |
| 弱阳性 | 1 | 0 | - |
| 中等阳性 | 8 | 4 | 0.088 |
| 强阳性 | 3 | 2 | 0.188 |
| Bid/Bcl-xL≥1 | 28 | 1 | 0.002 |
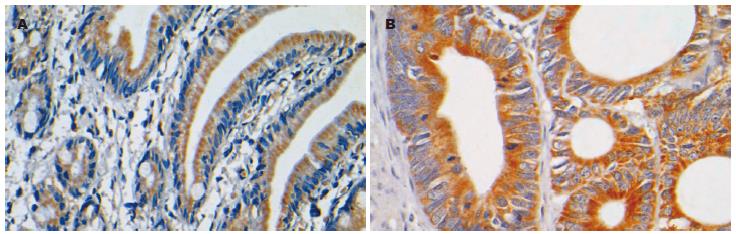
蛋白Bcl-xL在正常小肠组织中有12例阳性(12/35, 34.29%), 在小肠腺癌中有6例阳性(6/7, 86.71%). 在阳性组织中, 正常小肠组织中强阳性表的的3例(3/35, 8.57%), 腺癌组织中强阳性表达的有2例(2/7, 28.57%); 中等强度的表达组织中, 正常小肠组织有8例(8/35, 22.86%)腺癌组织有4例(4/7, 57.14%). 统计学分析显示, 蛋白Bcl-xL在小肠腺癌中的阳性率显著高于正常小肠组织, 两者之间存在统计学差异(P = 0.031<0.05). 从表达强度分析, 尽管数值上腺癌组织高于正常组织, 但统计学上缺乏差异性(表2). 蛋白Bcl-xL在正常组织中主要位于下段腺管上皮胞质和绒毛上皮游离缘胞质中, 绒毛上皮基底侧的表达强度明显低于游离缘(图4A). 在腺癌组织中, 可见蛋白Bcl-xL弥散的表达于整个胞质呈颗粒样, 且表达强度高于正常小肠组织(图4B).
Bid和Bcl-xL是作用相反的两个基因, 基于其不同作用首先比较二者在正常小肠和小肠腺癌中的表达是否存在统计学差异. 前述分析显示P值均小于0.05, 认为Bid在正常小肠组织表达阳性率高于腺癌组织, 而Bcl-xL则在腺癌组织的表达阳性率高于正常组织. 将正常小肠组织和小肠腺癌组织按Bid/Bcl-xL≥1和Bid/Bcl-xL<1分为两组. Bid/Bcl-xL≥1的样本数在正常小肠和小肠腺癌分别为28/35(80.00%)和1/7(14.29%). 根据以上数据统计学分析显示P = 0.002<0.01, 两者之间有显著性统计学差异(表2). 因此, Bid/Bcl-xL比值在正常小肠组织和小肠腺癌组织之间有统计学差异.
在小肠肿瘤中, AI与蛋白Bid的表达呈正相关(r = 0.368), 与蛋白Bcl-xL的表达不存在相关性(r = -0.103), 且蛋白Bid和Bcl-xL之间也不存在相关性.
在正常肠道组织中, 隐窝基底部含有肠道干细胞, 其不断增殖和分化产生新生的细胞, 而绒毛顶端的细胞通过凋亡脱落入肠腔, 两者之间的相互平衡维持了肠道细胞数量的恒定[10,11]. 如果细胞凋亡的速度慢于增殖速度, 则破坏肠道隐窝的正常结构并进一步引起肿瘤的发生[4]. 结直肠腺癌的发生是一个从息肉、腺瘤、腺癌渐进的过程, 在这一过程中伴随着凋亡细胞的逐渐减少[12]. 同样在胃癌的研究中也发现, 在胃黏膜不典型增生、早期胃癌到进展期胃癌的发展过程中细胞凋亡逐渐受到抑制. 不同分化程度的胃癌的细胞AI的研究发现,高分化胃癌的AI明显高于低分化者, 两者间比较有显著性差异(P<0.01)[13], 提示分化差的胃癌细胞对细胞凋亡存在逃避机制. 但目前对于小肠凋亡的研究相对较少[14], 因此本文从凋亡角度探讨小肠腺癌发生的机制.
在我们的研究中发现, 正常小肠的AI明显高于小肠腺癌: 在正常小肠AI平均值为15.78%, 最大值为49.86%; 而小肠腺癌的AI均值为0.29%, 最大值为0.85%. TUNEL阳性的细胞位于正常小肠绒毛的游离缘和隐窝的基底部, 但游离缘凋亡强度显著高于基底部. 这可能是由于正常肠道隐窝的干细胞不断分裂产生新的子代细胞, 子代细胞从隐窝的基底部向游离缘移动并分化成熟, 而衰老的细胞则通过凋亡脱落入肠腔完成小肠细胞的更新过程, 因此正常组织的凋亡主要位于小肠绒毛的游离缘. 当各种原因导致凋亡过程受阻时, 大量分化不完全细胞的过量增殖引起肿瘤的发生. 因此, 细胞凋亡的减少促进小肠腺癌的发生.
在与凋亡有关的众多蛋白研究中, Bcl-2家族受到了越来越多的重视. 该家族通过线粒体途径调控细胞的凋亡, 可以分为3类: 第一类由抑制凋亡蛋白组成, 包括Bcl-2、Bcl-xL等, 他们可以与促凋亡蛋白结合并抑制其功能; 第二类包括Bak、Bax等, 他们含有多个BH结构域, 该类蛋白通过改变线粒体外膜的通透性直接引起内源性凋亡通路; 第三类是仅含有一个BH结构域的促凋亡蛋白组成, 因此也称为BH3-only亚家族, 包括Bid、Bad等[15,16]. 促进凋亡的蛋白质可以通过与抑制凋亡的蛋白质之间形成异源二聚体直接调控细胞凋亡, 或与线粒体膜上电压依赖性的离子通道和腺苷酸转运子结合形成通透性的运输通道, 使线粒体膜电位迅速降低引起凋亡. 已有大量的研究报道该家族与结肠癌、胃癌、乳腺癌等肿瘤的发生有关[17], 但目前对于Bcl-2家族在小肠腺癌发生中的作用鲜有研究. 我们课题组的前期研究结果表明蛋白Bax在小肠腺癌低表达促进了凋亡的减少及肿瘤的发生, 但蛋白Bcl-2表达水平的升高与小肠腺癌的发生缺乏联系[18]. 近年的研究显示蛋白Bcl-xL和Bcl-2在肿瘤发生的不同阶段起作用, 且Bcl-xL的抗凋亡作用强于Bcl-2[19]. BH3-only亚家族是启动线粒体凋亡途径的必要条件, 其中蛋白Bid将内外源性的凋亡通路联系起来[20], 对于细胞凋亡有重要意义. 因此我们的研究选取蛋白Bid和Bcl-xL为研究对象, 探讨他们在小肠腺癌中的意义.
目前蛋白Bid在消化系肿瘤的研究主要集中在胃与结肠, 并且在胃癌中发现了该基因的失活性突变[21]. 在一项对TNMⅡ-Ⅲ期结肠腺癌的研究中发现, 蛋白Bid的表达强度与组织的AI呈正相关; Bid表达强度越高, 患者对化疗药物敏感性越高; Bid的表达强度越高, 患者的无瘤生存期(DFS disease free survival)和总存活数(OS overall survival)越长[23]. 国内的研究也显示蛋白Bid在结肠腺癌的表达率低于腺瘤[24]. 在我们的研究中, 蛋白Bid在小肠腺癌的表达率显著低于正常小肠组织(28.57% vs 77.14%, P = 0.021<0.05), 在正常组织主要表达于绒毛游离缘, 腺管上皮和隐窝基底部的表达明显低于游离缘. 此结果不论是从表达阳性率还是表达部位上, 都与TUNEL检测的凋亡结果相一致, 同时Spearmen相关分析也显示AI和蛋白Bid的免疫组织化学得分之间呈正相关(r = 0.368, P<0.05). 蛋白Bid在小肠腺癌的低表达降低了腺癌细胞的凋亡, 打破了肠道细胞的正常凋亡和增殖之间的平衡, 致使肿瘤细胞逃避免疫监视,在小肠腺癌的发生中具有一定作用.
蛋白Bcl-xL是Bcl-2家族中重要成员之一, 他与Bcl-2有着高度序列同源性且在多种肿瘤中共同表达, 通过调节线粒体膜的稳定性抑制凋亡的发生, 在结肠癌、食管癌、肝癌均有不同程度的表达升高. 在一项对56例结肠腺癌组织和正常对照的研究中显示, Bcl-xL在腺癌中的表达较对照显著升高, 且其表达强度与淋巴转移、Duke分期有关. 蛋白Bcl-xL主要在结肠腺癌表达, 而蛋白Bcl-2则主要是在结肠腺瘤阶段的表达, 提示蛋白Bcl-xL主要在肿瘤的晚期发挥作用[25]. 在胃癌的研究中也显示蛋白Bcl-xL在癌组织的表达显著升高[26]. 在本研究中, 蛋白Bcl-xL在小肠腺癌组织中的表达明显高于正常小肠组织(86.71% vs 34.29%, P = 0.031<0.05), 这与其在胃与结肠的研究结果类似. 但蛋白Bcl-xL的免疫组织化学得分与AI之间缺乏相关性(P>0.05). 因此, 在小肠腺癌的发生中抑制凋亡蛋白Bcl-xL表达的增加可能对于凋亡的减少并不起主要作用. 但蛋白Bcl-xL的高表达促进了结肠腺癌的发生[26], 这可能是由于在不同的组织中蛋白Bcl-xL所起的作用不同. 蛋白Bcl-xL可能主要是在结肠腺癌而不是小肠腺癌的发生中发挥作用.
在正常生理情况下, 促凋亡蛋白Bax或Bak与抑制凋亡蛋白Bcl-2或Bcl-xL结合. 在各种凋亡因素的作用下, BH3-only家族的成员与抑制凋亡蛋白Bcl-2或Bcl-xL结合, 使得促凋亡蛋白Bax或Bak游离出来, 形成同源二聚体引起凋亡的发生[27,28]. 又由于Bax/Bcl-2比值对多种细胞的凋亡起关键作用[29]. 在分子间相互作用的研究中发现Bcl-xL可以与蛋白Bid形成异源二聚体进而抑制蛋白Bid的促凋亡作用[30]. 因此我们研究Bid/Bcl-xL比值在正常小肠和小肠腺癌组织之间有无差异. 结果显示, 在正常小肠组织中Bid/Bcl-xL比值高于小肠腺癌组织(80.00% vs 14.29%, P = 0.002<0.01). 因此, 在小肠腺癌的发生中, Bid/Bcl-xL比值的降低可能促进了腺癌的发生.
在临床应用中, 蛋白Bid的表达含量或许可以作为检测小肠癌手术后化疗敏感性及判断预后的指标之一. 另外, 如果能上调肿瘤细胞蛋白Bid的表达或Bid/Bcl-xL比值, 不失为一种很好的生物治疗方法.
总之, 本研究发现细胞凋亡水平的降低、蛋白Bid的低表达和Bid/Bcl-xL比值的降低可能在小肠肿瘤的发生和发展过程中发挥重要的作用; Bid/Bcl-xL比值可能会成为小肠肿瘤发生和发展新的预测指标.尽管蛋白Bcl-xL在腺癌的表达高于正常组织, 但其表达水平与AI缺乏统计学相关性, 蛋白Bcl-xL可能在小肠腺癌的发生中不起主要作用.
目前对于消化系肿瘤的研究主要集中在胃和结肠, 对于小肠肿瘤尤其是腺癌的研究甚少. 细胞凋亡的减少对于肿瘤的发生发展有重要的意义. 因此, 本文从凋亡的角度研究小肠腺癌的可能发病机制.
施瑞华, 教授, 南京医科大学第一附属医院消化科; 朱亮, 副教授, 大连医科大学生理教研室.
在胃癌的研究中发现, 通过RNA 干扰技术将蛋白Bid的表达敲除, 结果与内外凋亡通路有关的因子表达水平均降低, 细胞在药物刺激下不再发生凋亡. 因此蛋白Bid是细胞内外凋亡通路的整合因子.
由于小肠腺癌的低发和标本来源的困难, 目前国内外对小肠腺癌发生机制的报道较少; 本文研究促凋亡蛋白Bid和抑制凋亡蛋白Bcl-xL在小肠中的表达水平, 并研究两者之间的比值Bid/Bcl-xL与腺癌组织凋亡的关系, 初步阐述小肠腺癌发生的可能机制.
由于蛋白Bid表达水平的降低与小肠腺癌凋亡指数的减少呈正相关. 因此, 通过生物学的方法上调蛋白Bid表达是促进肿瘤细胞凋亡的重要方法, 不失为化疗的一个方向.
内源性凋亡途径: 是由Bcl-2家族蛋白介导的细胞内信号凋亡通路, 导致线粒体释放细胞色素c, 进一步引起caspase9和下游caspase3/7的活化, 从而引起凋亡的产生.
本研究较全面地分析和论证了Bid和Bcl-xL表达和小肠腺癌之间的关系, 有一定的创新性, 相关结果有助于提高对小肠腺癌发生的认知水平, 并提示术后Bid和Bcl-xL免疫组织化学的病理检测, 可能对判断患者预后和指导术后化疗方案有潜在的临床借鉴意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Brueckl WM, Heinze E, Milsmann C, Wein A, Koebnick C, Jung A, Croner RS, Brabletz T, Günther K, Kirchner T. Prognostic significance of microsatellite instability in curatively resected adenocarcinoma of the small intestine. Cancer Lett. 2004;203:181-190. [PubMed] |
| 2. | Schottenfeld D, Beebe-Dimmer JL, Vigneau FD. The epidemiology and pathogenesis of neoplasia in the small intestine. Ann Epidemiol. 2009;19:58-69. [PubMed] |
| 3. | Singhal N, Singhal D. Adjuvant chemotherapy for small intestine adenocarcinoma. Cochrane Database Syst Rev. 2007;CD005202. [PubMed] |
| 4. | Cotter TG. Apoptosis and cancer: the genesis of a research field. Nat Rev Cancer. 2009;9:501-507. [PubMed] |
| 5. | Yang SY, Sales KM, Fuller B, Seifalian AM, Winslet MC. Apoptosis and colorectal cancer: implications for therapy. Trends Mol Med. 2009;15:225-233. [PubMed] |
| 6. | Yu J, Zhang L. Apoptosis in human cancer cells. Curr Opin Oncol. 2004;16:19-24. [PubMed] |
| 7. | Lomonosova E, Chinnadurai G. BH3-only proteins in apoptosis and beyond: an overview. Oncogene. 2008;27 Suppl 1:S2-S19. [PubMed] |
| 8. | Giam M, Huang DC, Bouillet P. BH3-only proteins and their roles in programmed cell death. Oncogene. 2008;27 Suppl 1:S128-S136. [PubMed] |
| 9. | Fernandez-Luna JL. Regulation of pro-apoptotic BH3-only proteins and its contribution to cancer progression and chemoresistance. Cell Signal. 2008;20:1921-1926. [PubMed] |
| 10. | Leedham SJ, Wright NA. Expansion of a mutated clone: from stem cell to tumour. J Clin Pathol. 2008;61:164-171. [PubMed] |
| 11. | Rajagopalan H, Nowak MA, Vogelstein B, Lengauer C. The significance of unstable chromosomes in colorectal cancer. Nat Rev Cancer. 2003;3:695-701. [PubMed] |
| 12. | Watson AJ, Pritchard DM. Lessons from genetically engineered animal models. VII. Apoptosis in intestinal epithelium: lessons from transgenic and knockout mice. Am J Physiol Gastrointest Liver Physiol. 2000;278:G1-G5. [PubMed] |
| 13. | Aurello P, Bellagamba R, Rossi Del Monte S, D'Angelo F, Nigri G, Cicchini C, Ravaioli M, Ramacciato G. Apoptosis and microvessel density in gastric cancer: correlation with tumor stage and prognosis. Am Surg. 2009;75:1183-1188. [PubMed] |
| 14. | Keefe DM, Brealey J, Goland GJ, Cummins AG. Chemotherapy for cancer causes apoptosis that precedes hypoplasia in crypts of the small intestine in humans. Gut. 2000;47:632-637. [PubMed] |
| 15. | Brunelle JK, Letai A. Control of mitochondrial apoptosis by the Bcl-2 family. J Cell Sci. 2009;122:437-441. [PubMed] |
| 16. | Chipuk JE, Fisher JC, Dillon CP, Kriwacki RW, Kuwana T, Green DR. Mechanism of apoptosis induction by inhibition of the anti-apoptotic BCL-2 proteins. Proc Natl Acad Sci U S A. 2008;105:20327-20332. [PubMed] |
| 18. | Gao C, Wang AY. Significance of increased apoptosis and Bax expression in human small intestinal adenocarcinoma. J Histochem Cytochem. 2009;57:1139-1148. [PubMed] |
| 19. | Han HS, Park YM, Hwang TS. Differential expression of Bcl-2, Bcl-XL and p53 in colorectal cancer. J Gastroenterol Hepatol. 2006;21:1108-1114. [PubMed] |
| 20. | Cory S, Huang DC, Adams JM. The Bcl-2 family: roles in cell survival and oncogenesis. Oncogene. 2003;22:8590-8607. [PubMed] |
| 21. | Lee JH, Soung YH, Lee JW, Park WS, Kim SY, Cho YG, Kim CJ, Seo SH, Kim HS, Nam SW. Inactivating mutation of the pro-apoptotic gene BID in gastric cancer. J Pathol. 2004;202:439-445. [PubMed] |
| 22. | Zhao Y, Li R, Xia W, Neuzil J, Lu Y, Zhang H, Zhao X, Zhang X, Sun C, Wu K. Bid integrates intrinsic and extrinsic signaling in apoptosis induced by alpha-tocopheryl succinate in human gastric carcinoma cells. Cancer Lett. 2010;288:42-49. [PubMed] |
| 23. | Sinicrope FA, Rego RL, Foster NR, Thibodeau SN, Alberts SR, Windschitl HE, Sargent DJ. Proapoptotic Bad and Bid protein expression predict survival in stages II and III colon cancers. Clin Cancer Res. 2008;14:4128-4133. [PubMed] |
| 25. | Zhang YL, Pang LQ, Wu Y, Wang XY, Wang CQ, Fan Y. Significance of Bcl-xL in human colon carcinoma. World J Gastroenterol. 2008;14:3069-3073. [PubMed] |
| 26. | Smith L, Berrieman HK, O'Kane SL, Campbell A, Maraveyas A, Cawkwell L. Immunohistochemical detection of apoptotic markers in gastric cancer. Oncol Res. 2006;15:441-444. [PubMed] |
| 27. | Willis SN, Chen L, Dewson G, Wei A, Naik E, Fletcher JI, Adams JM, Huang DC. Proapoptotic Bak is sequestered by Mcl-1 and Bcl-xL, but not Bcl-2, until displaced by BH3-only proteins. Genes Dev. 2005;19:1294-1305. [PubMed] |
| 28. | Willis SN, Fletcher JI, Kaufmann T, van Delft MF, Chen L, Czabotar PE, Ierino H, Lee EF, Fairlie WD, Bouillet P. Apoptosis initiated when BH3 ligands engage multiple Bcl-2 homologs, not Bax or Bak. Science. 2007;315:856-859. [PubMed] |
| 29. | Lalier L, Cartron PF, Juin P, Nedelkina S, Manon S, Bechinger B, Vallette FM. Bax activation and mitochondrial insertion during apoptosis. Apoptosis. 2007;12:887-896. [PubMed] |
| 30. | García-Sáez AJ, Ries J, Orzáez M, Pérez-Payà E, Schwille P. Membrane promotes tBID interaction with BCL(XL). Nat Struct Mol Biol. 2009;16:1178-1185. [PubMed] |