修回日期: 2010-03-22
接受日期: 2010-03-29
在线出版日期: 2010-04-18
目的: 建立稳定表达HBx基因缺失突变体(HBx-d382)的L02肝细胞株, 并探讨其对L02细胞增殖的影响.
方法: 含HBx-d382重组质粒(pcDNA3.0/HBx-d382)经过PCR扩增、双酶切及测序鉴定后, 通过脂质体转染和G418筛选获得稳定表达HBx-d382的L02肝细胞株. PCR鉴定基因组中HBx-d382基因整合. RT-PCR和Western blot鉴定其表达, 进一步通过MTT法, 软琼脂克隆形成实验检测HBx-d382对L02细胞增殖及非锚定依赖生长能力的影响. 用流式细胞仪检测其对细胞周期的影响.
结果: 经PCR扩增、双酶切及测序鉴定HBx-d382重组质粒构建正确. 稳定转染该质粒的L02细胞基因组存在HBx-d382整合. RT-PCR及Western blot表明在RNA水平和蛋白水平存在HBx-d382表达, 稳定表达HBx-d382的L02细胞其增殖能力和非锚定生长能力增强, S+G2期细胞比例升高.
结论: 成功构建了HBx缺失突变体的真核表达模型, 证实HBx缺失突变体能影响细胞增殖, 这种效应可能与其影响细胞周期调控相关.
引文著录: 胡志亮, 谭德明, 侯周华, 谢萍, 刘国珍, 欧阳奕, 刘菲, 刘洪波. HBx基因缺失突变体HBx-d382对L02细胞增殖及非锚定依赖生长能力的影响. 世界华人消化杂志 2010; 18(11): 1109-1114
Revised: March 22, 2010
Accepted: March 29, 2010
Published online: April 18, 2010
AIM: To establish a L02 cell line stably expressing HBx gene deletion mutant (HBx-d382) and to examine their proliferation changes.
METHODS: A recombinant plasmid encoding the HBx deletion mutant (pcDNA3.0/HBx-d382) was verified by PCR amplification, double restriction digestion and DNA sequencing, and then introduced into L02 cells by liposome-mediated transfection. Positive clones were selected in the present of G418. The genome integration of the HBx gene deletion mutant was confirmed by PCR amplification, and the expression of the deletion mutant was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot. Cell proliferation changes were measured by methyl thiazol tetrazolium (MTT) assay and soft agar colony formation assay. The cell cycle distribution was tested by flow cytometry.
RESULTS: The recombinant plasmid pcDNA3.0/HBx-d382 was verified to contain HBx-d382 by PCR amplification, double digestion and DNA sequencing. Positive clones selected with G418 harbored chromosomally integrated HBx-d382 and could express HBx-d382. This cell line showed enhanced proliferation and anchorage-independent growth as revealed by MTT assay and soft agar colony formation assay. The percentage of cells in S and G2 phases increased in transfected cell line.
CONCLUSION: L02 cell line stably expressing the HBx deletion mutant is established successfully. The proliferation ability of this cell line increases probably due to altered cell cycle.
- Citation: Hu ZL, Tan DM, Hou ZH, Xie P, Liu GZ, Ouyang Y, Liu F, Liu HB. HBx gene deletion mutant (HBx-d382) enhances the proliferation and anchorage-independent growth of L02 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1109-1114
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1109
原发性肝细胞癌是世界上最常见的恶性肿瘤之一, HBV慢性感染是导致肝癌的最常见原因, HBV携带者肝癌的发病率是正常人群的25-37倍[1,2], 而对HBV肝癌发生发展的机制仍未完全阐明. 在HBV所编码的蛋白中, 约17 kDa大小的HBx被认为和肝癌密切相关[3]. 一些研究发现, HBV感染的肝癌患者中存在HBx基因的整合及突变, 并认为HBx基因-COOH某些缺失突变体与肝细胞癌相关[4-6]. 我们前期的研究发现在肝癌组织中HBx基因nt 382-400缺失突变(HBx-d382)发生率较高, 可能与慢性乙型肝炎感染后肝癌高发有关[7]. 为研究HBx-d382缺失突变体的意义, 本实验将检测表达HBx缺失突变体(HBx-d382)或野生型HBx的L02细胞细胞增殖的改变, 进一步研究其致肝细胞恶性转化的机制.
含有质粒pcDNA3.0、重组质粒pcDNA3.0/HBx-d382(HBx基因nt 382-400缺失)和pcDNA3.0/HBx(重组HBx基因片段来自于肝癌细胞株HepG2.215)的细菌DH5α由我室保存; 人肝细胞株(L02)购自中科院上海细胞生物学研究所细胞库; 胎牛血清、RPMI Medium 1640培养基(Gibco); Lipofectamine 2000、TRIzol REAGENT(美国Invitrogen); 无内毒素质粒大提试剂盒、基因组提取试剂盒(北京天根公司); 逆转录试剂盒、核酸内切酶KpnⅠ和ApaⅠ(Fermentas); 细胞周期检测试剂盒(南京, 凯基); ECL+显色试剂盒(GE); 兔抗HBx多克隆抗体(英国, Abcam)、鼠抗β-actin单克隆抗体(美国, Sigma).
1.2.1 细菌培养, 质粒提取与鉴定: 取-70 ℃保存菌种, 用细菌接种环沾取少量菌液, 接种于含氨苄青霉素(100 mg/L)的LB平板培养基上, 挑选单个菌落增菌培养, 收集细菌沉淀, 提取质粒, 质粒的提取按照试剂盒说明书进行, 提取的质粒用KpnⅠ和ApaⅠ双酶切鉴定; 并用HBx基因特异性引物HBx-F: 5'-AAGGTACCATGGCTGCTAGGCTGTGCT-3', HBx-R: 5'-CTGGGCCCTTAGGCAGAGGTGAAAAAGTTG-3'进行PCR反应, 扩增目的片段, 并将质粒送上海申友公司进行DNA序列测定.
1.2.2 细胞转染和稳定细胞株的筛选: 质粒鉴定成功后按照Lipofectamine 2000说明书进行转染操作, 参照文献[8], 以500 mg/L G418维持培养2 wk后挑选抗性克隆, 扩大培养后以250 mg/L G418维持筛选, 以获得稳定表达HBx基因的细胞株, 分别命名为L02/HBx-d382(转染质粒pcDNA3.0/HBx-d382)和L02/HBx(转染质粒pcDNA3.0/HBx), 稳定转染pcDNA3.0的细胞株命名为L02/pcDNA3.0.
1.2.3 转染后细胞株HBx基因整合及表达的鉴定: 细胞基因组DNA的提取按照基因组提取试剂盒说明书进行; 细胞总RNA的提取按照TRIzol说明书进行, 用无RNA酶Dnase处理后, 通过Oligo(dT)18引物合成cDNA, 操作按照说明书进行. 以基因组DNA和合成的cDNA为模板, 用HBx特异性引物HBx-F和HBx-R扩增目的基因, 同时以β-actin用来作为内参照. PCR反应产物经1.5%琼脂糖凝胶电泳后置于紫外灯下观察. RIPA裂解细胞, 离心后收集上清, 30 µg的总蛋白用于15% SDS-PAGE电泳, 半干转印于PVDF膜上, 用50 g/L脱脂奶粉室温封闭1 h, 分别加入HBx抗体(1:1 500), β-actin抗体(1:100 000), 4 ℃孵育过夜, 洗膜后根据一抗来源加入相应二抗室温孵育1 h, ECL显色试剂盒显影, 将β-actin作内参照[9].
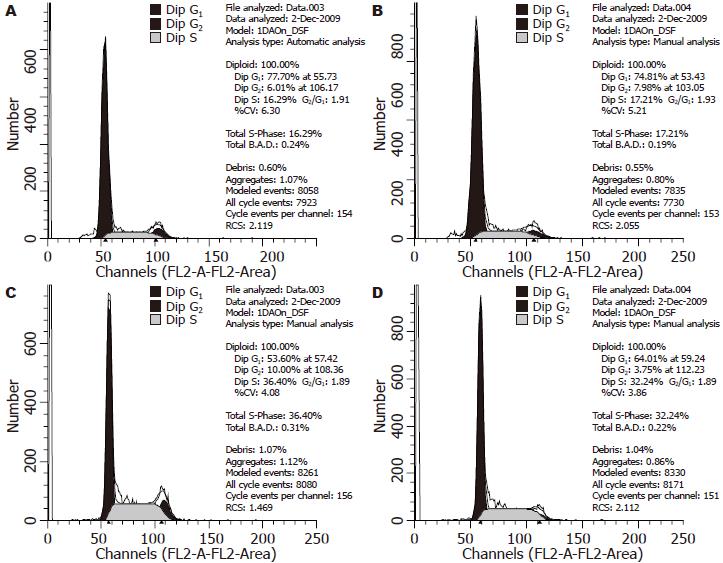
1.2.4 细胞周期检测[10]: 实验分为L02细胞组, L02/pcDNA3.0细胞组, L02/HBx-d382细胞组和L02/HBx细胞组, 细胞接种于6孔培养板, 待细胞长至对数生长期, 收集细胞, 用PBS洗涤2次, 700 mL/L乙醇4 ℃固定过夜, 取出离心收集细胞, PBS洗涤2次, 加入RNase A 37孵育30 min, 再加入碘化丙锭染色, 采用流式细胞仪检测细胞周期.
1.2.5 MTT检测细胞增殖: 操作参照文献[10,11], 略加修改, 各组细胞接种于96孔板, 每孔接种2×103个细胞, 培养24 h后吸弃上清, 加入200 μL含0.5 g/L MTT的Opti-MEM I Reduced Serum Medium, 4 h吸弃上清, 加入150 μL DMSO, 摇匀10 min后酶联免疫检测仪测定572 nm处吸光值, 连续检测6 d, 以时间为横轴, 吸光值为纵轴绘制细胞生长曲线.
1.2.5 软琼脂克隆形成实验: 操作参照文献[12], 略加修改, 将5×103个细胞加入2 mL含3 g/L琼脂, 100 mL/L胎牛血清的RPMI Medium 1640培养基中, 充分混匀后, 将细胞悬液加入6孔板中已凝固的5 g/L琼脂培养基(含100 mL/L胎牛血清的RPMI Medium 1640培养基)上面, 培养2 wk后取出培养板, 每组细胞随机选取10个低倍视野, 镜下计数形成的细胞克隆数.
统计学处理 所有数据以mean±SD表示, 组间比较采用LSD-t检验, 用SPSS16.0统计软件进行统计分析, 以P<0.05为有统计学意义.
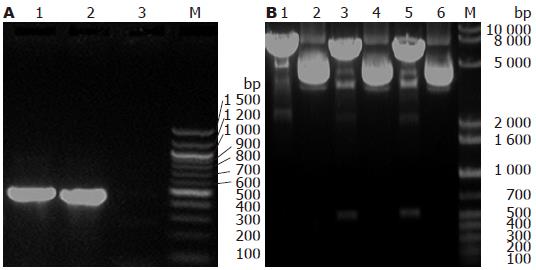
以HBx基因重组质粒为模板, 用HBx基因特异性引物PCR扩增, 经15 g/L的琼脂糖凝胶电泳, 可以一约500 bp的条带, 而pcDNA3.0质粒未见特异条带(图1A). 经提取的质粒用用KpnⅠ和ApaⅠ双酶切后, 超螺旋pcDNA3.0被切成约5.4 kb线性DNA, pcDNA3.0/HBx-d382和pcDNA3.0/HBx重组质粒用KpnⅠ和ApaⅠ双酶切后, 经0.8%琼脂糖凝胶电泳, 可见约5.4 kb的片段和约500 bp的目的基因片段(图1B). DNA测序证实为质粒构建正确.
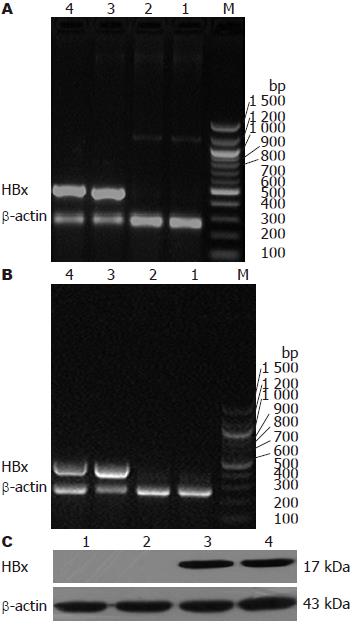
转染pcDNA3.0/HBx-d382、pcDNA3.0/HBx与pCDNA3.0的L02细胞基因组DNA经PCR扩增和15 g/L琼脂糖凝胶电泳后, 在约500 bp处出现一特异性条带, 与预期大小片段一致. 而转染空质粒pCDNA3和未转染质粒的L02细胞基因组DNA经PCR扩增和15 g/L琼脂糖凝胶电泳后, 未见特异性片段(图2A). 提取上述L02细胞mRNA经过RT-PCR扩增, 可见特异性目的片段(图2B), Western blot可见HBx蛋白表达(图2C).
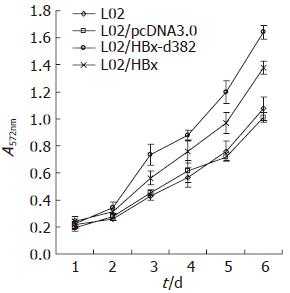
MTT结果显示L02细胞以及转染空载体pcDNA3.0质粒细胞L02/pcDNA3.0的增殖无明显差异性. 在细胞培养的前2 d, 各组细胞的增殖差异性并不明显, 从第3天开始转染HBx基因缺失突变体的细胞L02/HBx-d382(P = 0.03)和转染野生型HBx基因的细胞L02/HBx(P = 0.02)的增殖能力相对L02细胞和L02/pcDNA3.0细胞增强; 且L02/HBx-d382的增殖能力强于L02/HBx(P = 0.004, 图3).
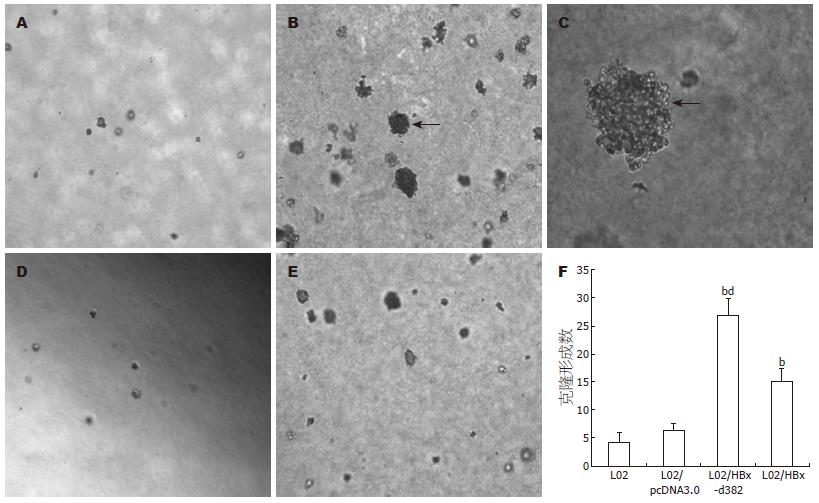
L02、L02/pcDNA3.0、L02/HBx-d382和L02/HBx组细胞在软琼脂中生长约1 wk可以看见克隆形成, 培养2 wk后置于显微镜下观察, L02/HBx-d382组和L02/HBx组的克隆形成率明显高于L02组和L02/pcDNA3.0组(P<0.01), 且L02/HBx-d382组高于LO2/HBx(P<0.01), 而L02组和L02/pcDNA3.0组克隆形成率无明显差别(图4).
在许多HBV慢性感染的肝组织基因组DNA中存在HBV基因的整合, 虽然整合对于病毒复制不是必需的, 但HBV DNA的整合往往导致其基因组逃避免疫反应, 成为HBV持续感染因素之一[13,14], 同时HBV DNA的整合也能导致基因组DNA的不稳定性从而导致肝细胞恶性转化[15,16]. 在众多整合的病毒亚单位中, HBx基因可以转录出17 kDa的HBx蛋白, 其与肝癌的关系被广泛研究, 一些研究认为HBx广泛影响着细胞的增殖、凋亡、有丝分裂纺锤体形成以及信号转导并可导致细胞恶性转化[3,8,17-20], 但其确切机制仍未完全阐明.
慢性HBV感染者众多, 但其发展为肝癌的几率并不高, 一些研究认为HBx单独可能并不导致肝细胞恶性转化, 他需要某些癌基因如H-ras、c-myc、p53共同作用才能导致细胞恶性转化[21-25], HBx与肝癌的关系仍然存在许多争议, 其确切机制有待进一步阐明.
先前的研究发现, 肝癌组织中HBx基因变异特别是一些HBx基因-COOH端的缺失突变体变异频发[4,5,26,27], 来源于肝癌组织的一些HBx基因-COOH端的缺失突变体以及人工构建的不同HBx缺失突变体和野生型HBx具有不同的生物学效应[5,27-29], 因此我们推测某些HBx基因突变可能与肝癌的发生发展相关. 我们前期研究也发现在肝癌组织的基因组中广泛存在HBx基因突变体的整合, 并筛选出2个缺失突变体HBx-d382和HBx-d431, 其中HBx-d382在肝癌组织中检出率较高, 我们猜想HBx基因某些突变可能与肝细胞癌密切相关[7]. 随后我们成功构建了HBx-d382真核表达载体pcDNA3.0/ HBx-d382[30], 为了进一步探讨HBx缺失突变体对细胞生物学活性的影响, 本研究用脂质体转染目的基因, 通过G418筛选, 提取转染前后细胞的基因组DNA总RNA以及细胞总蛋白, 分别通过PCR、RT-PCR以及蛋白免疫印迹技术验证基因组中存在目的基因(HBx-d382以及野生型HBx)的整合、RNA水平存在目的基因的表达同时能检测到相关蛋白.
进一步研究发现, 稳定表达HBx的L02细胞相比转染空载体pcDNA3.0以及未转染质粒的L02细胞其增殖能力明显增强, 克隆形成能力增强, 且HBx缺失突变体的引起的改变要强于野生型HBx, 而L02细胞和未转染质粒的L02细胞差异性不明显. 我们推测HBx-d382可能更能影响细胞的增殖, 导致细胞的恶性转化. 各组细胞细胞周期的观察也发现稳定转染HBx的L02细胞(S+G2)期细胞比例明显高于未转染质粒和转染空质粒pcDNA3.0的L02细胞, 这种效应以HBx基因缺失突变体更加明显. 结果提示HBx基因及其缺失突变体可能有助于推动细胞从G0/G1期进入S期从而导致细胞增殖增强.
虽然在实验中我们发现HBx缺失突变体相比野生型HBx更能影响细胞增殖, 但其确切机制尚不清楚, 是否HBx缺失突变体影响细胞周期调控的相关基因如E2F1、cyclin D等表达, 或许HBx基因缺失突变体改变了调控细胞增殖相关miRNA的表达, 需要进一步的研究.
总之, 我们成功构建了HBx基因缺失突变体(HBx-d382)的真核表达模型, 证实HBx-d382相比野生型HBx更能影响L02细胞增殖, 这种效应可能与其影响细胞周期调控相关. 该研究支持HBx基因突变可能导致肝细胞恶性转化的假说.
乙型肝炎病毒(HBV)慢性感染是肝癌发生的主要危险因素, 既往的研究表明, 几乎所有HBV相关的肝癌组织中可以检测到基因组整合的HBV DNA, 在众多病毒基因组整合亚单位中HBx基因可以转录并翻译成相应HBx蛋白; HBx蛋白是一种多功能蛋白质, 参与调节基因转录、细胞信号传导、控制细胞增殖和凋亡, 其对肝细胞的分子生物学特性影响被广泛研究.
管世鹤, 副教授, 安徽医科大学第一附属医院检验科.
在肝癌组织中或是肝癌患者血清中可以检测到自然发生的HBx变异, 一些研究认为HBx突变特别是-COOH的缺失突变体和野生型HBx具有不同的生物学效应, 可能参与肝细胞的恶性转化.
前期研究发现中国南部地区肝癌组织中HBx基因存在着多种类型缺失型突变和点突变, 其中HBx基因缺失突变体HBx-d382发生率较高, 但其肝细胞生物学特性的影响尚不明确. 本研究建立稳定表达HBx-d382或野生型HBx的L02细胞株, 检测其对L02细胞增殖和非锚定依赖增殖能力的影响, 为进一步探讨肝细胞癌发生的分子机制打下基础.
本研究表明HBx-d382比野生型HBx具有更强的促细胞增殖能力及非锚定依赖增殖能力, 进一步论证了HBx-d382与肝癌发生有着密切关系, 对HBx-d382更深一步的研究提供依据.
本文做出一定的工作, 对今后研究有帮助.
编辑: 李军亮 电编:何基才
| 1. | Hassan MM, Hwang LY, Hatten CJ, Swaim M, Li D, Abbruzzese JL, Beasley P, Patt YZ. Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology. 2002;36:1206-1213. [PubMed] |
| 2. | Geier A, Gartung C, Dietrich CG. Hepatitis B e Antigen and the Risk of Hepatocellular Carcinoma. N Engl J Med. 2002;347:1721-1722; author reply 1721-1722. [PubMed] |
| 3. | Koike K. Hepatitis B virus X gene is implicated in liver carcinogenesis. Cancer Lett. 2009;286:60-68. [PubMed] |
| 4. | Liu XH, Lin J, Zhang SH, Zhang SM, Feitelson MA, Gao HJ, Zhu MH. COOH-terminal deletion of HBx gene is a frequent event in HBV-associated hepatocellular carcinoma. World J Gastroenterol. 2008;14:1346-1352. [PubMed] |
| 5. | Ma NF, Lau SH, Hu L, Xie D, Wu J, Yang J, Wang Y, Wu MC, Fung J, Bai X. COOH-terminal truncated HBV X protein plays key role in hepatocarcinogenesis. Clin Cancer Res. 2008;14:5061-5068. [PubMed] |
| 6. | Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, Paterlini-Bréchot P, Bréchot C, Kremsdorf D. Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues. Cancer Res. 2001;61:7803-7810. [PubMed] |
| 7. | Zhu P, Tan D, Peng Z, Liu F, Song L. Polymorphism analyses of hepatitis B virus X gene in hepatocellular carcinoma patients from southern China. Acta Biochim Biophys Sin (Shanghai). 2007;39:265-272. [PubMed] |
| 10. | 张 红燕, 李 珊珊, 孙 洋, 王 新华, 阎 爱华, 王 小军. TGF-β1反义寡核苷酸对食管鳞癌细胞EC9706增殖及凋亡的影响. 世界华人消化杂志. 2009;17:3480-3485. [DOI] |
| 13. | Brechot C, Pourcel C, Louise A, Rain B, Tiollais P. Presence of integrated hepatitis B virus DNA sequences in cellular DNA of human hepatocellular carcinoma. Nature. 1980;286:533-535. [PubMed] |
| 14. | Beasley RP, Hwang LY, Lin CC, Chien CS. Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22 707 men in Taiwan. Lancet. 1981;2:1129-1133. [PubMed] |
| 15. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] |
| 16. | Minami M, Daimon Y, Mori K, Takashima H, Nakajima T, Itoh Y, Okanoue T. Hepatitis B virus-related insertional mutagenesis in chronic hepatitis B patients as an early drastic genetic change leading to hepatocarcinogenesis. Oncogene. 2005;24:4340-4348. [PubMed] |
| 17. | Zhang WY, Cai N, Ye LH, Zhang XD. Transformation of human liver L-O2 cells mediated by stable HBx transfection. Acta Pharmacol Sin. 2009;30:1153-1161. [PubMed] |
| 18. | Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007;13:74-81. [PubMed] |
| 19. | Zhang JL, Zhao WG, Wu KL, Wang K, Zhang X, Gu CF, Li Y, Zhu Y, Wu JG. Human hepatitis B virus X protein promotes cell proliferation and inhibits cell apoptosis through interacting with a serine protease Hepsin. Arch Virol. 2005;150:721-741. [PubMed] |
| 20. | Kim HJ, Kim SY, Kim J, Lee H, Choi M, Kim JK, Ahn JK. Hepatitis B virus X protein induces apoptosis by enhancing translocation of Bax to mitochondria. IUBMB Life. 2008;60:473-480. [PubMed] |
| 21. | Hussain SP, Schwank J, Staib F, Wang XW, Harris CC. TP53 mutations and hepatocellular carcinoma: insights into the etiology and pathogenesis of liver cancer. Oncogene. 2007;26:2166-2176. [PubMed] |
| 22. | Terradillos O, Billet O, Renard CA, Levy R, Molina T, Briand P, Buendia MA. The hepatitis B virus X gene potentiates c-myc-induced liver oncogenesis in transgenic mice. Oncogene. 1997;14:395-404. [PubMed] |
| 23. | Kim YC, Song KS, Yoon G, Nam MJ, Ryu WS. Activated ras oncogene collaborates with HBx gene of hepatitis B virus to transform cells by suppressing HBx-mediated apoptosis. Oncogene. 2001;20:16-23. [PubMed] |
| 24. | Jiang W, Wang XW, Unger T, Forgues M, Kim JW, Hussain SP, Bowman E, Spillare EA, Lipsky MM, Meck JM. Cooperation of tumor-derived HBx mutants and p53-249(ser) mutant in regulating cell proliferation, anchorage-independent growth and aneuploidy in a telomerase-immortalized normal human hepatocyte-derived cell line. Int J Cancer. 2009; Dec 16. [Epub ahead of print]. [PubMed] |
| 25. | Wang XW, Hussain SP, Huo TI, Wu CG, Forgues M, Hofseth LJ, Brechot C, Harris CC. Molecular pathogenesis of human hepatocellular carcinoma. Toxicology. 2002;181-182:43-47. [PubMed] |
| 26. | Kwun HJ, Jang KL. Natural variants of hepatitis B virus X protein have differential effects on the expression of cyclin-dependent kinase inhibitor p21 gene. Nucleic Acids Res. 2004;32:2202-2213. [PubMed] |
| 27. | Wang Y, Lau SH, Sham JS, Wu MC, Wang T, Guan XY. Characterization of HBV integrants in 14 hepatocellular carcinomas: association of truncated X gene and hepatocellular carcinogenesis. Oncogene. 2004;23:142-148. [PubMed] |
| 28. | Liu X, Zhang S, Lin J, Zhang S, Feitelson MA, Gao H, Zhu M. Hepatitis B virus X protein mutants exhibit distinct biological activities in hepatoma Huh7 cells. Biochem Biophys Res Commun. 2008;373:643-647. [PubMed] |
| 29. | Zhang H, Shan CL, Li N, Zhang X, Zhang XZ, Xu FQ, Zhang S, Qiu LY, Ye LH, Zhang XD. Identification of a natural mutant of HBV X protein truncated 27 amino acids at the COOH terminal and its effect on liver cell proliferation. Acta Pharmacol Sin. 2008;29:473-480. [PubMed] |