修回日期: 2010-03-16
接受日期: 2010-03-23
在线出版日期: 2010-04-18
目的: 研究骨桥蛋白(OPN)及纤溶酶原激活物抑制物(PAI-1)的表达特征及其在肝纤维化时的变化.
方法: 采用二甲基亚硝胺制作大鼠肝纤维化模型. 大鼠肝脏常规HE和天狼猩红染色. 采用SABC法作免疫组织化学染色及Western blot检测OPN和PAI-1蛋白表达; RT-PCR法检测OPN基因表达; 检测结果采用计算机图像定量分析系统, 扫描并计算染色阳性区域面积和阳性比率或条带的吸光度值.
结果: 正常大鼠肝组织OPN和PAI-1表达极弱, 肝纤维化大鼠肝脏中OPN表达增强, 阳性信号散在或弥漫性分布, 主要见于小叶内中央静脉周围、纤维间隔内以及周围巨噬细胞胞质, 库普弗细胞, 门管区的部分肝细胞, 肝窦壁内皮细胞. PAI-1在肝纤维化大鼠肝组织汇管区、肝细胞变性坏死处, 肝窦周Disse间隙及毗邻以上部位的肝细胞, 组织纤维间隔处及其外周细胞亦见阳性染色. Western blot检测正常大鼠肝脏OPN的蛋白表达极低, 肝纤维化组OPN的蛋白表达较正常组显著增强(1.0907±0.2082 vs 0.0673±0.0663, P<0.01). 与正常组比, 肝纤维化组PAI-1表达也显著增强(1.1407±0.3094 vs 0.2464±0.2234, P<0.01). RT-PCR检测结果显示, 正常大鼠肝脏OPN mRNA表达极低, 肝纤维化大鼠肝脏OPN mRNA的表达明显增强(0.2128±0.0527 vs 0.1298±0.0316, P<0.05).
结论: OPN及PAI-1的表达与肝纤维化密切相关, 肝纤维化时大鼠肝组织OPN及PAI-1的表达水平显著增高, OPN可能会促进PAI-1的高表达, 从而抑制细胞外基质(ECM)降解、加速肝纤维化进程.
引文著录: 张斌, 赵莹, 陈建杰, 王灵台. OPN和PAI-1在肝纤维化时的表达特征. 世界华人消化杂志 2010; 18(11): 1104-1108
Revised: March 16, 2010
Accepted: March 23, 2010
Published online: April 18, 2010
AIM: To investigate the expression of osteopontin (OPN) and plasminogen activator inhibitor type 1 (PAI-1) in dimethylnitrosamine (DMN)-induced hepatic fibrosis in rats.
METHODS: Liver fibrosis was induced in rats by intraperitoneal injection of DMN. All rats were sacrificed to take liver tissue specimens. Formalin-fixed liver sections were stained with hematoxylin and eosin (HE) and Sirius Red to evaluate general histology and hepatic fibrosis, respectively. The expression of OPN and PAI-1 proteins was detected by immunohistochemistry and Western blot. The expression of OPN mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR). Computerized image analysis system was then used for quantification.
RESULTS: Immunohistochemical staining showed that the expression of OPN and PAI-1 increased dramatically in fibrotic rat liver when compared with normal rat liver. OPN-positive signals were scattered or diffused around the central veins, and in fibrous septum and adjacent macrophages, Kupffer cells, some hepatic cells in the portal area, and liver sinusoidal endothelial cells. The expression of PAI-1 was distributed in the portal areas, degenerative and necrotic hepatic cells, the space of Disse and adjacent hepatic cells, fibrous septum and adjacent cells. Western blot analysis showed that the expression of OPN and PAI-1 increased obviously in fibrotic rat liver (1.0907 ± 0.2082 vs 0.0673 ± 0.0663 and 1.1407 ± 0.3094 vs 0.2464 ± 0.2234, respectively; both P < 0.01). RT-PCR analysis showed that the expression of OPN mRNA was also significantly enhanced in fibrotic rat liver (0.2128 ± 0.0527 vs 0.1298 ± 0.0316, P < 0.05).
CONCLUSION: The expression of OPN is closely correlated with that of PAI-1 during hepatic fibrosis. The expression of OPN and PAI-1 is significantly up-regulated in rat hepatic fibrosis. OPN may promote the high expression of PAI-1, inhibit extracellular matrix degradation, and accelerate fibrosis progression.
- Citation: Zhang B, Zhao Y, Chen JJ, Wang LT. Expression characteristics of OPN and PAI-1 in rat liver fibrosis. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1104-1108
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1104.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1104
肝纤维化是肝脏对慢性损伤的一种修复反应, 是慢性肝病的共有病理改变, 肝内细胞外基质(extracellular matrix, ECM)的过多沉积为其特征性改变. 骨桥蛋白(osteopontin, OPN)作为ECM的非胶原糖蛋白组分, 在肝纤维化过程的作用受到学者的重视. 纤溶系统(PA和PAI)属于丝氨酸蛋白酶类, 与ECM的降解密切相关, 本文拟从此角度研究OPN及纤溶酶原激活物抑制物(plasminogen activator inhibitor type 1, PAI-1)表达特征及在肝纤维化时的作用.
Wistar♂大鼠35只, 清洁级, 体质量150 g±10 g, 中科院上海实验动物中心提供. 二甲基亚硝胺(DMN, 东京化成工业株式会社产品). 小鼠抗大鼠OPN抗体、兔抗大鼠PAI-1抗体、兔抗大鼠GAPDH(SC-25778)抗体为美国Santa Cruz公司产品, SABC免疫组织化学即用型染色试剂盒及DAB染色试剂盒, 购于武汉博士德公司, BCATM Protein-Assay-Kit美国PIERCE产品, ECL Plus Western Blotting Detection Reagent美国GE Healthcare offices产品. cDNA逆转录试剂盒及PCR×MIX试剂盒为Fermentas产品.
1.2.1 分组及处理: 将大鼠随机分为正常对照组和肝纤维化模型组(DMN组), 模型组从造模第1周起, 每周1, 2, 3连续三天腹腔注射0.5% DMN 0.2 mL/100 g体质量, 每日1次, 共注射3 wk, 稳定1 wk.
1.2.2 OPN、PAI-1免疫组织化学检测: 大鼠肝脏石蜡包埋块4 µm连续切片, 采用SABC法作免疫组织化学染色, 一抗分别为OPN抗体(工作浓度1:800)和PAI-1抗体(工作浓度1:200), 阴性对照以PBS替代一抗, 阳性细胞为胞质着色. 染色结果采用MIQAS医学图像定量分析系统, 测量并计算阳性区域面积和阳性比率以及吸光度值.
1.2.3 Western blot检测: 取100 mg湿肝冰浴中匀浆, 移入含10 µL PMSF的管中离心, 取上清液测总蛋白量, 保持样品蛋白质等量上样、电泳. 电泳后将凝胶取出, 电转移至硝酸纤维素膜, 经洗膜、封闭后, 加入一抗的工作液, 4 ℃轻摇过夜, TBST洗膜后, 加二抗的工作液, 室温振荡60 min, TBST洗膜后, 按Amersham ECL Plus检测试剂盒操作, 转印膜用感光胶片显影, 显影后可见特异性靶条带, 用图像分析软件扫描并测定吸光度值.
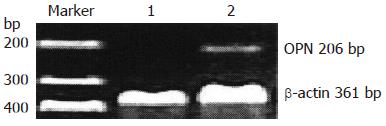
1.2.4 RT-PCR检测: 采用TRIzol试剂方法抽提肝组织总RNA, 提取的总RNA用蛋白质核酸分析系统进行定量, 测定A260/A280≥1.8. RT-PCR检测目的基因及内参照β-actin引物由上海赛百盛生物技术有限责任公司设计并合成(表1). RNA逆转录合成cDNA根据cDNA Synthesis Kit方法进行. 总RNA经逆转录反应后, 采用2对引物在同一体系中进行PCR反应, 其中β-actin的引物作为内参. PCR体系置DNA扩增仪上扩增后, 将PCR产物10 µL, 加入上样缓冲液, 于2%琼脂糖凝胶电泳, 在天能凝胶图像处理仪观察并摄取电泳凝胶图像, 用KS400型图像分析系统进行吸光度扫描, 以目的基因吸光度值与对应内参基因吸光度的比值作为该样品中目的基因的相对转录量.
| 基因 | PCR引物 | 产物长度(bp) |
| OPN-F | CAGTCGATGTCCCTGACGG | 206 |
| OPN-R | GTTGCTGTCCTGATCAGAGG | |
| β-actin-F | GTTCCGATGCCCGAGGCTCT | 361 |
| β-actin-R | GCATTTGCGGTGCACGATGGA |
统计学处理 计量资料以mean±SD表示, 组间差异采用单因素方差分析, 两两比较采用最小显著(LSD)法检验, 所有数据均利用SPSS11.0软件分析.
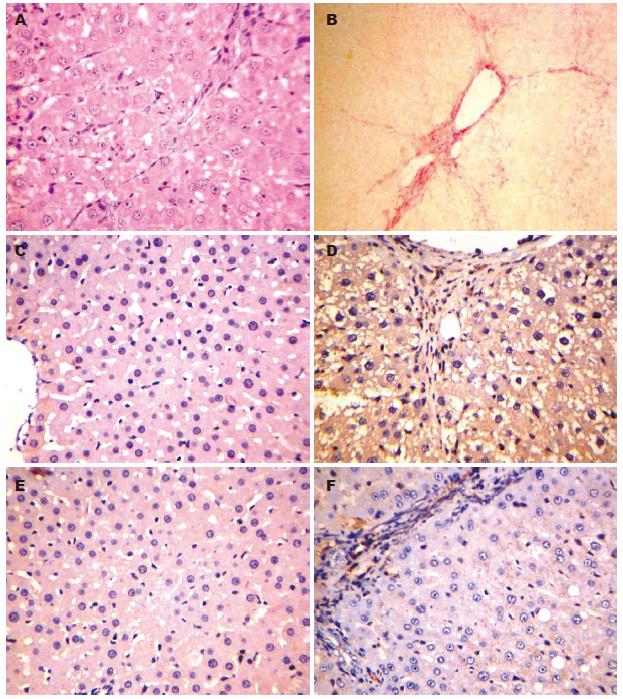
正常组大鼠肝细胞束排列整齐, 无变性、坏死, 肝实质内未见炎细胞浸润. DMN组大鼠肝组织中可见肝细胞空泡样变性, 纤维组织增生, 纤维间隔加宽, 肝窦走向紊乱, 有部分假小叶形成(图1A).
正常组大鼠肝小叶结构正常, 无纤维增生; DMN组大鼠肝组织可见到肝内纤维间隔增多增宽, 纵横交错互相连接, 汇管区结构变形(图1B).
正常组大鼠肝组织OPN表达极弱, DMN组大鼠肝脏中OPN表达增强, 阳性信号为棕黄色颗粒, 散在或弥漫性分布, 主要见于小叶内中央静脉周围、纤维间隔内以及周围巨噬细胞胞质, 库普弗细胞, 门管区的部分肝细胞胞质, 肝窦壁内皮细胞, 中亦有阳性染色, 未见细胞核着色(图1C, D). PAI-1在正常大鼠肝组织中央静脉、肝动脉、门静脉及肝血窦腔面可见阳性细胞胞质染色, 在DMN组大鼠肝组织汇管区、肝细胞变性坏死处、肝窦周Disse间隙及毗邻的肝细胞质、组织纤维间隔处及其外周细胞亦见阳性染色(图1E, F).
正常组大鼠肝脏OPN的蛋白表达极低, DMN组OPN的蛋白表达较正常组显著增强(P<0.01). 与正常组比, DMN组PAI-1表达也显著增强(P<0.01, 表2, 图2, 3).
RT-PCR检测结果显示, 正常组大鼠肝脏OPN mRNA表达极低, DMN组大鼠肝脏OPN mRNA的表达明显增强, 较正常组有显著差异(0.2128±0.0527 vs 0.1298±0.0316, P<0.05, 图4).
肝脏炎症反应和肝细胞的损伤常是肝纤维化的启动因素, 肝细胞损伤后可通过一些细胞因子或介质的释放引起纤维化进程的加速, 已有研究表明OPN和PAI与肝纤维化进程密切相关, 炎症反应可增强刺激肝星状细胞(hepatic stellate cell, HSC), 导致ECM的重建和纤维瘢痕的形成[1].
我们通过免疫组织化学对OPN的表达定位, 发现正常组大鼠的肝组织几乎不表达OPN, 与部分文献报道结果相同[2], 而肝纤维化大鼠肝小叶中央静脉周围、纤维间隔内以及周围巨噬细胞胞质, 库普弗细胞, 肝窦内皮细胞, 汇管区的部分肝细胞胞质中都有OPN阳性表达. 通过RT-PCR和Western blot的方法检测肝纤维化组OPN mRNA表达和蛋白表达, 显示肝纤维化组OPN的蛋白表达和OPN mRNA的表达都较正常组明显增强, 因此推测OPN的蛋白表达和mRNA表达增加, 可能与肝脏损伤后表达OPN的细胞增多有关[3].
HSC活化、增殖进而合成大量的胶原等ECM成分是各种肝脏损伤引起肝纤维化的中心环节. 尽管我们在使用免疫组织化学的方法对模型OPN的定位, 未能发现大量的肝星状细胞OPN强阳性染色, 但是我们通过对OPN蛋白表达的Western blot检测结合基因表达的RT-PCR检测, 与肝组织动态病理分级, 结合胶原天狼猩红染色的情况, 我们认为OPN的表达与肝星状细胞的活化是密切相关的. OPN可能通过对巨噬细胞的趋化作用, 引起巨噬细胞的聚集, 从而参与局部累积的库普弗细胞和巨噬细胞对于HSC的激活和肝纤维化级联反应.
新近的研究证实体外培养的肝细胞能合成和分泌OPN, 并且在TNF-α, TGF-β和Leptin的刺激下其合成上调, 并且肝细胞OPN的表达增加先于肝脏炎症及纤维化的发展的, 同时伴随有Ⅰ型胶原mRNA的表达增加[4]. Sung等发现重组OPN与HSC共培养, 可引起HSC明显的增殖与迁移, 诱导MMP-2的产生与活化, 引起Ⅰ型胶原和Ⅱ型、TGF-β受体mRNA及蛋白的产生[2]. 这提示OPN的表达上调可能是HSC活化的一个重要途径. 本实验结果表明, 在肝纤维化的形成过程中, 中央静脉周围、汇管区周围及其附近的肝窦内皮细胞, 部分肝细胞胞质都可以发现OPN阳性染色的细胞, 可以设想, 用干预OPN的表达或调节OPN的活性作为治疗靶标, 可以阻止肝纤维化的进程.
纤溶系统属于丝氨酸蛋白酶类, 与ECM的降解密切相关. 纤溶酶原激活物抑制物(PAI-1)作为纤溶系统当中的一个重要的组成部分, 大量的实验和临床研究证据表明他在肝纤维化形成中具有重要的作用. 对于PAI-1致纤维化的作用目前认为与两个相互联系的途径密不可分: 一是PAI-1抑制PA活性, 进而减少纤溶酶的生成和纤维蛋白的降解; 二是u-PA可促进MT1-MMP和MMP2活化. PAI-1作为uPA的抑制剂, 抑制uPA诱导的及由MT1-MMP介导的MMP-2的活化.
纤溶系统的肝脏细胞来源一直为众多学者所争论[5], 如有的研究发现静止期的大鼠肝细胞体内及体外实验都不表达PAI-1, 而有的学者发现在原代培养的肝细胞产生tPA和PAI-1. 我们免疫组织化学定位的结果表明在正常大鼠的肝脏中央静脉、肝动脉、门静脉及肝血窦腔面可见阳性细胞胞质染色, 在血瘀型肝纤维化模型大鼠肝组织汇管区、肝细胞变性坏死处, 肝窦周Disse间隙及毗邻部位的肝细胞质, 组织纤维间隔处及其外周细胞亦见不同程度阳性表达. 而在纤维化模型大鼠的肝组织以上部位的阳性表达较血瘀型肝纤维化模型阳性表达弱. 这与国内李清华等报道相似: 随着肝纤维化程度的加重, PAI-1的蛋白表达着色积分亦明显增加[6].
通过免疫组织化学半定量及蛋白表达Western blot检测的发现, PAI-1和OPN在肝纤维化形成过程中蛋白表达明显增强, 就免疫组织化学定位来看, 两者在肝纤维化发生时的细胞学来源相似, 与关键ECM产生细胞如HSC相关, 或者与HSC活化相关的细胞如纤维细胞、巨噬细胞相互联系. 但是两者在肝纤维化中发挥的作用存在差异, PAI-1主要是与基质的降解关系较大, 因此随着肝纤维化的进展其表达不断增加从而抑制ECM的降解. 而OPN作为一种功能独特的ECM成分之一, 从肝纤维化的形成过程中的蛋白表达整体趋势而言以上升为主, 既可以通过对巨噬细胞的趋化作用, 引起巨噬细胞的聚集, 从而参与局部累积的库普弗细胞和巨噬细胞对于星状细胞的激活和肝纤维化级联反应, 也可能与Ⅰ型胶原, 纤连蛋白等其他胞外基质成分相互作用而参与纤维化时ECM网架的形成等.
可以推测OPN的表达增高可能会促进PAI-1的表达增强, PAI-1表达增强会抑制纤溶系统对包括OPN在内的ECM成分的降解, 从而加速纤维化的形成. 目前对于OPN与纤溶系统的关系的研究还不是很多, 国内报道[7]在血管再狭窄发生过程中, OPN与纤溶酶原激活物抑制物共同参与血管的重构, 而对于OPN及PAI-1在肝纤维化形成中作用的研究报道更少, 我们对于两者关系的研究初步揭示OPN和PAI-1在肝纤维化形成过程中的相关性.
骨桥蛋白(OPN)作为ECM的非胶原糖蛋白组分, 在肝纤维化过程的作用受到学者的重视. 纤溶系统(PA和PAI)属于丝氨酸蛋白酶类, 与ECM的降解密切相关, 本文拟从此角度研究OPN及纤溶酶原激活物抑制物(PAI-1)表达特征及在肝纤维化时的作用.
叶红军, 主任医师, 广东省北京大学深圳医院消化内科.
纤溶系统的肝脏细胞来源一直为众多学者所争论, 如有的研究发现静止期的大鼠肝细胞体内及体外实验都不表达PAI-1, 而有的学者发现在原代培养的肝细胞产生tPA和PAI-1.
已有研究表明OPN和PAI与肝纤维化进程密切相关, 炎症反应可增强刺激肝星状细胞(HSC), 导致ECM的重建和纤维瘢痕的形成.
本研究内容有一定新颖性, 技术路线先进, 论点清晰, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 2. | Lee SH, Seo GS, Park YN, Yoo TM, Sohn DH. Effects and regulation of osteopontin in rat hepatic stellate cells. Biochem Pharmacol. 2004;68:2367-2378. [PubMed] |
| 3. | Lorena D, Darby IA, Gadeau AP, Leen LL, Rittling S, Porto LC, Rosenbaum J, Desmoulière A. Osteopontin expression in normal and fibrotic liver. altered liver healing in osteopontin-deficient mice. J Hepatol. 2006;44:383-390. [PubMed] |
| 4. | Kawashima R, Mochida S, Matsui A, YouLuTuZ Y, Ishikawa K, Toshima K, Yamanobe F, Inao M, Ikeda H, Ohno A. Expression of osteopontin in Kupffer cells and hepatic macrophages and Stellate cells in rat liver after carbon tetrachloride intoxication: a possible factor for macrophage migration into hepatic necrotic areas. Bioch. em Biophys Res Commun. 1999;256:527-531. [PubMed] |