修回日期: 2010-03-19
接受日期: 2010-03-23
在线出版日期: 2010-04-18
目的: 研究转染kiss-1基因对人食管癌EC9706细胞裸鼠皮下移植瘤的作用, 探讨其在食管癌基因治疗中的可行性和特异性.
方法: 在食管癌细胞系EC9706中转染kiss-1基因, 经G418筛选, 建立稳定高表达Kiss-1蛋白的细胞系. 稳定表达该基因的细胞为转染kiss-1基因组, 转染空质粒细胞及未处理细胞为对照组, 建立裸鼠荷瘤模型; 监测肿瘤生长变化, HE染色观察肿瘤病理学变化, RT-PCR、Western blot方法检测kiss-1 mRNA和蛋白变化.
结果: 转染kiss-1基因组肿瘤生长受到显著抑制; HE染色显示转染kiss-1基因组及转染空质粒组肿瘤组织内坏死均较空白对照组多; RT-PCR、Western blot结果表明转染kiss-1基因组裸鼠肿瘤组织kiss-1 mRNA和蛋白表达均显著升高, 三组间比较差异具有统计学意义(F = 72.685, 24.807, 均P<0.05).
结论: 转染kiss-1基因能抑制人食管癌EC9706细胞裸鼠皮下移植瘤的形成, 且能有效上调kiss-1 mRNA和蛋白的表达, 可为食管癌的基因治疗提供新的靶点、开辟新的思路.
引文著录: 李晟磊, 赵志华, 张岚, 陈奎生, 高冬玲, 张云汉, 张蕾. 转染kiss-1基因对人食管癌EC9706细胞裸鼠移植瘤的抑制作用. 世界华人消化杂志 2010; 18(11): 1088-1092
Revised: March 19, 2010
Accepted: March 23, 2010
Published online: April 18, 2010
AIM: To investigate the effects of kiss-1 transfection on the growth of xenograft tumors derived from human esophageal carcinoma cell line EC9706 in nude mice, and to explore the feasibility of gene therapy for esophageal carcinoma.
METHODS: A eukaryotic expression vector carrying the kiss-1 gene (pcDNA3.1-Kiss-1) was transfected into EC9706 cells with Lipofectamine 2000. The cells stably expressing Kiss-1 were selected using G418. EC9706 cells untransfected or transfected with empty pcDNA3.1 plasmid were used as controls. A xenograft tumor model was then established. Tumor growth was observed. Tumor histopathological changes were determined by hematoxylin and eosin (HE) staining. The expression of kiss-1 mRNA and protein in tumor tissue was measured by RT-PCR (reverse transcription-polymerase chain reaction) and Western blot, respectively.
RESULTS: Kiss-1 transfection significantly suppressed tumor growth. Histopathological observations indicated that the volume of tumors derived from control cells were significantly bigger than that from EC9706 cells transfected with pcDNA3.1-Kiss-1 plasmid. RT-PCR and Western blot analyses indicated that the expression of kiss-1 mRNA and protein was significantly enhanced in EC9706 cells transfected with the recombinant plasmid when compared with control cells (F = 72.685 and 24.807, respectively; both P < 0.05).
CONCLUSION: Kiss-1 transfection effectively inhibits the growth of subcutaneous xenograft tumors derived from EC9706 cell line in nude mice, suggesting that Kiss-1 may be a potential molecular therapeutic target for esophageal carcinoma.
- Citation: Li SL, Zhao ZH, Zhang L, Chen KS, Gao DL, Zhang YH, Zhang L. Kiss-1 transfection inhibits the growth of xenograft tumors derived from human esophageal carcinoma cell line EC9706 in nude mice. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1088-1092
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1088.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1088
kiss-1基因是近年来发现的一个新的肿瘤转移抑制基因, 定位于人染色体1q32-q41, 由4个外显子组成. 他可以抑制细胞的趋化性, 增强成簇黏附激酶的表达和活性, 从而抑制肿瘤细胞的转移[1-4]. 本研究首先在食管癌细胞系EC9706中转染kiss-1基因, 建立了稳定高表达Kiss-1蛋白的细胞系, 然后将不同组的细胞注射入裸鼠皮下成瘤, 之后采用RT-PCR及Western blot等实验方法, 分别检查了不同组裸鼠移植瘤组织中kiss-1基因蛋白及mRNA表达水平的变化. 从不同角度对kiss-1基因抑制肿瘤转移的机制进行初步探索. 旨在进一步探讨kiss-1基因在食管鳞癌发生过程中的作用, 为寻找检测食管鳞癌的新的分子标记奠定基础.
pcDNA3.1真核表达质粒由郑州大学基础医学院微生物学与免疫学教研室保存. pcDNA3.1-Kiss-1真核表达质粒由本课题组构建, 经酶切及测序鉴定后保存在本实验室. 食管癌细胞系EC9706由中国医学科学院肿瘤医院分子肿瘤学国家重点实验室惠赠. One step RNA PCR Kit(AMV)购自大连宝生物工程有限公司; 凯基全蛋白提取试剂盒购自南京凯基生物科技发展有限公司; SP免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司; Lipofectamine2000购自Invitrogen公司; Kiss-1兔抗人多克隆抗体购自武汉博士德生物工程有限公司; 引物由北京奥克生物工程公司合成.
1.2.1 细胞培养与基因转染: 细胞在含有100 mL/L胎牛血清、100 kU/L青霉素和100 mg/L链霉素的完全培养基中37 ℃、50 mL/L CO2条件下培养, 以1-2×105/孔的密度接种于24孔板上, 待细胞长至90%-95%融合时, 按试剂盒要求将pcDNA3.1-Kiss-1质粒与脂质体混合后加入24孔板中, 轻微混匀后, 置37 ℃孵箱中培养, 转染4-6 h换液, 加入完全培养液终止转染, 并以pcDNA3.1空质粒转染做阴性对照. 于转染后48 h加入终浓度为800 mg/L的G418, 连续应用2 wk, 挑取肉眼可辨的单克隆细胞, 以G418终浓度为300 mg/L继续扩大培养, 获得稳定转染细胞.
1.2.2 转染细胞的裸鼠荷瘤实验及分组: 4-6 wk鼠龄BalB/c雌性裸鼠, 平均质量18-22 g, 购自中国科学院上海斯莱克实验动物中心. 在河南省肿瘤病理重点实验室动物实验中心层流净化室无菌饲养. 取对数生长期细胞, 胰酶消化, PBS调整细胞悬液浓度至5×1010/L, 在裸鼠腋下接种0.2 mL. 15只裸鼠随机分组, 每组5只. A组接种pSU2PER2EGFP2STA T3重组体转染细胞, B组接种空载体转染细胞, C组接种未转染细胞. 注射7 d开始每3天游标卡尺测量瘤体大小, 每隔3 d测量肿瘤的长径(L)和短径(S), 至28 d统一处死裸鼠, 取下肿瘤组织, 根据公式V(cm3) = (L×S2)/2来计算肿瘤的体积.
1.2.3 Western blot检测蛋白表达: 按照总蛋白提取试剂盒说明书(凯基生物公司)提取总蛋白, Bradford法检测蛋白质的含量, 蛋白经SDS-PAGE电泳(5%浓缩胶, 15%分离胶)后转移至硝酸纤维素膜, 用含1%脱脂奶粉的TBST封闭30 min, 一抗于4 ℃孵育过夜, TBST洗涤3次×10 min; 辣根过氧化物酶标记的二抗于室温孵育2 h, TBST洗涤3次×10 min, 膜与化学发光底物孵育5 min, 经X线片曝光、显影、定影. 显色结果用软件Total Lab2.0进行灰度分析, 并计算蛋白的相对表达水平.
1.2.4 RT-PCR(一步法)检测mRNA的表达: 采用大连宝生物公司提供的一步法试剂盒说明书进行, RNA提取过程按照TRIzol(Invitrogen公司)RNA提取试剂盒说明书进行, 引物序列分别为kiss-1上游5'-AGAGGAAGCCAGCTGCTACTG-3', 下游5'-GCCGAAGGAGTTCCAGTTGTA-3'; 内参β-actin: 上游5'-CATCCTGCGTCTGCACCT-3', 下游5'-TCAGGAGGAGCAAT GATCTTG-3', 预期扩增片段大小分别为191 bp和480 bp. RT-PCR反应条件: 50 ℃×30 min, 94 ℃×2 min, 94 ℃×40 s, Kiss-1为48 ℃×30 s, 72 ℃×1 min, 共30个循环; 72 ℃延伸10 min. 取5 μL用1.5%琼脂糖凝胶电泳, 在凝胶成像仪上成像及灰度分析.
统计学处理 实验结果应用SPSS13.0统计分析软件进行分析, 检验水准α = 0.05, 各组间相对表达水平的比较采用F分析.
至接种4 wk后, 裸鼠处死前测量各组移植瘤瘤体大小. 连续4 wk检测3组裸鼠的成瘤体积, 肉眼观察时可见EC9706/pcDNA3.1-Kiss-1组瘤体最小, 裸鼠移植瘤体积明显小于EC9706细胞组、EC9706/pcDNA3.1细胞组. 4 wk后裸鼠处死后迅速测量体积, 3组裸鼠肿瘤体积大小分别为1 541.60 mm3±59.36 mm3、1 482.60 mm3±70.32 mm3、508.40 mm3±464.90 mm3, 差异具有统计学意义(F = 473.35, P = 0.000).
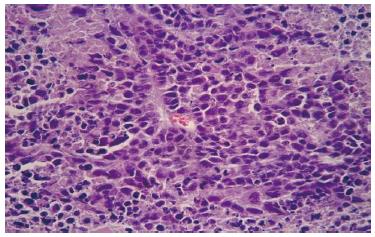
各组抑制瘤组织HE染色后, 光镜下观察可见大小不等的瘤细胞团, 其中散在灶状、片状凝固性坏死, 瘤细胞团周围有少量纤维结缔组织包绕. 瘤细胞多为圆形或多角形上皮样细胞, 细胞排列紧密, 呈明显异形行, 大小不一, 形态各异, 核大而深染, 部分肿瘤细胞核仁清晰可见, 病理性核分裂相可见. 坏死灶依EC9706细胞组、EC9706/pcDNA3.1细胞组、EC9706/pcDNA3.1-Kiss-1细胞组的顺序逐渐增多, 图1为转染kiss-1基因组裸鼠肿瘤组织HE染色图片, 肿瘤细胞之间坏死组织广泛分布.
免疫细胞化学法检测结果显示, Kiss-1蛋白和在三组细胞中的表达主要定位于胞质, 采用HPIAS-1000高清晰图像处理系统进行图像分析, Kiss-1蛋白在转染组中的平均吸光度(A值), 明显高于转染空质粒组和空白对照组(P<0.05). Western blot检测结果见图2和表1.
| 分组 | Kiss-1/β-actin | F值 | P值 |
| EC9706细胞组 | 0.652±0.039 | ||
| EC9706/pcDNA3.1细胞组 | 0.642±0.042 | 24.807 | 0.000 |
| EC9706/pcDNA3.1-Kiss-1细胞组 | 0.790±0.029 |
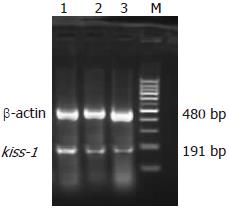
RT-PCR扩增结果经凝胶电泳显示, kiss-1 mRNA RT-PCR扩增产物与预计一致, 其片段大小为191 bp, 内参β-actin片段大小为480 bp(图3). 扩增结果经凝胶灰度扫描而对kiss-1 mRNA阳性表达进行定量, 在EC9706细胞组、EC9706/pcDNA3.1细胞组、EC9706/pcDNA3.1-Kiss-1细胞组中kiss-1 mRNA的含量依次增高, 组间比较差异具有统计学意义(F = 72.685, P<0.05, 图3, 表2).
| 分组 | Kiss-1/β-actin | F值 | P值 |
| EC9706细胞组 | 0.377±0.030 | ||
| EC9706/pcDNA3.1细胞组 | 0.382±0.024 | 72.685 | 0.000 |
| EC9706/pcDNA3.1-Kiss-1细胞组 | 0.535±0.014 |
肿瘤发生发展过程中的侵袭和转移是影响其预后的重要因素, 食管癌患者早期出现侵袭和转移的生物学特性严重影响了患者的生存率, 目前肿瘤转移抑制基因在肿瘤侵袭和转移中的作用受到了普遍关注[5]. kiss-1基因是1996年Lee等在人黑色素瘤细胞株中最先发现的一个新的肿瘤转移抑制基因, 定位于染色体1q32-q41区. kiss-1基因编码的是一个有亲水性的145个氨基酸组成的蛋白质, 其羧基末端(61-121)的54个氨基酸是人孤儿G蛋白偶联受体(hOT7T175)的配体, 被命名为转移抑素(metastin), 其与受体结合在人类多种肿瘤中发挥了抑制肿瘤转移的作用[6-8], 但其具体机制尚不十分明确.
研究表明, kiss-1基因的异常表达与肾癌, 肾癌、胃癌、肝癌、乳腺癌、胰腺癌及卵巢癌等恶性肿瘤的浸润转移密切相关[9-14]. 我们前期的实验研究显示: 食管鳞癌组织中的确存在kiss-1基因的表达显著下调, 并且这种表达量的下调与食管鳞癌的淋巴结转移有关[15-17]. 因此本课题组在前期组织实验的基础上, 构建kiss-1基因真核表达载体, 并将其转染入食管癌EC9706细胞, 然后采用将不同组别的细胞注射入裸鼠体内, RT-PCR和Western blot技术首先验证kiss-1基因转染成功, 并检测转染前后裸鼠移植瘤组织中Kiss-1蛋白及mRNA的表达情况. 结果显示: 转染kiss-1基因后食管癌EC9706细胞裸鼠移植瘤组织中Kiss-1蛋白及mRNA的表达水平显著增加(P<0.05). 自2001年Yan等首次克隆出kiss-1基因并将其转入HT-1080细胞, 发现kiss-1基因降低了MMP的表达而起到了抑制肿瘤转移的作用以来, kiss-1基因与MMP的关系在胰腺癌、卵巢癌及子宫内膜癌中也相继被发现. 我们通过以上实验证明了在食管癌细胞中kiss-1基因的过表达能抑制肿瘤的生长表达, 从而起到抑制肿瘤细胞转移的作用; 转染kiss-1基因的肿瘤细胞其蛋白及mRNA表达均显著上调, 转染kiss-1基因可能能够抑制肿瘤组织的生长.
kiss-1的确切功能目前尚不完全清楚, 有资料报道kiss-1还可能通过MAPK信号转导途径、Rac/Cdc42途径及PKC/PLC、Ca2+途径调节肿瘤细胞的增殖、凋亡及抑制肿瘤细胞的转移[18-20]. 因此对kiss-1基因进行深入、广泛的研究, 了解其抑制肿瘤浸润和转移的具体机制, 可为肿瘤的预后评估及临床治疗提供理论依据.
kiss-1基因是近年来发现的一个新的肿瘤转移抑制基因, 他可以抑制细胞的趋化性, 增强成簇黏附激酶的表达和活性, 从而抑制肿瘤细胞的转移. 本课题组在前期工作基础上将kiss-1基因转染了食管鳞癌EC9706细胞并筛选出稳定表达kiss-1基因的食管癌细胞株, 关于转染kiss-1基因后注射裸鼠成瘤的实验研究目前国内外均尚未见报道.
刘丽江, 教授, 江汉大学医学院病理学; 李瑗, 教授, 广西肿瘤研究所.
国内外研究表明, 肝癌、乳腺癌及肺癌中kiss-1基因表达量与肿瘤的侵袭力成呈负相关, 且kiss-1基因表达较高的患者预后往往也明显好于表达量低的患者.
本文首次采用细胞转染、RT-PCR及Westren blot等技术联合检测转染kiss-1基因后食管癌EC9706细胞裸鼠皮下移植瘤成瘤情况及中瘤组织Kiss-1蛋白及mRNA表达的情况.
本研究设计合理并具有科学性, 研究内容比较丰富, 数据及结果可论证其结论.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lee JH, Miele ME, Hicks DJ, Phillips KK, Trent JM, Weissman BE, Welch DR. KiSS-1, a novel human malignant melanoma metastasis-suppressor gene. J Natl Cancer Inst. 1996;88:1731-1737. [PubMed] |
| 2. | Shengbing Z, Feng LJ, Bin W, Lingyun G, Aimin H. Expression of KiSS-1 gene and its role in invasion and metastasis of human hepatocellular carcinoma. Anat Rec (Hoboken). 2009;292:1128-1134. [PubMed] |
| 3. | Lee KH, Kim JR. Kiss-1 suppresses MMP-9 expression by activating p38 MAP kinase in human stomach cancer. Oncol Res. 2009;18:107-116. [PubMed] |
| 4. | Yoshioka K, Ohno Y, Horiguchi Y, Ozu C, Namiki K, Tachibana M. Effects of a KiSS-1 peptide, a metastasis suppressor gene, on the invasive ability of renal cell carcinoma cells through a modulation of a matrix metalloproteinase 2 expression. Life Sci. 2008;83:332-338. [PubMed] |
| 5. | Ek ET, Ojaimi J, Kitagawa Y, Choong PF. Does the degree of intratumoural microvessel density and VEGF expression have prognostic significance in osteosarcoma? Oncol Rep. 2006;16:17-23. [PubMed] |
| 6. | Zheng HC, Yu AM, Xin Y. Aberrant expression of Kiss-1 and matrix metalloproteinase-9 are closely linked to lymph node metastasis of gastric cancer. Chin Med Sci J. 2008;23:63-64. [PubMed] |
| 7. | Nicolle G, Comperat E, Nicolaïew N, Cancel-Tassin G, Cussenot O. Metastin (KISS-1) and metastin-coupled receptor (GPR54) expression in transitional cell carcinoma of the bladder. Ann Oncol. 2007;18:605-607. [PubMed] |
| 8. | Ikeguchi M, Yamaguchi K, Kaibara N. Clinical significance of the loss of KiSS-1 and orphan G-protein-coupled receptor (hOT7T175) gene expression in esophageal squamous cell carcinoma. Clin Cancer Res. 2004;10:1379-1383. [PubMed] |
| 9. | Shoji S, Tang XY, Umemura S, Itoh J, Takekoshi S, Shima M, Usui Y, Nagata Y, Uchida T, Osamura RY. Metastin inhibits migration and invasion of renal cell carcinoma with overexpression of metastin receptor. Eur Urol. 2009;55:441-449. [PubMed] |
| 10. | Wang ZH, Feng XS, Wang GP, Gao SG, Mi JQ, Sun JT, Qu ZF, Han J, Zhang L. [Expression and clinical significance of KiSS-1 and E-cadherin in gastric cardia carcinoma]. Zhonghua Weichang Waike Zazhi. 2007;10:380-382. [PubMed] |
| 11. | Hou YK, Wang Y, Cong WM, Wu MC. [Expression of tumor metastasis-suppressor gene KiSS-1 and matrix metalloproteinase-9 in portal vein tumor thrombus of hepatocellular carcinoma]. Aizheng. 2007;26:591-595. [PubMed] |
| 12. | Pentheroudakis G, Kostadima L, Dova L, Georgiou I, Tzavaras T, Vartholomatos G, Wirtz RM, Fountzilas G, Malamou-Mitsi V, Pavlidis N. A twisted kiss: in vitro and in vivo evidence of genetic variation and suppressed transcription of the metastasis-suppressor gene KiSS1 in early breast cancer. Neoplasma. 2010;57:47-54. [PubMed] |
| 13. | Liang S, Yang ZL. [Expression of KiSS-1mRNA in pancreatic ductal adenocarcinoma and non-cancerous pancreatic tissues in SD rats]. Zhongnan Daxue Xuebao Yixueban. 2007;32:109-113. [PubMed] |
| 14. | Gao GL, Liu LD, Zou XS, Chen WX. [Expression of KiSS-1, matrix metalloproteinase-9, nuclear factor-kappaBp65 in ovarian tumour]. Zhonghua Fuchanke Zazhi. 2007;42:34-38. [PubMed] |
| 15. | 陈 妍琼, 赵 志华, 张 蕾, 高 冬玲, 张 岚, 陈 奎生. 食管鳞状细胞癌组织中KiSS-1蛋白和微血管密度的检测. 郑州大学学报(医学报). 2009;44:1127-1130. |
| 17. | 李 小丽, 赵 志华, 张 蕾, 温 洪涛, 李 晟磊, 许 柯. 人食管鳞状细胞癌组织中KiSS-1 mRNA及蛋白的表达. 郑州大学学报(医学报). 2008;43:634-636. |
| 18. | Castaño JP, Martínez-Fuentes AJ, Gutiérrez-Pascual E, Vaudry H, Tena-Sempere M, Malagón MM. Intracellular signaling pathways activated by kisspeptins through GPR54: do multiple signals underlie function diversity? Peptides. 2009;30:10-15. [PubMed] |
| 19. | Yan C, Wang H, Boyd DD. KiSS-1 represses 92-kDa type IV collagenase expression by down-regulating NF-kappa B binding to the promoter as a consequence of Ikappa Balpha -induced block of p65/p50 nuclear translocation. J Biol Chem. 2001;276:1164-1172. [PubMed] |
| 20. | Dissanayake SK, Wade M, Johnson CE, O'Connell MP, Leotlela PD, French AD, Shah KV, Hewitt KJ, Rosenthal DT, Indig FE. The Wnt5A/protein kinase C pathway mediates motility in melanoma cells via the inhibition of metastasis suppressors and initiation of an epithelial to mesenchymal transition. J Biol Chem. 2007;282:17259-17271. [PubMed] |