修回日期: 2010-02-05
接受日期: 2010-02-23
在线出版日期: 2010-04-08
目的: 检测癌-睾丸抗原GAGE-7的自身抗体在食管鳞状细胞癌患者和正常人血清中表达的差异, 评价GAGE家族作为肿瘤诊断标志物的可行性.
方法: 在原核细菌中表达并纯化重组GAGE-7蛋白, 采用ELISA检测GAGE-7自身抗体在105份食管鳞状细胞癌患者血清和86份正常人血清中的表达水平. 同时检测各血清中总IgG的表达量, 计算GAGE-7自身抗体在总IgG中所占比例的差异.
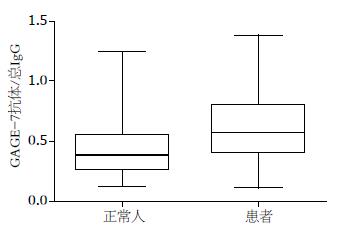
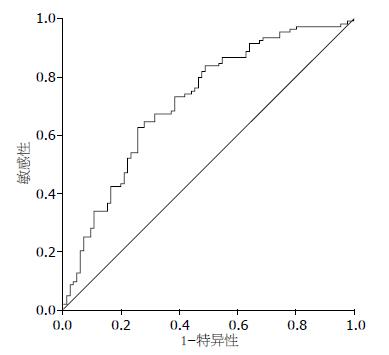
结果: 血清中GAGE-7抗体在食管鳞状细胞癌中的含量与正常组比较差异显著(P<0.001), 而GAGE-7抗体与总IgG比例, 患者组明显高于正常组, 逻辑回归模型分析c值为0.717, 敏感性和特异性分别达到0.72和0.62, 且差异显著(P<0.0001).
结论: 癌-睾丸抗原GAGE-7的自身抗体在食管鳞状细胞癌血清中有较高表达, 且与正常组比较有显著差异, 其表达特性可被看做是较为理想的癌症检测标志物.
引文著录: 王皓, 钟理, 徐家馨, 张小刚, 王建飞. GAGE-7自身抗体在食管鳞状细胞癌中的表达. 世界华人消化杂志 2010; 18(10): 998-1003
Revised: February 5, 2010
Accepted: February 23, 2010
Published online: April 8, 2010
AIM: To compare the level of serum autoantibody against cancer-testis antigens GAGE-7 between patients with esophageal squamous cell carcinoma and normal controls and to evaluate the possibility of using GAGE family members as diagnostic tumor markers.
METHODS: Recombinant GAGE-7 protein was expressed and purified. The level of serum autoantibody against GAGE-7 was detected in patients with esophageal squamous cell carcinoma serum and normal controls by enzyme-linked immunosorbent assay (ELISA). Meanwhile, total serum IgG was determined. The ratio of serum autoantibody against GAGE-7 to total serum IgG was then calculated.
RESULTS: The level of serum autoantibody against GAGE-7 was much higher in patients with esophageal squamous cell carcinoma than in normal controls (P < 0.001). The difference in the ratio of serum autoantibody against GAGE-7 to total serum IgG between the two groups of subjects was more significant than that in the level of serum autoantibody against GAGE-7. Logistic regression analysis showed that detection of the ratio of serum autoantibody against GAGE-7 to total serum IgG for discrimination of the two groups of subjects had a c value of 0.717, a sensitivity of 0.72, and a specificity of 0.62 (P < 0.0001).
CONCLUSION: The level of serum autoantibody against GAGE-7 differs significantly between patients with esophageal squamous cell carcinoma and normal controls. GAGE family members may be promising markers for diagnosis of esophageal squamous cell carcinoma.
- Citation: Wang H, Zhong L, Xu JX, Zhang XG, Wang JF. Detection of serum autoantibody against GAGE-7 in patients with esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 998-1003
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/998.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.998
食管癌是发生在食管上皮组织的恶性肿瘤, 全世界每年约有34万人死于食管癌, 在世界常见肿瘤中占第8位[1]. 我国是世界食管癌的高发区, 其中发病患者约占全世界发病总数的70%, 严重威胁着人民的健康. 食管癌主要有两种类型, 食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌, 各自具有独特的病原和病理特征, 其中ESCC是主要的食管癌类型, 在世界范围的食管癌患者中约占95%. ESCC具有多种发病诱因, 包括遗传及环境的影响. 有研究表明, 酒精、烟草、维他命缺乏及年龄衰老等, 都是诱发ESCC的主要危险因素[2,3]. 在发达国家中, 较为常见的是食管腺癌, 而ESCC则较多出现在发展中国家. 因此, 对于ESCC的研究远不如对食管腺癌的研究深入, ESCC发生和发展的分子机制目前尚未明了[4]. 尽管医疗技术日益先进, 但是总体上5年以上的食管癌患者存活率依然不足30%[5]. 这在很大程度上是由于缺少高敏感性和特异性的早期诊断标志物造成的. 一些食管鳞状细胞癌常用标志物, 比如细胞角蛋白19片段[6]、鳞状上皮细胞癌抗原[7]和癌胚抗原[8], 敏感性均小于50%. 因此, 寻找高敏感性和特异性的肿瘤诊断标志物和诊断方法成为提高食管鳞状细胞癌患者存活率的关键. 近些年来, 一系列肿瘤相关抗原(tumor-associated antigens, TAA)相继被发现并得到确认. 其中一部分TAA属于肿瘤生殖系基因产物, 也被称为癌-睾丸抗原(cancer-testis antigens, CTA)家族[9]. 这些抗原带有一小段细胞蛋白多肽组成的膜结合一类HMC分子, 因此可以被机体免疫系统识别, 诱导免疫反应对抗肿瘤细胞[10]. CTA家族在广泛的肿瘤组织中有着不同水平的表达, 而在正常组织中的表达只限于生殖细胞中(睾丸及卵巢), 而生殖细胞没有或很少表达人白细胞抗原(human leukocyte antigen, HLA), 因此不会引起机体的免疫应答[11].
G antigen(GAGE)基因属于CTA家族, 包括十多个不同的成员[12-14]. GAGE基因家族在大多数成年人正常组织中不表达, 但是表达在多种肿瘤组织中. 关于GAGE抗原的表达机制和生物学功能还不十分了解, 但是有研究表明GAGE的表达水平与许多人类肿瘤的发生和预后相关, 说明GAGE也许对于癌症细胞的有着显著的影响[13,15-16]. 由于GAGE单一表达在肿瘤组织中, 使得GAGE抗原成为一种潜在的诊断和预后标志物, 并且通过分析GAGE在正常组织和各种不同癌症组织的表达差异, 可以将GAGE作为免疫诊断的靶位[17]. GAGE蛋白能够引起机体产生细胞免疫[12]和体液免疫[18], 尤其是体液免疫反应可以产生自身抗体, 而这些特异性抗体可以在抗原存在十分稀少时被大量表达, 因此检测血清中的自身抗体可以作为肿瘤早期检测的方法之一[19,20]. 此外, 许多学者都证明恶性肿瘤患者的体液免疫常发生明显变化, 其中血清Ig的检测颇受重视并应用于临床检测[21-24]. 血清中某种特异性抗体的含量可能由于血清总IgG含量的不同而发生改变. 在本次研究中, 我们原核表达并纯化了GAGE-7蛋白, 并检测和比较了GAGE抗体在食管鳞状细胞癌患者血清和正常人血清的表达差异, 同时比较GAGE-7自身抗体在血清总IgG中所占比例的差异, 以期评价GAGE基因产物作为食管鳞状细胞癌检测的可能性.
实验所使用血清来自河北大学附属医院, 年龄为50-80岁. 其中食管鳞状细胞癌患者血清105份, 正常人血清86份.
1.2.1 目的基因表达载体的构建: 目的基因GAGE-7由人类全长cDNA克隆(Origene Technologies, Rockville, United States)获得. 依据GenBank收录GAGE-7, 设计引物(上游5'-TTTTTAACCATGGGCATGAGTTGGCGAGGAAGATC-3', 下游5'-TTTTTACTCGAGACACTGTGATTGCTTTTCACC-3'), 在目的基因两端分别插入NcoⅠ和XhoⅠ作为酶切位点. PCR扩增程序: 95 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸45 s, 共40个循环. 扩增结束后进行1.5%(质量分数)琼脂糖凝胶电泳检测并纯化扩增产物. 将扩增产物从凝胶中回收(Gel Extraction Kit, Bioland Research Products, La Palma, United States)后, 将扩增产物和pET-28b(+)(Novagen, Madison, United States)在NcoⅠ和XhoⅠ位点进行酶切, 37 ℃, 3 h, 进行电泳纯化后在16 ℃将目的基因与pET-28b(+)质粒连接(DNA Ligation Kit, Novagen, Madison, United States)4 h, 目的基因下游连接6个His-tag序列. 将重组质粒转化至DH5α感受态菌中, 使用卡那霉素筛选阳性克隆. 随机挑选5个克隆, 提取重组质粒(Plasmid Miniprep Kit, Bioland Research Products, Cerritos, USA), 酶切检测并进行DNA测序(T7 Promoter引物).
1.2.2 GAGE-7蛋白表达与纯化: 将序列正确的重组质粒转化至大肠杆菌BL21(DE3), 使用卡那霉素筛选阳性克隆, 挑选单个克隆接种于LB培养基, 37 ℃培养至菌液浓度A600 = 0.4-0.6, 用浓度为1 mmol/L的IPTG诱导3 h, 未诱导菌作对照. 离心收菌. 收集的细菌沉淀用裂解液(8 mol/L Urea, 100 mmol/L NaH2PO4, 10 mmol/L Tris, 10 mmol/L Imidazole, 1 mmol/L TCEP, pH8.0)室温裂解1 h, 离心后将上清液与Ni-NTA琼脂糖微珠(QIAGEN, Valencia, United States)室温孵育1 h, 清洗液(8 mol/L Urea, 100 mmol/L NaH2PO4, 10 mmol/L Tris, 10 mmol/L Imidazole, 1 mmol/L TCEP, pH6.3)清洗微珠4次后, 将蛋白用洗脱液(8 mol/L Urea, 100 mmol/L NaH2PO4, 10 mmol/L Tris, 10 mmol/L Imidazole, 1 mmol/L TCEP, pH4.5)从微珠上洗脱下来. 将纯化后蛋白进行15% SDS-PAGE电泳, 考马斯亮蓝染色分析目的蛋白的纯度. 并使用His-probe(H-3)antibody(Santa Cruz Biotechnology, Inc, Santa Cruz, United States)进行Western blot检测.
1.2.3 酶联免疫吸附剂测定(enzyme-linked immunosorbent assay, ELISA): 血清中GAGE-7抗体含量由ELISA. 96孔板中每孔包被50 µL, 浓度为1 mg/L的GAGE-7蛋白, 4 ℃过夜. 3% BSA室温封闭1 h, 0.1% PBST洗板3次. 将患者及正常人血清以1:160稀释于封闭液中, 每孔50 µL, 室温1 h, 羊抗人IgG Fc HRP(Jackson Immunoresearch, West Grove, United States)1:5 000作为2抗, 每孔50 µL, 室温1 h. 清洗3次后加底物及反应终止液, 在450 nm下读取A值.
1.2.4 血清总IgG检测: 血清总IgG含量的测定使用羊抗人IgG[F(ab')2](Thermo Scientific, Rockford, United States)包被96孔板, 3 mg/L, 每孔50 µL. 血清以1:1 000 000稀释于3% BSA封闭液中, 每孔50 µL, 室温反应1 h. 2抗同样使用羊抗人IgG Fc HRP(Jackson Immunoresearch, West Grove, United States)1:5 000, 每孔50 µL, 450 nm下读取A值.
统计学处理 采用t检验分别统计GAGE-7抗体和血清总IgG检测在患者和正常人的表达差异, 以及GAGE-7抗体与总IgG比例的差异. P<0.05差异有统计学意义.
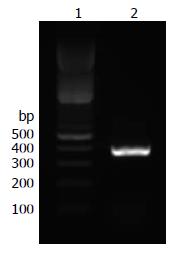
以人类全长cDNA克隆为模板扩增GAGE-7基因, 琼脂糖凝胶电泳出现一条大小约为350 bp的产物, 与设计产物大小一致(354 bp, 图1).
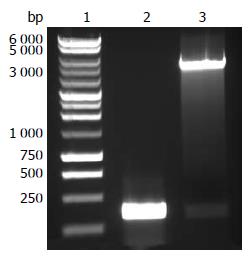
目的基因与pET-28b(+)质粒经酶切与连接后, 重组为含有GAGE-7-His-tag的质粒. 重组质粒经NcoⅠ和XhoⅠ酶切检测, 在电泳中出现两条大小有明显差异的条带. 其中小条带大小与PCR扩增产物一致, 大条带符合pET-28b(+)质粒大小(5 368 bp, 图2).
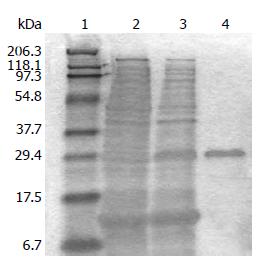
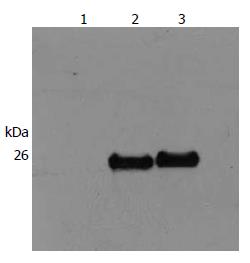
重组转化菌BL21(DE3)经IPTG诱导及纯化后, 在26 kDa处出现诱导蛋白, 而在没有经IPTG诱导的pET-28b(+)重组质粒细菌中没有目的蛋白出现. 经His-probe(H-3)antibody的Western blot检测, 可确定蛋白按所设计的序列表达His-tag(图3, 4). 将蛋白进行mass-spectrometry测序, 确定所表达蛋白为C段带有6个His-tag标签的GAGE-7蛋白.
经ELISA测定, 食管鳞状细胞癌组血清总IgG明显低于正常组(P<0.0001). 血清中GAGE-7抗体在食管鳞状细胞癌血清中含量与正常组比较差异显著(P<0.001), 而GAGE-7抗体与总IgG比例, 患者组明显高于正常组, 逻辑回归模型分析c值为0.717, 敏感性和特异性分别达到0.72和0.62, 且差异显著(P<0.0001, 图5, 6).
自1995年, Van den Eynde等[12]从黑色素瘤细胞株cDNA文库中筛选出一种新的肿瘤抗原基因GAGE, 至今GAGE家族已经包括17个以上的成员[13,14-27]. GAGE基因家族定位于X染色体P11.23区域[13]. 各成员的基因序列有很高的同源性, 因此本实验以GAGE-7为抗原检测的血清抗体很有可能包括了所有GAGE家族抗体. GAGE基因通过细胞毒性T淋巴细胞筛选法鉴定, 目前已发现了GAGE基因家族的两个抗原肽, 其中抗原肽YRPRPRRY(aa9-16)为GAGE-1、-2和-8所共同享有, 由HLA-CW×0601分子递呈; 另一抗原肽YYWPRPRRY(aa9-17)为GAGE-3至-6和7/7B共有, 由HLA-A29分子递呈. 体外实验已证实这些抗原肽可被自身CTL识别[13].
GAGE基因的表达主要表现在mRNA水平和蛋白水平两方面. 在mRNA水平, 多种恶性肿瘤组织中均有表达, 比如黑色素瘤, 食管癌, 肝癌, 肺癌, 前列腺癌, 乳腺癌, 卵巢癌和子宫内膜癌等组织类型[13,17,28-30]. 而在正常组织中除睾丸和卵巢外没有表达. GAGE不仅可以引起机体的细胞免疫反应, 同时也可激活机体的体液免疫反应. 有研究[18]在13.6%的皮肤T细胞淋巴瘤患者血清中检测到GAGE抗体的存在. Bazhin等[31]在黑色素瘤患者血清中检测GAGE家族自身抗体, 有6%的患者血清有反应. 而在食管鳞状细胞癌血清中还尚未有人检测GAGE抗体的含量.
本实验从原核细菌中表达并纯化GAGE-7-His-tag重组蛋白, 运用ELISA方法, 在ESCC患者和正常人血清中分别检测了GAGE-7自身抗抗体的表达差异. 结果表明GAGE-7自身抗体在患者血清中表达水平高于正常组, 且差异显著(P<0.001). 除此以外, 本实验同时检测了血清中总IgG的表达量, 结果正常组中总IgG含量明显高于ESCC患者(P<0.0001). 梅强等[32]通过检测ESCC患者外周血清中IgG、IgA、IgM、C3、C4的含量, 结果食管癌患者体液免疫功能指标中受测各Ig的含量与常人组比较均见降低(P<0.05); 补体C3、C4含量均见升高, 认为食管癌患者体液免疫功能受损, 致使血清中Ig含量降低、补体升高. 刘志峰等[33]运用单项免疫扩散法检测肿瘤患者血清免疫球蛋白IgG、IgA、IgM的含量. 结果与对照比较食管癌血清IgG含量差异显著(P<0.05). 而黄雪芳等[34]检测食管癌与正常人血清总IgG含量, 结果食管癌中含量明显高于正常对照组(P<0.001), 而患者血清复合IgG含量显著低于正常对照组(P<0.001). 他们认为肿瘤患者的特异性体液免疫反应明显不足, 有关升高的Ig主要是非特异性的反应产物, 通过复合Ig的检测更有利于对患者免疫状况的评价. 由此可知血清总IgG在ESCC血清的变化可作为一项可参考的检测标志物. 通过比较GAGE-7自身抗体在血清总IgG中的比例在病患和正常组的不同, 结果差异比单一比较GAGE-7自身抗体含量变化更加明显(P<0.0001), 说明比较单一肿瘤标志物自身抗体在总IgG中的比例是一个更加敏感和准确的方法.
目前, GAGE基因及蛋白的功能尚不明确, 但其表达特性已被看做是较为理想的癌症检测和预后, 监测肿瘤发生和发展, 及复发和治疗状况的指标. 尽管目前尚未用于临床, 但由于GAGE在多种不同组织类型的肿瘤中均有较高表达, 使其在肿瘤免疫治疗的研究中备受关注. 由于肿瘤细胞的特异性, 及GAGE家族各成员结构和功能可能各不相同, 因此将GAGE家族作为高特异性和敏感性的肿瘤诊断标志物以及肿瘤免疫治疗靶位, 还需更加深入和全面的研究.
食管癌是发生在食管上皮组织的恶性肿瘤, 我国是世界食管癌的高发区, 其中发病患者约占全世界发病总数的70%, 严重威胁着人民的健康. 食管鳞状细胞癌较多出现在发展中国家, 也是我国食管癌病发的主要类型. 尽管医疗技术日益先进, 但是总体食管癌患者存活率依然不足30%. 因此, 对于食管鳞状细胞癌的早期准确诊断必不可少.
欧希龙, 副教授, 东南大学中大医院消化科
目前对于食管鳞状细胞癌的诊断中, 肿瘤标志物检测是较为常见且便利的方法. 存在或变量表达可以提示肿瘤的性质、种类, 可辅助诊断肿瘤、分析病程、指导治疗、监测复发或转移、判断预后. 目前一些常用的食管鳞状细胞癌单一标志物的敏感性和特异性依然有待提高. 作为近几年来新发现的抗原家族, GAGE由于单一表达在肿瘤组织中, 使其成为一种潜在的诊断和预后标志物.
张师前等分别在卵巢癌和子宫内膜癌中检测肿瘤特异性抗原MAGE, GAGE, BAGE的表达, 他们认为MAGE, GAGE, BAGE基因在卵巢癌和子宫内膜癌中有较高表达, 其表达与卵巢癌有无淋巴结转移无关, GAGE1-2与子宫内膜癌的分期无关, 与分级有关, 可作为卵巢癌和子宫内膜癌患者免疫治疗的特异性靶点. Eichumller等检测皮肤T细胞淋巴瘤患者血清中GAGE-3至-7相应抗体, 结果15.8% (3/19)的患者血清中检测到抗体的存在, 而在6%黑素瘤患者组织中检测到GAGE-7b重组蛋白的自身免疫抗体.
本文通过原核表达及纯化GAGE-7蛋白, 检测GAGE-7自身抗体在食管鳞状细胞癌患者及正常人血清中的表达差异. 同时, 以患者和对照组血清总IgG作为统一参考, 来平衡各人之间血清表达能力水平的差异, 结果更具科学性.
本文通过对GAGE-7血清中自身抗体的表达检测, 说明GAGE家族在食管鳞状细胞癌有特异性表达, 具有作为肿瘤血清学诊断标志物以及肿瘤免疫治疗靶位的可能性.
本研究具有一定的新颖性, 设计科学合理, 结果可信.
编辑: 李军亮 电编:何基才
| 1. | Parkin DM, Pisani P, Ferlay J. Estimates of the worldwide incidence of 25 major cancers in 1990. Int J Cancer. 1999;80:827-841. [PubMed] [DOI] |
| 2. | Asha G, Vijayalakshmi D, Veerendra Kumar KV. Relationship between risk factors and dietary intake of oesophageal cancer patients. J Hum Ecol. 2005;17:39-42. |
| 3. | Freedman ND, Abnet CC, Leitzmann MF, Mouw T, Subar AF, Hollenbeck AR, Schatzkin A. A prospective study of tobacco, alcohol, and the risk of esophageal and gastric cancer subtypes. Am J Epidemiol. 2007;165:1424-1433. [PubMed] [DOI] |
| 4. | Kashyap MK, Marimuthu A, Kishore CJ, Peri S, Keerthikumar S, Prasad TS, Mahmood R, Rao S, Ranganathan P, Sanjeeviah RC. Genomewide mRNA profiling of esophageal squamous cell carcinoma for identification of cancer biomarkers. Cancer Biol Ther. 2009;8:36-46. [PubMed] |
| 5. | McCann J. Esophageal cancers: changing character, increasing incidence. J Natl Cancer Inst. 1999;91:497-498. [PubMed] [DOI] |
| 6. | Wakatsuki M, Suzuki Y, Nakamoto S, Ohno T, Ishikawa H, Kiyohara H, Kiyozuka M, Shirai K, Nakayama Y, Nakano T. Clinical usefulness of CYFRA 21-1 for esophageal squamous cell carcinoma in radiation therapy. J Gastroenterol Hepatol. 2007;22:715-719. [PubMed] |
| 7. | Shimada H, Takeda A, Arima M, Okazumi S, Matsubara H, Nabeya Y, Funami Y, Hayashi H, Gunji Y, Suzuki T. Serum p53 antibody is a useful tumor marker in superficial esophageal squamous cell carcinoma. Cancer. 2000;89:1677-1683. [PubMed] [DOI] |
| 8. | Yamabuki T, Daigo Y, Kato T, Hayama S, Tsunoda T, Miyamoto M, Ito T, Fujita M, Hosokawa M, Kondo S. Genome-wide gene expression profile analysis of esophageal squamous cell carcinomas. Int J Oncol. 2006;28:1375-1384. [PubMed] |
| 9. | Old LJ. Cancer/testis (CT) antigens - a new link between gametogenesis and cancer. Cancer Immun. 2001;1:1. [PubMed] |
| 10. | Boon T, Coulie PG, Van den Eynde B. Tumor antigens recognized by T cells. Immunol Today. 1997;18:267-268. [PubMed] [DOI] |
| 11. | Hutter H, Dohr G. HLA expression on immature and mature human germ cells. J Reprod Immunol. 1998;38:101-122. [PubMed] [DOI] |
| 12. | Van den Eynde B, Peeters O, De Backer O, Gaugler B, Lucas S, Boon T. A new family of genes coding for an antigen recognized by autologous cytolytic T lymphocytes on a human melanoma. J Exp Med. 1995;182:689-698. [PubMed] [DOI] |
| 13. | De Backer O, Arden KC, Boretti M, Vantomme V, De Smet C, Czekay S, Viars CS, De Plaen E, Brasseur F, Chomez P. Characterization of the GAGE genes that are expressed in various human cancers and in normal testis. Cancer Res. 1999;59:3157-3165. [PubMed] |
| 14. | Chen ME, Lin SH, Chung LW, Sikes RA. Isolation and characterization of PAGE-1 and GAGE-7. New genes expressed in the LNCaP prostate cancer progression model that share homology with melanoma-associated antigens. J Biol Chem. 1998;273:17618-17625. [PubMed] [DOI] |
| 15. | Scarcella DL, Chow CW, Gonzales MF, Economou C, Brasseur F, Ashley DM. Expression of MAGE and GAGE in high-grade brain tumors: a potential target for specific immunotherapy and diagnostic markers. Clin Cancer Res. 1999;5:335-341. [PubMed] |
| 16. | Cheung IY, Cheung NK, Ghossein RA, Satagopan JM, Bhattacharya S, Coit DG. Association between molecular detection of GAGE and survival in patients with malignant melanoma: a retrospective cohort study. Clin Cancer Res. 1999;5:2042-2047. [PubMed] |
| 17. | Gjerstorff MF, Ditzel HJ. An overview of the GAGE cancer/testis antigen family with the inclusion of newly identified members. Tissue Antigens. 2008;71:187-192. [PubMed] [DOI] |
| 18. | Eichmüller S, Usener D, Thiel D, Schadendorf D. Tumor-specific antigens in cutaneous T-cell lymphoma: expression and sero-reactivity. Int J Cancer. 2003;104:482-487. [PubMed] [DOI] |
| 19. | Anderson KS, LaBaer J. The sentinel within: exploiting the immune system for cancer biomarkers. J Proteome Res. 2005;4:1123-1133. [PubMed] [DOI] |
| 20. | Hanash S. Harnessing immunity for cancer marker discovery. Nat Biotechnol. 2003;21:37-38. [PubMed] [DOI] |
| 21. | Fearon ER, Cho KR, Nigro JM, Kern SE, Simons JW, Ruppert JM, Hamilton SR, Preisinger AC, Thomas G, Kinzler KW. Identification of a chromosome 18q gene that is altered in colorectal cancers. Science. 1990;247:49-56. [PubMed] [DOI] |
| 22. | Burnett PR, VanCott TC, Polonis VR, Redfield RR, Birx DL. Serum IgA-mediated neutralization of HIV type 1. J Immunol. 1994;152:4642-4648. [PubMed] |
| 24. | Peng XX, Wainberg MA, Tao Y, Brenner BG. Immunoglobulin and complement complexes in blood following infection with human immunodeficiency virus type 1. Clin Diagn Lab Immunol. 1996;3:128-131. [PubMed] |
| 25. | Brinkmann U, Vasmatzis G, Lee B, Pastan I. Novel genes in the PAGE and GAGE family of tumor antigens found by homology walking in the dbEST database. Cancer Res. 1999;59:1445-1448. [PubMed] |
| 26. | Cilensek ZM, Yehiely F, Kular RK, Deiss LP. A member of the GAGE family of tumor antigens is an anti-apoptotic gene that confers resistance to Fas/CD95/APO-1, Interferon-gamma, taxol and gamma-irradiation. Cancer Biol Ther. 2002;1:380-387. [PubMed] |
| 27. | Scanlan MJ, Gordon CM, Williamson B, Lee SY, Chen YT, Stockert E, Jungbluth A, Ritter G, Jäger D, Jäger E. Identification of cancer/testis genes by database mining and mRNA expression analysis. Int J Cancer. 2002;98:485-492. [PubMed] [DOI] |
| 29. | 吴 喜梅, 张 师前, 周 晓亮, 石 琰. 肿瘤特异性抗原MAGE, BAGE, GAGE在子宫内膜癌组织中表达的研究. 山东大学学报(医学版). 2006;44:1004-1007. |
| 30. | 张 师前, 周 晓亮, 张 琳琳, 吴 喜梅, 石 琰. 卵巢癌组织及细胞株中肿瘤特异性抗原MAGE, GAGE, BAGE基因表达的研究. 山东大学学报(医学版). 2007;45:762-766. |
| 31. | Bazhin AV, Wiedemann N, Schnölzer M, Schadendorf D, Eichmüller SB. Expression of GAGE family proteins in malignant melanoma. Cancer Lett. 2007;251:258-267. [PubMed] [DOI] |