修回日期: 2010-03-01
接受日期: 2010-03-09
在线出版日期: 2010-04-08
目的: 探讨外源性干细胞因子(stem cell factor, SCF)对糖尿病(diabetes mellitus, DM)小鼠小肠动力障碍时小肠平滑肌细胞慢波的影响.
方法: ♂Balb/c小鼠一次性腹腔注射(ip)链脲佐菌素(STZ, 150 mg/kg)造模, 将小鼠分为正常组、DM组、DM+外源性SCF组(DM+SCF组); DM+SCF组ip SCF 0.20 µg/(kg•d), 正常组和DM组每天ip等量的磷酸盐缓冲液(pH7.40). 所有小鼠干预6 wk结束后, 给予印度墨水灌胃测定小肠传输速率, 用微电极细胞内记录仪记录各组小鼠十二指肠平滑肌细胞内慢波的变化.
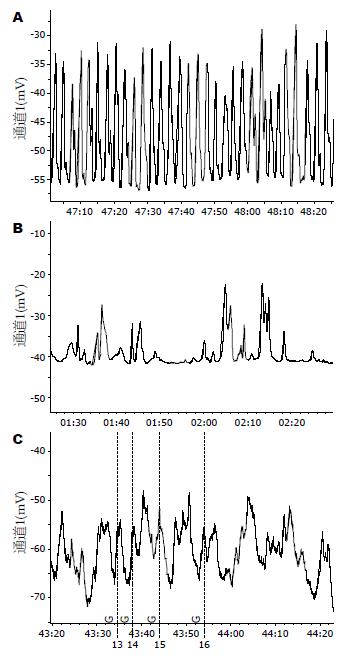
结果: DM组小肠推进率比正常组的明显降低(44.05%±5.48% vs 82.75%±6.56%, P<0.01); DM+SCF组比DM组的小肠推进率显著增加(75.89%±3.61% vs 44.05%±5.48%, P<0.01), 但比正常组的降低(75.89%±3.619% vs 82.75%±6.56%, P<0.05); DM组与正常小鼠相比, 十二指肠平滑肌细胞内慢波频率明显减慢(13.33±4.27 vs 30.67±3.33, P<0.01), 波幅明显减小(15.17±3.71 vs 35.17±3.71, P<0.01), 且波形杂乱不规则. DM+SCF组小鼠十二指肠平滑肌细胞内慢波频率和波幅比DM组增加(26.50±1.87 vs 13.33±4.27; 27.50±2.26 vs 15.17±3.71, 均P<0.01), 但比正常组减慢和降低(26.50±1.87 vs30.67±3.33, P<0.05; 27.50±2.26 vs 35.17±3.71, P<0.01).
结论: 外源性SCF对DM小鼠的小肠动力障碍有一定的改善作用.
引文著录: 杨琰, 余跃, 高显奎, 陈军, 王巧民. 干细胞因子对糖尿病小鼠小肠平滑肌细胞慢波的影响. 世界华人消化杂志 2010; 18(10): 993-997
Revised: March 1, 2010
Accepted: March 9, 2010
Published online: April 8, 2010
AIM: To explore the effects of stem cell factor (SCF) on the slow waves in duodenal smooth muscle of diabetic mice.
METHODS: Diabetes mellitus (DM) was induced in Balb/c male mice by intraperitoneal injection of streptozotocin (STZ, 150 mg/kg, ip). Mice were then divided into three groups (n = 6 per group): normal control group, DM model group and SCF treatment group. The SCF treatment group was given SCF 0.20 µg/(kg•d, ip), while the normal control group and DM model group were given equal volume of phosphate buffer solution (pH7.40). After six weeks of intervention, all the mice were given Indian ink for determination of the small intestinal transit rate. The changes in the slow waves in duodenal smooth muscle were recorded.
RESULTS: Small intestine transit rate was significantly reduced in the DM model group when compared with the normal control group (44.05% ± 5.48% vs 82.75% ± 6.56%, P < 0.01). Small intestine transit rate in the SCF treatment group was significantly higher than that in the DM model group (75.89% ± 3.61% vs 44.05% ± 5.48%, P < 0.01), but lower than that in the normal control group (75.89% ± 3.61% vs 82.75% ± 6.56%, P < 0.05). Compared with the normal control group, the frequency and amplitude of slow waves in duodenal smooth muscle were significantly reduced in the DM model group (13.33 ± 4.27 vs 30.67 ± 3.33 and 5.17 ± 3.71 vs 35.17 ± 3.71, respectively; both P < 0.01). The frequency and amplitude of slow waves in duodenal smooth muscle in the SCF treatment group were significantly higher than those in the DM model group (26.50 ± 1.87 vs 13.33 ± 4.27 and 27.50 ± 2.26 vs 15.17 ± 3.71, respectively; both P < 0.01), but lower than those in the normal control group (26.50 ± 1.87 vs 30.67 ± 3.33, P < 0.05; 27.50 ± 2.26 vs 35.17 ± 3.71, P < 0.01).
CONCLUSION: Exogenous SCF is able to improve duodenal motility in diabetic mice.
- Citation: Yang Y, Yu Y, Gao XK, Chen J, Wang QM. Effects of stem cell factor on the slow waves in intestinal smooth muscle of diabetic mice. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 993-997
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/993.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.993
胃肠动力障碍是糖尿病(diabetes mellitus, DM)患者的常见并发症之一, 其机制尚不清楚, 近年来研究认为[1], Cajal间质细胞(interstitial cells of Cajal, ICC)是胃肠道的起搏细胞, ICC异常会影响平滑肌细胞内的慢波, 从而影响平滑肌正常的收缩运动, 导致整个胃肠动力障碍. 干细胞因子(stem cell factor, SCF)是ICC特异性标志物Kit受体的天然配体, 对ICC的增殖、分化和维持具有重要作用[2], 但对胃肠平滑肌慢波的影响国内外鲜见报道. 本研究通过记录DM小鼠十二指肠平滑肌细胞内慢波的变化, 以及外源性SCF干预后慢波的变化, 旨在明确外源性SCF能否改善DM小鼠小肠动力障碍.
Balb/c小鼠, ♂, 体质量18-22 g, 由安徽医科大学动物实验中心提供. 链脲佐菌素(streptozocin, STZ, Sigma, 美国), SCF(Sigma, 美国), 精蛋白锌胰岛素注射液(江苏万邦生化医药股份有限公司), 印度墨水(Solarbio cat, No.18060), 血糖仪(ACCU-CHEK, Active, 德国), 血糖试纸(ACCU-CHEK, 德国), 电极管(FHC, BOWDOINHAM, ME04008, 美国), 微电极拉制仪(NARISHIGE, 日本), 细胞内电流记录仪(Intra 767, 美国), 计算机信号采集分析系统(Powerlab/4sp, Australia), 微操仪(MC1000e, Controller, serial No.S1411).
1.2.1 建立DM小鼠模型、分组及干预: 实验小鼠予一次性ip STZ(150 mg/kg)造模[3,4], 72 h后及1 wk后尾静脉采血, 2次随机血糖均≥12 mmol/L者为DM小鼠模型建立, 不符合条件者予以剔除. 将实验小鼠分为正常组(n = 6)、DM组(n = 6)和DM+外源性SCF干预组(DM+SCF组, n = 6). 干预(共6 wk): DM+SCF组给予SCF ip[0.20 µg/(kg•d)][5], 正常组和DM组每天ip等量的磷酸盐缓冲液(pH7.40), 6 wk结束.
1.2.2 一般状况: 造模成功后观察饮食、饮水、粪便, 毛色及精神情况, 每周称质量.
1.2.3 血糖值测定: 干预6 wk后各组小鼠测定血糖值.
1.2.4 小肠推进速率测定: 各组小鼠处死前予印度墨水10 mL/kg灌胃, 30 min后处死, 取出全胃肠道, 计算无张力下小肠推进率(墨水前端至幽门括约肌距离/小肠全长×100%)[6].
1.2.5 十二指肠平滑肌细胞内慢波记录: 开启稳压电源(220 V), 检查电路连线, 依次打开计算机、放大器、Powerlab信号采集系统, 仪器预热半小时, 电脑、灌流槽等妥善接地. 将小鼠脱臼处死, 剖腹迅速在靠近幽门处剪取1-2 cm的十二指肠肠段, 沿纵轴剖开肠管, 在装有Krebs液的烧杯内去除胃肠内容物. 将组织浆膜层面朝上平铺并固定于灌流槽中, 打开温水浴(37 ℃), 充氧, 打开灌流液开始灌流, 用镊子小心剥掉浆膜层, 待组织标本稳定1 h后, 用微操仪将充满KCl(3 mol/L)的微电极插入标本. 微电极拉制的电阻30-50 MΩ.
统计学处理 数据均以mean±SD表示, 应用 SPSS17.0统计软件进行处理, 多组资料间比较采用LSD检验分析, P<0.05为差异有统计学意义.
造模成功后, DM小鼠出现多饮, 多食, 多尿, 消瘦, 精神萎靡, 行动迟缓, 毛色干枯, 无光泽. 干预6 wk后, DM+SCF组比DM组的多饮, 多食, 多尿症状减轻, 体质量明显增加(P<0.01), 精神状态好转, DM+SCF组体质量比正常组的降低(P<0.01, 表1).
第6周DM组的血糖值显著高于正常组(P<0.01). DM+SCF组比DM组的血糖值显著降低(P<0.01), 但比正常组的升高(P<0.05, 表1).
DM组的推进率比正常组的明显降低(44.05%±5.45% vs 82.75%±6.56%, P<0.01); DM+SCF组比DM组的推进率显著增加(75.89%±3.61% vs 44.05%±5.48%, P<0.01), 但比正常组的降低(75.89%±3.61% vs 82.75%±6.56%,P<0.05).
胃肠动力障碍是临床常见的DM慢性并发症之一. DM患者中, 胃肠动力障碍的发病率为25%-76%[7]. DM胃肠动力障碍的病理生理特点是: 胃肠张力和收缩力低下、蠕动减慢、排空延迟[8], 其机制尚不清楚.
ICC是胃肠道运动起搏细胞, 且介导神经递质的产生和作用[9,10], ICC特异性表达酪氨酸激酶受体c-Kit, 其配体SCF[11]已被证实对ICC具有重要调控作用[12,13]. Kit是一种酪氨酸激酶受体, 而SCF是c-Kit受体的天然配体, 他与Kit结合组成Kit-SCF信号系统, 激活酪氨酸激酶, 导致一系列磷酸化过程. Kit-SCF信号系统参与了机体所有Kit阳性细胞的发育、分化、增殖等过程[14,15], 同样也与ICC的生长发育、形态及功能的维持关系密切[2,12].
胃肠ICC网络通过众多缝隙连接给邻近平滑肌细胞提供电流及起搏活动. 当ICC发出慢波, 通过缝隙连接传播至平滑肌细胞, 激活平滑肌细胞, 产生动作电位, 引起平滑肌收缩. 周吕、柯美云曾在《神经胃肠病学与动力》[16]中记录到胃肠道平滑肌的静息电位很不稳定, 波动较大, 其实测值一般为(-40 mV)-(-80 mV). 研究显示[17], 正常小鼠小肠ICC与平滑肌细胞慢波的频率一致, ICC慢波的波幅大于50 mV, 平滑肌细胞慢波的波幅一般在20-35 mV, 最大不超过50 mV. ICC异常可致胃肠道起搏功能和电兴奋传导减弱, 使平滑肌产生不规则慢波、收缩运动障碍、蠕动减少, 最终导致临床上出现胃肠动力障碍症状.
本研究发现, DM组的推进率比正常组的明显降低(P<0.01); DM+SCF组比DM组的推进率显著增加(P<0.01), 但比正常组的降低(P<0.05); 表明SCF能改善小肠动力, 促进小肠传输. 进一步观察到, DM组的频率比正常组的显著降低(P<0.01); DM+SCF组比DM组的频率显著增加(P<0.01), 但比正常组的降低(P<0.05); DM组的波幅比正常组的明显降低(P<0.01); DM+SCF组比DM组的波幅显著增加(P<0.01), 但比正常组的降低(P<0.01). 提示SCF通过改善小肠平滑肌的慢波活动来恢复正常的小肠运动, 这与国内外文献一致[18-20].
Ordög等[18]用c-Kit免疫染色揭示, DM小鼠模型中,胃体和胃窦部的ICC明显减少, 并以胃窦远端最为明显. 其肌间神经丛、环形肌和纵行肌内的ICC所占比例由11.2%±0.6%, 15.7%±2.1%, 17.0%±1.8%降至5.5%±0.4%, 7.7%±2.1%, 7.2%±2.6%. 表明ICC明显减少, Kit-SCF信号系统破坏, 与DM小鼠胃肠动力障碍密切相关.
还有大量实验表明, ICC可产生自发性的电活动, 而消除ICC, 则慢波电位不能产生. Koh等[19]在分离培养的小鼠小肠ICC上用膜片钳技术记录出有节律性、规则的慢波样去极化波形, 慢波样波宽度与波形均与肌条上记录的慢波相似. 当新生大鼠ICC网络结构发育不成熟时, 记录不到规律的电节律, 而当平滑肌的ICC网络基本形成, 就可记录到完整的自发的慢波电位. 在W/W(V)突变种鼠小肠[20], 干细胞突变型使鼠肠肌丛ICC不能发育因而缺乏起搏活动, 没有自发慢波和负载于其上的动作电位. 因而我们推测外源性SCF可能通过修复Kit-SCF信号系统, 改善小肠平滑肌的慢波活动, 进而恢复正常的小肠运动.
本研究证实了糖尿病小鼠确实存在胃肠动力障碍, 外源性SCF对DM小鼠小肠动力障碍有一定的改善作用. 本研究提示外源性SCF可能为临床治疗DM胃肠动力障碍提供新的理论依据, 其具体的机制有待于进一步研究.
胃肠动力障碍是糖尿病常见的慢性并发症之一, 深入研究胃肠动力障碍的机制, 并针对此寻求有效的治疗措施成为当今研究的重点.
陆伦根, 教授, 上海交通大学附属第一人民医院消化科
近些年, 干细胞因子在Cajal间质细胞以及胃肠动力障碍中的病理机制成为研究热点.
Koth等的研究揭示出只有当ICC网络发育成熟时才可以记录到完整的慢波电位, 而ICC的生长发育、形态及功能的维持与SCF密切相关, 因此SCF正是通过改善ICC进而改善小肠平滑肌的慢波活动.
应用外源性干细胞因子对平滑肌细胞慢波进行干预, 结果显示外源性干细胞因子对糖尿病小鼠的小肠动力障碍有一定的改善作用.
本研究可能为临床治疗糖尿病胃肠动力障碍提供新的理论依据.
本研究选题较好, 设计合理, 结论有一定参考价值.
编辑: 李军亮 电编:何基才
| 1. | Battaglia E, Bassotti G, Bellone G, Dughera L, Serra AM, Chiusa L, Repici A, Mioli P, Emanuelli G. Loss of interstitial cells of Cajal network in severe idiopathic gastroparesis. World J Gastroenterol. 2006;12:6172-6177. [PubMed] |
| 2. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 3. | Kitayama J, Faraci FM, Gunnett CA, Heistad DD. Impairment of dilator responses of cerebral arterioles during diabetes mellitus: role of inducible NO synthase. Stroke. 2006;37:2129-2133. [PubMed] [DOI] |
| 4. | Yu X, Tesiram YA, Towner RA, Abbott A, Patterson E, Huang S, Garrett MW, Chandrasekaran S, Matsuzaki S, Szweda LI. Early myocardial dysfunction in streptozotocin-induced diabetic mice: a study using in vivo magnetic resonance imaging (MRI). Cardiovasc Diabetol. 2007;6:6. [PubMed] [DOI] |
| 6. | 许 东强, 余 保平, 高 山, 王 玮. 便秘宁对便秘小鼠排便作用的影响. 胃肠病学和肝病学杂志. 2006;15:295-296. |
| 7. | Icks A, Haastert B, Rathmann W, Wareham N. Prevalence of gastrointestinal symptoms in patients with type 2 diabetes: a population-based study. Arch Intern Med. 2002;162:1067-1069; author reply 1069. [PubMed] [DOI] |
| 8. | Jung HK, Kim DY, Moon IH, Hong YS. Colonic transit time in diabetic patients--comparison with healthy subjects and the effect of autonomic neuropathy. Yonsei Med J. 2003;44:265-272. [PubMed] |
| 9. | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine. Am J Physiol Cell Physiol. 2005;288:C710-C720. [PubMed] [DOI] |
| 10. | Wang XY, Sanders KM, Ward SM. Intimate relationship between interstitial cells of cajal and enteric nerves in the guinea-pig small intestine. Cell Tissue Res. 1999;295:247-256. [PubMed] [DOI] |
| 11. | Wu JJ, Rothman TP, Gershon MD. Development of the interstitial cell of Cajal: origin, kit dependence and neuronal and nonneuronal sources of kit ligand. J Neurosci Res. 2000;59:384-401. [PubMed] [DOI] |
| 12. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 13. | Torihashi S, Nishi K, Tokutomi Y, Nishi T, Ward S, Sanders KM. Blockade of kit signaling induces transdifferentiation of interstitial cells of cajal to a smooth muscle phenotype. Gastroenterology. 1999;117:140-148. [PubMed] [DOI] |
| 14. | Li J, Goodyer CG, Fellows F, Wang R. Stem cell factor/c-Kit interactions regulate human islet-epithelial cluster proliferation and differentiation. Int J Biochem Cell Biol. 2006;38:961-972. [PubMed] [DOI] |
| 15. | Bashamboo A, Taylor AH, Samuel K, Panthier JJ, Whetton AD, Forrester LM. The survival of differentiating embryonic stem cells is dependent on the SCF-KIT pathway. J Cell Sci. 2006;119:3039-3046. [PubMed] [DOI] |
| 17. | Kito Y, Suzuki H. Effects of temperature on pacemaker potentials in the mouse small intestine. Pflugers Arch. 2007;454:263-275. [PubMed] [DOI] |
| 18. | Ordög T, Takayama I, Cheung WK, Ward SM, Sanders KM. Remodeling of networks of interstitial cells of Cajal in a murine model of diabetic gastroparesis. Diabetes. 2000;49:1731-1739. [PubMed] [DOI] |