修回日期: 2010-02-07
接受日期: 2010-02-23
在线出版日期: 2010-04-08
目的: 探讨姜黄素对大鼠肝脏缺血再灌注早期损伤微循环的影响.
方法: 将大鼠随机分为假手术组、对照组和实验组(姜黄素40 mg/kg, 2次给药). 通过检测再灌注早期1、3 h血清转氨酶水平、肝组织中一氧化氮(nitricoxide, NO)、一氧化氮合酶(nitricoxide synthase, NOS), 诱导型一氧化氮合酶(inducible nitricoxide synthase, iNOS)mRNA及内皮型一氧化氮合酶(endothelium nitricoxide synthase, eNOS) mRNA水平, 以及肝组织病理学检查来评价姜黄素对大鼠肝脏缺血再灌注早期损伤微循环的影响.
结果: 相对于对照组, 姜黄素可降低大鼠肝脏缺血再灌注早期损伤1、3 h血清谷丙转氨酶(ALT)的水平(603.8 U/L±64.5 U/Lvs 758.1 U/L±114.7 U/L, 837.1 U/L±33.3 U/L vs 1012.7 U/L±119.8 U/L, 均P<0.01)和谷草转氨酶(AST)的水平(605.7 U/L±65.7 U/L vs 779.5 U/L±124.3 U/L, 849.6 U/L±36.0 U/L vs 1027.8 U/L±139.8 U/L, 均P<0.01); 改善肝组织病理学损害; 减少肝脏缺血再灌注早期损伤1、3 h肝组织由iNOS产生的NO蛋白水平(0.455±0.056 vs0.594±0.087, 0.492±0.040 vs 0.671±0.079, 均P<0.01); 降低肝脏缺血再灌注早期损伤1、3 h肝组织iNOS mRNA的表达强度(0.426±0.075 vs 0.569±0.073, 0.527±0.066 vs 0.702±0.089, 均P<0.01).
结论: 姜黄素可通过减轻肝组织中由iNOS产生的NO生成, 来改善肝缺血再灌注早期损伤中微循环的紊乱, 从而减少对肝缺血再灌注肝实质细胞的损伤.
引文著录: 向进见, 田夫, 李文岗, 李明忠, 蒋雪峰, 程本静. 姜黄素对大鼠肝缺血再灌注早期肝组织一氧化氮表达的影响. 世界华人消化杂志 2010; 18(10): 987-992
Revised: February 7, 2010
Accepted: February 23, 2010
Published online: April 8, 2010
AIM: To investigate the effects of curcumin on the microcirculation in early-stage ischemia/reperfusion injury in rats.
METHODS: Wistar rats were randomized into three groups: sham-operation group, dimethyl sulfoxide (DMSO) group (treated with 1 mL of DMSO twice) and curcumin group (treated with 40 mg/kg of curcumin twice). The level of serum transaminase, the content of hepatic nitric oxide (NO), and the expression of nitric oxide synthase (NOS), inducible nitric oxide synthase (iNOS) and endothelial nitric oxide synthase (eNOS) mRNAs in liver tissue were determined to evaluate the effects of curcumin on the microcirculation in early-stage ischemia/reperfusion (reperfusion for 1 h and 3 h).
RESULTS: Compared with the DMSO group, curcumin decreased the levels of serum alanine transaminase (603.8 U/L ± 64.5 U/L vs 758.1 U/L ± 114.7 U/L and 837.1 U/L ± 33.3 U/L vs 1012.7 U/L ± 119.8 U/L, respectively; both P < 0.01) and aspartate aminotransferase (605.7 U/L ± 65.7 U/L vs 779.5 U/L ± 124.3 U/L and 849.6 U/L ± 36.0 U/L vs 1027.8 U/L ± 139.8 U/L, respectively; both P < 0.01), relieved hepatic pathological damage, reduced the content of NO (0.455 ± 0.056 vs 0.594 ± 0.087 and 0.492 ± 0.040 vs 0.671 ± 0.079, respectively; both P < 0.01) derived from iNOS, and down-regulated the expression of iNOS mRNA (0.426 ± 0.075 vs 0.569 ± 0.073 and 0.527 ± 0.066 vs 0.702 ± 0.089, respectively; both P < 0.01) in the liver tissue in early-stage ischemia/reperfusion (reperfusion for 1 h and 3 h).
CONCLUSION: Curcumin can relieve hepatic cell injury by decreasing the content of NO derived from iNOS and reducing hepatic microcirculation disturbance in early-stage ischemia/reperfusion injury in rats.
- Citation: Xiang JJ, Tian F, Li WG, Li MZ, Jiang XF, Cheng BJ. Curcumin reduces hepatic nitric oxide production in early-stage ischemia/reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 987-992
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/987.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.987
一氧化氮(nitricoxide, NO)是一种具有多种生物活性的小分子物质, 参与多种生理及病理过程, 他与肝缺血再灌注(hepatic ischemia reperfusion, HIR)损伤密切相关. 本研究从肝组织NO、一氧化氮合酶(nitricoxide synthase, NOS)及NOS mRNA水平的改变来探讨姜黄素(curcumin)对大鼠实验性HIR早期损伤微循环的影响.
SPF级SD大鼠, 雌雄不限, 体质量240 g±20 g, 购于武汉大学人民医院动物室; 姜黄素购于美国Sigma公司; 二甲基亚砜(dimethyl sulfoxide, DMSO)购于武汉天源生物有限公司; 一氧化氮试剂盒、一氧化氮合酶试剂盒和考马斯亮蓝蛋白测定试剂盒购于南京建成生物工程公司; 根据美国国立图书馆NCBI中GenBank提供的诱导型一氧化氮合酶(inducible nitricoxide synthase, iNOS)、内皮型一氧化氮合酶(endothelium nitricoxide synthase, eNOS)和三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)三者cDNA序列, 参照相关文献由上海赛百盛公司合成下列引物序列, 其中iNOS生产编号: 0517-07, eNOS生产编号: 0830-01, GAPDH生产编号: 0517-05; iNOS上游引物为TTCTTTGCTTCTGTGCTAATGCG, 下游引物为GTTGTTGCTGAACTTCCAATCGT, 扩增长度1 061 bp; eNOS上游引物为TGGGCAG CATCACCTACGATA, GGAACCACTCCTTTTGATCGAGTTAT, 扩增长度202 bp; GAPDH上游引物为TCCCTCAAGATTGTCAGCAA, 下游引物AGATCCACAACGGATACATT, 扩增长度309 bp.
1.2.1 HIR模型的建立: 大鼠术前12 h禁食, 不禁水. 腹腔内注射20%乌拉坦溶液5 mL/kg麻醉, 然后上腹部正中切口开腹, 分离门静脉和肝动脉主干、左右分支和肠系膜上静脉. 经肠系膜上静脉分支插管, 用小血管夹夹闭肝左中叶脉管以阻断左中叶血供, 造成左中叶肝缺血. 1 h后松开小血管夹, 恢复血流, 形成再灌注. 操作过程中所有动物注意保温且经插管注射37 ℃生理盐水8 mL/kg, 以保持血液动力学的稳定.
1.2.2 分组: 将48只大鼠按随机数字表随机分为假手术组、对照组和实验组. 假手术组不给药, 除不夹闭肝左中叶脉管外, 手术过程同上述模型. 对照组分别于左中肝血流阻断前30 min和再灌注开始时经肠系膜上静脉分支插管注入DMSO 1 mL, 同样情况下, 实验组按姜黄素40 mg/kg量溶于DMSO 1 mL注入.
1.2.3 标本收集: (1)假手术组开腹及游离血管后1 h(n = 8)、3 h(n = 8)取肝左中叶于-70 ℃冰箱保存待用, 同时经肝上下腔静脉取血2 mL, 离心, 取血清, 置4 ℃冰箱备用; (2)对照组和实验组肝脏再灌注1 h(n = 8)、3 h(n = 8)取肝左中叶于-70 ℃冰箱保存待用, 同时经肝上下腔静脉取血2 mL后离心, 取血清, 置4 ℃冰箱备用.
1.2.4 指标检测: 血清谷丙转氨酶(alanine transarninase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)含量由医院检验科检测. 取适量肝组织制成10%匀浆, 再取适量10%匀浆与生理盐水按1:9稀释成1%匀浆, 分别用于测定NO、NOS与总蛋白质含量. NO、NOS及总蛋白含量均按试剂盒说明测定. 采用RT-PCR法检测肝组织中的iNOS mRNA、eNOS mRNA含量.
统计学处理 所有数据以mean±SD表示, 用SPSS10.0软件进行统计学分析. 组间比较采用One-way ANOVA法, 其中两组间比较采用S-N-K法.
对照组1、3 h血清ALT、AST含量较假手术组明显升高(P<0.01, 表1), 实验组1、3 h血清ALT、AST含量低于对照组, 有统计学差异(P<0.01, 表1).
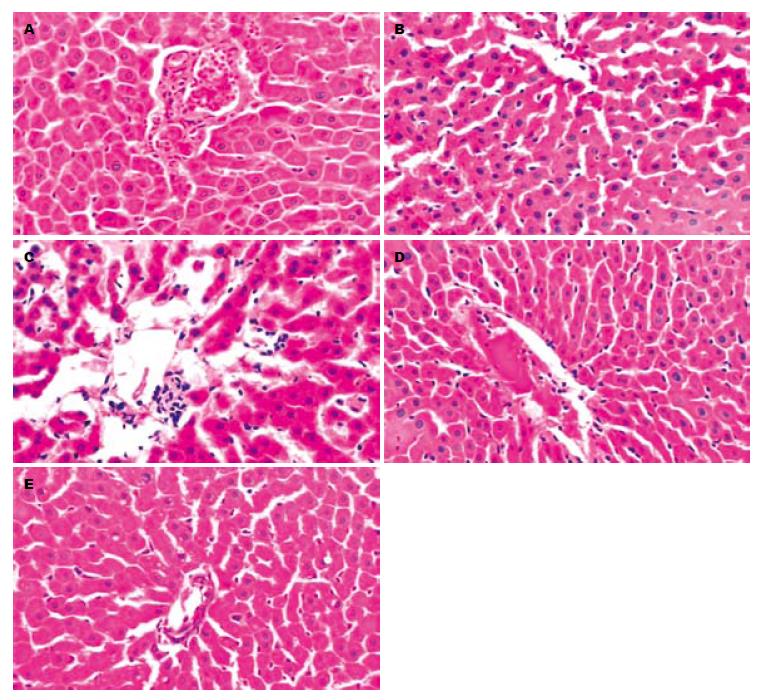
假手术组1、3 h肝组织HE染色结果类似(图1A), 可见肝索排列整齐, 肝窦形态正常, 无狭窄与扩张, 肝细胞边界清楚、形态正常. 对照组1 h肝组织肝索排列部分紊乱, 肝窦扩张明显, 部分肝细胞边界不清、空泡变性(图1B); 对照组3 h肝组织肝索排列明显紊乱, 肝窦形态不规则, 部分内皮细胞脱落, 有少量中性粒细胞浸润, 可见少量肝细胞核消失(图1C). 实验组1、3 h肝组织肝索排列尚整齐; 但可见肝窦轻度扩张, 3 h组扩张较1 h组明显; 肝细胞边界形态尚清楚、正常; 未见中性粒细胞浸润(图1D, E).
姜黄素对大鼠实验性HIR 1、3 h肝组织NO及NOS水平的影响见表2.
| 假手术组 | 对照组 | 实验组 | F值 | |
| NO(μmol/g·prot) | ||||
| 1 h | 0.48±0.04 | 0.38±0.03a | 0.30±0.05cb | 38.292 |
| 3 h | 0.47±0.03 | 0.29±0.04c | 0.25±0.03cb | 95.428 |
| TNOS(U/mg·prot) | ||||
| 1 h | 0.409±0.068 | 0.712±0.111c | 0.526±0.057cb | 28.247 |
| 3 h | 0.408±0.075 | 0.754±0.069c | 0.565±0.062cd | 50.720 |
| iNOS(U/mg·prot) | ||||
| 1 h | 0.333±0.050 | 0.594±0.087c | 0.455±0.056cd | 31.015 |
| 3 h | 0.337±0.033 | 0.671±0.079c | 0.492±0.040cd | 75.343 |
| eNOS(U/mg·prot) | ||||
| 1 h | 0.081±0.010 | 0.081±0.013 | 0.083±0.011 | 0.056 |
| 3 h | 0.083±0.010 | 0.078±0.009 | 0.087±0.013 | 1.351 |
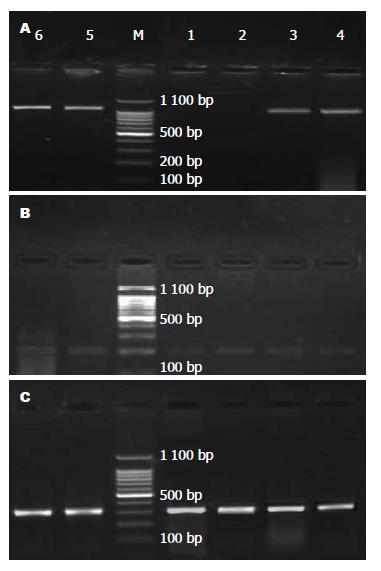
假手术组1、3 h肝组织中iNOS mRNA无表达; 实验组1、3 h均低于对照组肝组织中iNOS mRNA表达, 差异有统计学意义(P<0.01, 表3, 图2). 假手术组、对照组和实验组1、3 h肝组织中eNOS mRNA表达无明显区别, 差异无统计学意义(P>0.05, 表3, 图2).
HIR损伤常存在于肝切除、肝移植术、外伤和休克中, 可造成肝脏功能的损害. HIR损伤主要由肝脏微循环障碍引起[1]. 肝缺血再灌注损伤又包括肝早期缺血再灌注损伤(再灌注6 h内, 主要在前2 h内)和肝晚期再灌注损伤(再灌注6 h以后, 主要在18-24 h)[2-4]. 在肝脏早期(<6 h)缺血再灌注损伤中, 肝脏微循环障碍主要因收缩和舒张血管的物质产生不平衡引起. 目前研究在HIR损伤中起作用的收缩和舒张血管的物质主要包括NO、ET、CO、前列腺素E1(prostaglandin E-1, PGE-1)等[5,6]. NO对HIR损伤中微循环的调节起着重要的作用. NOS在机体内有3种异构酶: iNOS、cNOS/eNOS和nNOS, 肝脏中主要存在前两种. 目前认为NO在HIR中作用取决于生成NO的NOS的类型、部位和酶的活性有关. 一般认为在iNOS作用下产生的NO对肝脏有损害作用, 而在eNOS作用下产生的NO对肝脏有保护作用[6-8].
本实验对照组相对于假手术组, 肝组织中的总NOS(TNOS)含量增加, 但NO含量下降, 这是因为在肝脏缺血低氧状态下, 肝组织中NO合成所必需的L-Arg酶、NADPH和O2不足导致[9]. 姜黄素是从中药姜黄中提取的酚类化合物, 他不仅可作为色素添加剂, 还有着广泛的药理作用: 抗炎[10,11]、抗氧化[12,13]、抗突变[14]、抗血小板聚集[15]、降血脂[16]、抗动脉粥样硬化[17]和抗肿瘤[18-20]等. 有实验表明姜黄素可抑制由脂多糖激活的小胶质细胞iNOS的表达[21]. Chan等[22]研究口服(92 mg/kg)姜黄素对脂多糖(lipopolysaccharide, LPS)诱导的小鼠肝损害的作用时, 发现其可降低肝脏50%-70% iNOS mRNA的表达. 有研究表明姜黄素对心、肾、脑、肝脏等脏器的缺血再灌注损伤有保护作用[23-27].
本实验研究表明, 姜黄素可抑制大鼠HIR 1、3 h的肝组织中iNOS mRNA表达, 而对eNOS mRNA表达无影响, 从而降低了肝组织中TNOS的含量, 最终导致姜黄素组1、3 h肝组织中的NO水平较对照组水平更低. 本实验说明, 姜黄素通过抑制iNOS所产生的NO, 从而减轻了大鼠早期HIR损伤肝组织微循环紊乱, 进而对大鼠早期HIR损伤肝组织起到了抑制作用.
自20世纪70年代以来, 国内外对姜黄素的药理作用及临床应用方面做了大量研究, 表明其具有抗炎、抗氧化、抗突变、抗血小板聚集、降血脂、抗动脉粥样硬化、抗肿瘤等作用. 姜黄素已应用于心脏、肾、肠、肝和脑等脏器缺血再灌注损伤的研究.
周伟平, 教授, 上海东方肝胆外科医院肝外三科
姜黄素有着广泛的药理作用, 已用于心、脑、肾、肝等脏器缺血再灌注损伤的研究, 但其作用机制仍需要进一步研究.
有实验表明姜黄素可抑制由脂多糖激活的小胶质细胞iNOS的表达. Chan等研究口服(92 mg/kg)姜黄素对脂多糖(LPS)诱导的小鼠肝损害的作用时, 发现其可降低肝脏50%-70% iNOS mRNA的表达.
本研究探讨姜黄素对肝脏诱导型一氧化氮合酶的表达影响, 结果表明姜黄素可降低诱导型一氧化氮合酶的表达, 从而改善了肝缺血再灌注早期损伤中微循环的紊乱.
本研究实验设计合理, 能从机制上初步证实姜黄素对肝脏的保护作用, 有较好的理论价值.
编辑: 李瑞敏 电编:何基才
| 1. | Vollmar B, Glasz J, Leiderer R, Post S, Menger MD. Hepatic microcirculatory perfusion failure is a determinant of liver dysfunction in warm ischemia-reperfusion. Am J Pathol. 1994;145:1421-1431. [PubMed] |
| 2. | Arii S, Teramoto K, Kawamura T. Current progress in the understanding of and therapeutic strategies for ischemia and reperfusion injury of the liver. J Hepatobiliary Pancreat Surg. 2003;10:189-194. [PubMed] [DOI] |
| 3. | Jaeschke H, Smith CV, Mitchell JR. Reactive oxygen species during ischemia-reflow injury in isolated perfused rat liver. J Clin Invest. 1988;81:1240-1246. [PubMed] [DOI] |
| 4. | Jaeschke H, Bautista AP, Spolarics Z, Spitzer JJ. Superoxide generation by Kupffer cells and priming of neutrophils during reperfusion after hepatic ischemia. Free Radic Res Commun. 1991;15:277-284. [PubMed] [DOI] |
| 5. | Fondevila C, Busuttil RW, Kupiec-Weglinski JW. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 2003;74:86-93. [PubMed] [DOI] |
| 6. | Hossain MA, Izuishi K, Maeta H. Effect of short-term administration of prostaglandin E1 on viability after ischemia/reperfusion injury with extended hepatectomy in cirrhotic rat liver. World J Surg. 2003;27:1155-1160. [PubMed] [DOI] |
| 7. | Varadarajan R, Golden-Mason L, Young L, McLoughlin P, Nolan N, McEntee G, Traynor O, Geoghegan J, Hegarty JE, O'Farrelly C. Nitric oxide in early ischaemia reperfusion injury during human orthotopic liver transplantation. Transplantation. 2004;78:250-256. [PubMed] [DOI] |
| 8. | Taniai H, Hines IN, Bharwani S, Maloney RE, Nimura Y, Gao B, Flores SC, McCord JM, Grisham MB, Aw TY. Susceptibility of murine periportal hepatocytes to hypoxia-reoxygenation: role for NO and Kupffer cell-derived oxidants. Hepatology. 2004;39:1544-1552. [PubMed] [DOI] |
| 11. | Lal B, Kapoor AK, Asthana OP, Agrawal PK, Prasad R, Kumar P, Srimal RC. Efficacy of curcumin in the management of chronic anterior uveitis. Phytother Res. 1999;13:318-322. [PubMed] [DOI] |
| 13. | Weber WM, Hunsaker LA, Abcouwer SF, Deck LM, Vander Jagt DL. Anti-oxidant activities of curcumin and related enones. Bioorg Med Chem. 2005;13:3811-3820. [PubMed] [DOI] |
| 14. | Nagabhushan M, Amonkar AJ, Bhide SV. In vitro antimutagenicity of curcumin against environmental mutagens. Food Chem Toxicol. 1987;25:545-547. [PubMed] [DOI] |
| 15. | Srivastava R, Dikshit M, Srimal RC, Dhawan BN. Anti-thrombotic effect of curcumin. Thromb Res. 1985;40:413-417. [PubMed] [DOI] |
| 16. | Rukkumani R, Sri Balasubashini M, Vishwanathan P, Menon VP. Comparative effects of curcumin and photo-irradiated curcumin on alcohol- and polyunsaturated fatty acid-induced hyperlipidemia. Pharmacol Res. 2002;46:257-264. [PubMed] [DOI] |
| 18. | 侯 伟, 覃 华, 刘 南植, 刘 爽, 王 颖, 赵 秋, 田 德安. 姜黄素对缺氧条件下HepG2细胞VEGF表达的影响. 世界华人消化杂志. 2008;16:2234-2238. [DOI] |
| 19. | Kuttan G, Vasudevan DM, Kuttan R. Isolation and identification of a tumour reducing component from mistletoe extract (Iscador). Cancer Lett. 1988;41:307-314. [PubMed] [DOI] |
| 20. | Deeb D, Xu YX, Jiang H, Gao X, Janakiraman N, Chapman RA, Gautam SC. Curcumin (diferuloyl-methane) enhances tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in LNCaP prostate cancer cells. Mol Cancer Ther. 2003;2:95-103. [PubMed] |
| 21. | 杨 开艳, 顾 建兰, 施 建华, 沈 勤. 姜黄素对脂多糖激活的小胶质细胞诱导型一氧化氮合酶表达的抑制作用. 江苏大学学报(医学版). 2007;17:105-110. |
| 22. | Chan MM, Huang HI, Fenton MR, Fong D. In vivo inhibition of nitric oxide synthase gene expression by curcumin, a cancer preventive natural product with anti-inflammatory properties. Biochem Pharmacol. 1998;55:1955-1962. [PubMed] [DOI] |
| 23. | Shahed AR, Jones E, Shoskes D. Quercetin and curcumin up-regulate antioxidant gene expression in rat kidney after ureteral obstruction or ischemia/reperfusion injury. Transplant Proc. 2001;33:2988. [PubMed] [DOI] |
| 24. | Wang Q, Sun AY, Simonyi A, Jensen MD, Shelat PB, Rottinghaus GE, MacDonald RS, Miller DK, Lubahn DE, Weisman GA. Neuroprotective mechanisms of curcumin against cerebral ischemia-induced neuronal apoptosis and behavioral deficits. J Neurosci Res. 2005;82:138-148. [PubMed] [DOI] |
| 25. | Yeh CH, Chen TP, Wu YC, Lin YM, Jing Lin P. Inhibition of NFkappaB activation with curcumin attenuates plasma inflammatory cytokines surge and cardiomyocytic apoptosis following cardiac ischemia/reperfusion. J Surg Res. 2005;125:109-116. [PubMed] [DOI] |
| 26. | Thiyagarajan M, Sharma SS. Neuroprotective effect of curcumin in middle cerebral artery occlusion induced focal cerebral ischemia in rats. Life Sci. 2004;74:969-985. [PubMed] [DOI] |
| 27. | Shen SQ, Zhang Y, Xiang JJ, Xiong CL. Protective effect of curcumin against liver warm ischemia/reperfusion injury in rat model is associated with regulation of heat shock protein and antioxidant enzymes. World J Gastroenterol. 2007;13:1953-1961. [PubMed] |