修回日期: 2010-02-10
接受日期: 2010-02-23
在线出版日期: 2010-04-08
目的: 研究非酒精性脂肪性肝病(NAFLD)大鼠肠上皮细胞中紧密连接蛋白Occludin的表达及与肿瘤坏死因子α(TNF-α)的关系.
方法: 30只♂SD大鼠平均分为2组, 对照组普通饮食, 模型组给予高脂饮食, 喂养12 wk后处死. 模型组肝脏HE染色显示脂肪肝造模成功. 采用放免法检测血清TNF-α水平, 取肝脏组织行免疫组织化学检测TNF-α的表达, 取空肠组织应用免疫组织化学检测肠上皮细胞间紧密连接蛋白Occludin表达并电镜下观察肠上皮细胞间紧密连接部位的变化.
结果: 模型组血清TNF-α水平较对照组明显增高, 差异具有统计学意义(3.21 µg/L±0.45 µg/L vs 2.10 µg/L±0.29 µg/L, t = -6.157, P<0.01). 模型组大鼠肝脏TNF-α阳性物质主要分布在肝细胞的胞质, 呈棕黄色细颗粒状, 而对照组仅个别散在肝细胞阳性. 对照组Occludin蛋白主要沿大鼠空肠黏膜上皮细胞膜的顶端呈线状分布, 而模型组阳性染色较之明显减弱, 呈非连续性分布. 电镜下模型组紧密连接明显短于对照组, 具有显著性差异(0.50 µm±0.21 µm vs 0.78 µm±0.19 µm, P<0.05).
结论: TNF-α可能抑制了空肠上皮细胞中紧密连接蛋白Occludin的表达, 从而破坏了肠黏膜机械屏障, 促进NAFLD的发生及发展.
引文著录: 许腊梅, 孙丹莉, 张予蜀, 张振玉, 李晓翠. 紧密连接蛋白Occludin在非酒精性脂肪肝大鼠肠上皮细胞中的表达及其与TNF-α的关系. 世界华人消化杂志 2010; 18(10): 981-986
Revised: February 10, 2010
Accepted: February 23, 2010
Published online: April 8, 2010
AIM: To investigate the expression of tight junction protein occludin in intestinal epithelial cells and to analyze its relationship with tumor necrosis factor-α (TNF-α) level in rats with nonalcoholic fatty liver disease (NAFLD).
METHODS: Thirty male Sprague-Dawley rats were divided into two groups: control group and model group. The control group was fed a normal diet while the model group was fed a high-fat diet. All the animals were sacrificed after 12 wk of feeding. Hematoxylin & eosin staining of hepatic tissue was performed to confirm if NAFLD was induced successfully. Serum TNF-α level was determined by radioimmunoassay. The expression of TNF-α in hepatic cells and occludin in intestinal epithelial cells was detected by immunohistochemistry. Intestinal epithelial tight junctions were observed by electron microscopy.
RESULTS: Serum TNF-α level in the model group was significantly higher than that in the control group (3.21 µg/L ± 0.45 µg/Lvs 2.10 µg/L ± 0.29 µg/L, t = -6.157, P < 0.01). In the model group, TNF-α was mainly distributed in the cytoplasm of liver cells, presenting with brownish-yellow fine granules, whereas only scattered positive cells were seen in the control group. Immunohistochemistry analysis showed that occludin was localized to the apical region of the intestinal lateral plasma membrane and distributed in a continuous pattern in the control group but significantly down-regulated and distributed in a non-continuous pattern in the model group. Electron microscopy analysis demonstrated that tight junctions were significantly shorter in the model group than in the control group (0.50 µm ± 0.21 µm vs 0.78 µm ± 0.19 µm, P < 0.05).
CONCLUSION: TNF-α may inhibit the expression of tight junction protein occludin in intestinal epithelial cells, which may result in intestinal barrier dysfunction and promote the development and progression of NAFLD.
- Citation: Xu LM, Sun DL, Zhang YS, Zhang ZY, Li XC. Relationship between occludin expression in intestinal epithelial cells and tumor necrosis factor-α level in rats with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 981-986
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/981.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.981
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种获得性代谢性应激相关的肝脏疾病, 以肝实质细胞脂肪变性和脂肪贮积为病理特征, 但无过量饮酒史. 临床上包括单纯性脂肪肝、脂肪性肝炎(non-alcoholic steatohepatitis, NASH)和脂肪性肝硬化三种类型[1]. 患者从单纯性脂肪肝进展为NASH的发生机制尚不明确, 但近年来研究证实, 内毒素(endotoxin, ET)在NASH的发病机制中发挥了重要作用. 单纯性脂肪肝时常已伴有肠道菌群紊乱和/或内毒素血症. 某些细胞因子(如TNF-α)可以诱导肠上皮细胞凋亡[2-4]和细胞间紧密连接蛋白结构及功能的改变[5], 导致肠上皮通透性增加[6], 从而发生细菌移位及内毒素血症, 形成恶性循环[7]. 目前已有研究[8,9]证实, 肝硬化、急性肝功能衰竭等疾病时肠紧密连接蛋白的表达下降, 并与TNF-α有一定相关性, 而关于NAFLD时紧密连接蛋白表达的改变尚未见报道. 本研究在于探讨NAFLD大鼠肠上皮细胞间紧密连接蛋白Occludin的表达及与TNF-α的关系.
SD大鼠30只, ♂, 周龄6-8 wk, 体质量180-220 g, 由南京市江宁区青龙山动物繁殖场提供. 兔抗Occludin多克隆抗体, 美国Zymed公司; 兔抗TNF-α多克隆抗体, 荷兰HBT公司; PV6001兔二步法免疫组织化学试剂盒, 北京中杉金桥公司. TNF-α放免试剂盒, 中国人民解放军总医院科技开发中心放免研究所.
1.2.1 脂肪肝动物模型制备: 适应性喂养1 wk后, 随机平均分为2组: 正常对照组给予普通饲料喂养, 模型组以10%猪油、2%胆固醇、0.5%蛋黄粉、0.2%脱氧胆酸钠及87.3%基础饲料构成的高脂饲料喂养. 两组均自由饮水. 喂养12 wk后处死所有动物. 立即取出肝脏, 滤纸吸干表面水分后称其湿质量, 计算肝指数[肝指数 = (肝湿质量/大鼠体质量)×100]. 取部分肝组织及空肠组织置于40 g/L甲醛中固定制备石蜡标本. 留取部分空肠组织固定于4%戊二醛中, 以备电镜检查.
1.2.2 空肠免疫组织化学染色观察肠上皮紧密连接蛋白Occludin的表达: 石蜡切片常规脱蜡水化, 蛋白酶K 37 ℃消化10 min, PBS冲洗, 兔抗大鼠多克隆Occludin抗体4 ℃过夜, PBS冲洗, 二抗PV6001抗体37 ℃ 30 min, PBS冲洗. DAB显色, 镜下控制显色时间. PBS代替一抗做空白对照.
1.2.3 肝脏免疫组织化学染色观察TNF-α的表达: 石蜡切片脱蜡水化, 取pH6.0柠檬酸盐缓冲液1 500 mL于压力锅中, 大火加热直至沸腾, 将脱蜡水化后的组织切片置于不锈钢架上, 放入已沸腾的缓冲液中, 盖上锅盖, 扣上压力阀, 继续加热至喷汽, 从喷汽开始计时, 2 min后, 压力锅离开热源, 冷却至室温, 取出玻片. PBS冲洗, 兔抗大鼠多克隆TNF-α抗体4 ℃过夜, PBS冲洗, 二抗PV6001抗体37 ℃ 30 min, PBS冲洗. DAB显色, 镜下控制显色时间. PBS代替一抗做空白对照.
统计学处理 采用SPSS11.5软件进行统计分析, 数据采用mean±SD表示. 两组间指标的差异采用t检验.
2.1.1 体质量改变: 实验过程中, 各组大鼠均无死亡, 皮毛光泽度好, 进食饮水可, 活动自如, 对外界刺激反应迅速. 12 wk末模型组大鼠体质量、肝湿质量及肝指数明显增加, 与对照组相比有显著差异(P<0.01, 表1).
| 分组 | 体质量(g) | 肝湿质量(g) | 肝指数 |
| 对照组 | 331.33±30.93 | 8.72±0.67 | 2.64±0.21 |
| 模型组 | 397.06±23.50 | 14.39±1.98 | 3.62±0.43 |
| t值 | -5.076 | -8.134 | -6.061 |
| P值 | 0.008 | 0.001 | 0.002 |
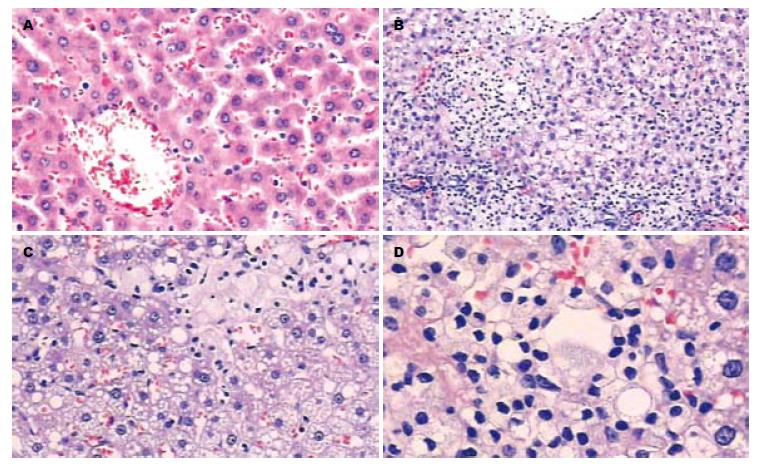
2.1.2 肝脏的病理改变: 肉眼观察, 12 wk处死的对照组大鼠肝脏颜色呈暗红; 模型组大鼠肝脏体积增大, 包膜稍紧张, 边缘圆钝, 呈奶黄色, 有油腻感. 病理切片观察, 对照组: 肝小叶结构清晰, 肝细胞索排列无异常, 肝细胞质呈细密颗粒状, 门管区无炎细胞浸润; 模型组大鼠均呈现脂肪性肝炎状态, 表现为: 肝窦狭窄, 肝细胞肿胀, 胞质内充满大小不等的空泡, 部分肝细胞呈气球样形态, 可见灶状坏死及小叶内炎性细胞浸润. 部分切片可见门管区炎细胞浸润及纤维增多(图1).
模型组血清TNF-α水平较对照组明显增高, 差异具有统计学意义(3.21 µg/L±0.45 µg/L vs 2.10 µg/L±0.29 µg/L, t = -6.157, P<0.01).
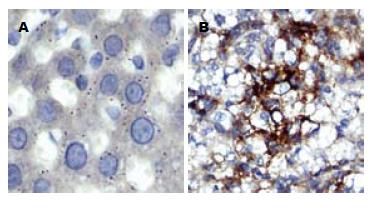
细胞中棕黄色颗粒存在为阳性. 模型组阳性物质主要分布在胞质, 呈棕黄色细颗粒状, 部分浸润单核细胞和少数汇管区. 而对照组仅个别散在肝细胞阳性(图2).
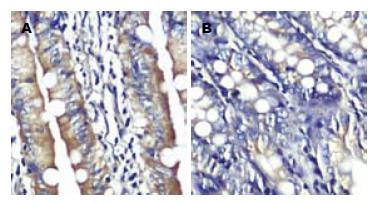
对照组Occludin蛋白主要沿大鼠空肠黏膜上皮细胞膜的顶端呈线状分布, 呈棕褐色信号. 而模型组阳性染色较之明显减弱, 呈非连续性分布, 定位与对照组无显著区别(图3).
对照组电镜下肠黏膜上皮排列规则、紧密, 上皮细胞表面微绒毛丰富, 排列规则, 细胞间靠腔面为紧密连接, 下方为桥粒结构, 紧密连接比较长, 结构清晰, 连接缝隙小, 桥粒结构丰富, 胞质内各类细胞器结构良好, 上皮细胞核位于基底; 模型组电镜下肠黏膜上皮排列紧密, 上皮细胞表面微绒毛丰富, 排列规则, 少数细胞微绒毛倒伏, 细胞间靠腔面为紧密连接, 下方为桥粒结构, 紧密连接较正常组稍变短, 桥粒结构良好, 其他细胞器结构良好. 电镜下模型组紧密连接明显低于对照组, 具有显著性差异(0.50 μm±0.21 μm vs 0.78 μm±0.19 μm, t = 2.31, P<0.05, 图4).
NAFLD是遗传-环境-代谢应激相关性疾病, 具体发病机制尚未明确, 但较为公认的机制为"二次打击"学说: 胰岛素抵抗(insulin resistance, IR)引起的肝细胞内脂肪过度积聚及肝细胞对损害因子的敏感性增加是NAFLD形成的"第一次打击", 是肝内脂肪积聚的关键机制; "第一次打击"将促进"第二次打击"发生, 导致肝细胞损伤、炎症及纤维化形成, 诱导肝细胞损伤的两条主要途径是氧应激诱导的脂质过氧化和细胞因子介导的损伤. 此外, 肠道细菌产生的ET可能作为"第二次打击"的因素参与NAFLD的发病. 传统上认为如果肝脏能够适应脂肪变性的发生, 则仅表现为脂肪变性, 如果肝脏不能够适应, 在有其他病理生理异常的情况下将发生非酒精性脂肪性肝炎, 甚至肝硬化及肝癌[10]. 西方国家NAFLD患病率约20%-30%, 亚太地区接近12%-24%[11], 其中约10%的患者发展成NASH, NASH中近30%的患者可进展为肝硬化, 或者发生终末期的肝功能衰竭, 需行肝脏移植手术[12]. 单纯性脂肪肝的近期预后良好, 而NASH的长期预后并不优于HCV引起的肝硬化[13].
正常情况下, 少量肠源性ET经门脉系统入肝, 主要由库普弗细胞(Kupffer cell, KC)吞噬清除, 维持肝脏内环境的稳定. 但在多种肝脏疾病时, 因肠道功能紊乱、KC功能受损和/或侧枝循环形成等多种因素作用, ET产生增加, 不能被有效清除而进入体循环, 从而形成肠源性ET血症[14]. 由"二次打击"学说可以看出, ET在NASH的发病机制中起重要作用. 其一方面通过直接细胞毒性作用, 诱导细胞凋亡、坏死. 更为重要的是, 脂多糖(lipopolysaccharide, LPS)与受体结合诱导以KC为主的肝脏间质细胞活化, 产生释放IL-1、IL-6、IL-8、TNF-α等炎症因子以及一氧化氮(NO)、氧自由基等生物活性物质, 构成炎症介质网络, 扩大LPS作用, 促进NASH的发生发展[15,16].
TNF-α是一种促炎性细胞因子, 在免疫反应、炎症和对损伤反应中起重要作用, 正常情况下主要是由脂肪组织产生, 其血清水平与机体的脂肪含量和胰岛素敏感性相关. 有研究发现, 脂酶活性抑制和IR导致的肝细胞内脂肪积累可能是NAFLD发病关键环节, 而TNF-α基因表达水平增加可以抑制脂肪组织的脂酶活性, 而导致血清中三酰甘油浓度的升高[17,18], 还可诱导IL-1、IL-6等细胞因子的产生, 共同参与肝损害. 另外还可引起中性粒细胞趋化, 进而导致肝脏炎症反应, 并通过脂质过氧化使细胞受损, 最终导致肝细胞坏死[19]. 本研究NAFLD大鼠血清及肝脏组织TNF-α水平均高于对照组, 提示TNF-α参与了高脂饮食脂肪肝损伤过程. 最近越来越多的研究表明, TNF-α还可以增加肠上皮细胞细胞旁的通透性[20], 降低肠上皮细胞屏障的跨上皮电阻, 并认为这是TNF-α引起肠黏膜屏障通透性增高的主要原因[4,21].
肠黏膜屏障在保护机体免受食物抗原、微生物及其产生的有害代谢产物的损害, 保持机体内环境的稳定方面起重要作用[22-24]. 正常情况下肠黏膜具有完善的机械屏障, 以抵御较强的刺激和正常菌群的侵犯. 机械屏障由肠黏膜表面黏液、微绒毛、上皮细胞及其间的紧密连接以及黏膜的特殊结构组成[25]. 多种炎症因子可损害肠上皮细胞屏障功能, 导致肠黏膜通透性增高, 包括ET、TNF-α、γ-干扰素等. 肠上皮细胞间连接由紧密连接、黏附连接、缝隙连接等构成. 紧密连接为一狭窄的带状结构, 位于上皮细胞膜外侧的顶部, 相邻细胞互相包裹, 形成融合点或吻合点, 连接起来就形成一个连续的渔网状结构. 紧密连接是肠上皮细胞间的主要连接方式, 对维持上皮细胞极性及调节肠屏障的通透性发挥着重要的作用. 紧密连接主要由Claudin蛋白、Occludin蛋白、JAM、ZOs等结构蛋白及各类连接蛋白分子共同组成[26,27]. Occludin蛋白作为紧密连接蛋白之一, 相对分子质量为65 kDa, 4个跨膜结构将Occludin分为2个细胞外环和2个细胞内环, 相邻细胞就是通过外环以拉链状结合而封闭细胞旁间隙[28-30]. 低氧、炎性因子刺激等病理情况可引起Occludin等分布异常、表达减少, 导致紧密连接结构和功能异常, 细胞间隙增宽, 从而导致内皮间通透性升高[31,32]. 有学者[33]认为缺乏Occludin则不能形成典型的紧密连接结构. 维持肠上皮的完整性对于保护肠道屏障功能、防止细菌内毒素及毒性大分子物质进入体内具有重要意义.
本研究发现NAFLD大鼠小肠上皮细胞间紧密连接蛋白Occludin的表达下降, 紧密连接明显缩短, 提示肠道机械屏障受损在NAFLD的病理生理机制中发挥一定的作用, 为临床预防和治疗NAFLD提供了一种可能的途径. 既往体外研究证实TNF-α能降解紧密连接蛋白[34], 抑制Occludin的表达[35], 使肠道上皮细胞的通透性增加. 本研究高脂饮食脂肪肝大鼠血及肝脏TNF-α水平增高, 而肠上皮细胞间紧密连接蛋白Occludin表达下降, 提示NAFLD大鼠肠上皮紧密连接蛋白Occludin表达下降与TNF-α升高存在一定的相关性. TNF-α可能抑制了小肠上皮细胞中紧密连接蛋白Occludin的表达, 从而破坏了肠黏膜机械屏障, 促进NAFLD的发生及发展. 肠上皮细胞间紧密连接带破坏、肠黏膜通透性增高、小肠细菌过度繁殖(small intestinal bacterial overgrowth, SIBO)、内毒素及TNF-α的产生、肠腔内乙醇产物增加、高脂饮食及果糖摄入过多、抗氧化物水平降低等, 通过肠-肝对话诱致肝细胞脂变、肝性IR、氧化应激及亚临床系统性炎症的发生和发展. 而内脏肥胖、脂肪肝和IR都是前炎状态, 其特点是促炎因子增多及选择性巨噬细胞浸润(第二次打击), 内脏脂肪和肝脏通过对脂肪酸的转运和处理进行对话, 由此扩大代谢-炎症及代谢-免疫的相互关联, 介导肝性IR、NASH、代谢综合征(metabolism syndrome, MS)及心血管疾病的发生[13]. 目前NAFLD尚无特效治疗药物, 本实验为NAFLD的治疗提供了方向.
非酒精性脂肪性肝病(NAFLD)是一种获得性代谢性应激相关的肝脏疾病, 目前国内外发病率呈明显上升趋势. NAFLD临床上包括单纯性脂肪肝、脂肪性肝炎(NASH)和脂肪性肝硬化三种类型. 患者从单纯性脂肪肝进展为NASH的发生机制尚不明确.
宣世英, 教授, 山东省青岛市市立医院肝病内科
TNF-α抑制肠上皮紧密连接蛋白Occludin的表达, 使肠道机械屏障受损, 这一表现可能是NAFL发展为NASH的病理生理和发病机制中的一重要环节. 这一发现为临床预防和治疗NAFLD提供了一种可能的途径.
马力等报道肝硬化、急性肝衰竭大鼠肠紧密连接蛋白的表达下降, 并与TNF-α有一定相关性. Patrick等的研究显示TNF-α能降解紧密连接蛋白, 抑制Occludin的表达.
本研究在于探讨NAFLD大鼠肠上皮细胞间紧密连接蛋白Occludin的表达及与TNF-α的关系, 为NAFLD的发病机制提出了新论点和依据. 国内外尚无此方面的报道.
本研究高脂饮食脂肪肝大鼠血及肝脏TNF-α水平增高, 而肠上皮细胞间紧密连接蛋白Occludin表达下降, 提示NAFLD大鼠肠上皮紧密连接蛋白Occludin表达下降与TNF-α升高存在一定的相关性. TNF-α可能抑制了小肠上皮细胞中紧密连接蛋白Occludin的表达, 从而破坏了肠黏膜机械屏障, 促进NAFLD的发生及发展.
本研究选题和思路都很好, 从总体的讨论和实验过程来看, 值得肯定, 有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Mehta K, Van Thiel DH, Shah N, Mobarhan S. Nonalcoholic fatty liver disease: pathogenesis and the role of antioxidants. Nutr Rev. 2002;60:289-293. [PubMed] [DOI] |
| 2. | Pinkoski MJ, Droin NM, Green DR. Tumor necrosis factor alpha up-regulates non-lymphoid Fas-ligand following superantigen-induced peripheral lymphocyte activation. J Biol Chem. 2002;277:42380-42385. [PubMed] [DOI] |
| 3. | Bojarski C, Bendfeldt K, Gitter AH, Mankertz J, Fromm M, Wagner S, Riecken EO, Schulzke JD. Apoptosis and intestinal barrier function. Ann N Y Acad Sci. 2000;915:270-274. [PubMed] |
| 4. | Bruewer M, Luegering A, Kucharzik T, Parkos CA, Madara JL, Hopkins AM, Nusrat A. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. J Immunol. 2003;171:6164-6172. [PubMed] |
| 5. | Poritz LS, Garver KI, Tilberg AF, Koltun WA. Tumor necrosis factor alpha disrupts tight junction assembly. J Surg Res. 2004;116:14-18. [PubMed] [DOI] |
| 6. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-G376. [PubMed] [DOI] |
| 7. | Wigg AJ, Roberts-Thomson IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut. 2001;48:206-211. [PubMed] [DOI] |
| 8. | 马 力, 崔 巍, 鲁 学恒. 实验性肝硬化大鼠肠上皮细胞间紧密连接蛋白Occludin表达下降. 中国组织化学与细胞化学杂志. 2007;16:416-418. |
| 10. | 丁 晓东, 范 建高. 非酒精性脂肪性肝病的发生机制. 北京: 人民卫生出版社 2009; 15-20. |
| 11. | Farrell GC, Chitturi S, Lau GK, Sollano JD. Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region: executive summary. J Gastroenterol Hepatol. 2007;22:775-777. [PubMed] [DOI] |
| 12. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 14. | Enomoto N, Ikejima K, Bradford BU, Rivera CA, Kono H, Goto M, Yamashina S, Schemmer P, Kitamura T, Oide H. Role of Kupffer cells and gut-derived endotoxins in alcoholic liver injury. J Gastroenterol Hepatol. 2000;15 Suppl:D20-D25. [PubMed] [DOI] |
| 15. | Day CP. Non-alcoholic steatohepatitis (NASH): where are we now and where are we going? Gut. 2002;50:585-588. [PubMed] [DOI] |
| 16. | Zhang H, Li Y, Wang S, Zhang K, Li L, Wu X. LPS-induced NF-kappa B activation requires Ca2+ as a mediator in isolated pancreatic acinar cells of rat. Chin Med J (Engl). 2003;116:1662-1667. [PubMed] |
| 17. | Hui JM, Hodge A, Farrell GC, Kench JG, Kriketos A, George J. Beyond insulin resistance in NASH: TNF-alpha or adiponectin? Hepatology. 2004;40:46-54. [PubMed] [DOI] |
| 18. | Li Z, Yang S, Lin H, Huang J, Watkins PA, Moser AB, Desimone C, Song XY, Diehl AM. Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease. Hepatology. 2003;37:343-350. [PubMed] [DOI] |
| 20. | Coyne CB, Vanhook MK, Gambling TM, Carson JL, Boucher RC, Johnson LG. Regulation of airway tight junctions by proinflammatory cytokines. Mol Biol Cell. 2002;13:3218-3234. [PubMed] [DOI] |
| 21. | Gitter AH, Bendfeldt K, Schmitz H, Schulzke JD, Bentzel CJ, Fromm M. Epithelial barrier defects in HT-29/B6 colonic cell monolayers induced by tumor necrosis factor-alpha. Ann N Y Acad Sci. 2000;915:193-203. [PubMed] |
| 23. | Harari Y, Weisbrodt NW, Moody FG. Ileal mucosal response to bacterial toxin challenge. J Trauma. 2000;49:306-313. [PubMed] [DOI] |
| 24. | Kiyono H, Kweon MN, Hiroi T, Takahashi I. The mucosal immune system: from specialized immune defense to inflammation and allergy. Acta Odontol Scand. 2001;59:145-153. [PubMed] [DOI] |
| 26. | Furuse M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J Cell Biol. 1998;141:1539-1550. [PubMed] [DOI] |
| 28. | Chen YH, Lu Q, Goodenough DA, Jeansonne B. Nonreceptor tyrosine kinase c-Yes interacts with occludin during tight junction formation in canine kidney epithelial cells. Mol Biol Cell. 2002;13:1227-1237. [PubMed] [DOI] |
| 29. | Nusrat A, Chen JA, Foley CS, Liang TW, Tom J, Cromwell M, Quan C, Mrsny RJ. The coiled-coil domain of occludin can act to organize structural and functional elements of the epithelial tight junction. J Biol Chem. 2000;275:29816-29822. [PubMed] [DOI] |
| 30. | Tsukita S, Furuse M. Occludin and claudins in tight-junction strands: leading or supporting players? Trends Cell Biol. 1999;9:268-273. [PubMed] [DOI] |
| 31. | Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut. 2003;52:439-451. [PubMed] [DOI] |
| 33. | Saitou M, Fujimoto K, Doi Y, Itoh M, Fujimoto T, Furuse M, Takano H, Noda T, Tsukita S. Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions. J Cell Biol. 1998;141:397-408. [PubMed] [DOI] |
| 34. | Patrick DM, Leone AK, Shellenberger JJ, Dudowicz KA, King JM. Proinflammatory cytokines tumor necrosis factor-alpha and interferon-gamma modulate epithelial barrier function in Madin-Darby canine kidney cells through mitogen activated protein kinase signaling. BMC Physiol. 2006;6:2. [PubMed] [DOI] |
| 35. | Mankertz J, Tavalali S, Schmitz H, Mankertz A, Riecken EO, Fromm M, Schulzke JD. Expression from the human occludin promoter is affected by tumor necrosis factor alpha and interferon gamma. J Cell Sci. 2000;113:2085-2090. [PubMed] |