修回日期: 2009-12-03
接受日期: 2009-12-07
在线出版日期: 2010-01-08
目的: 了解肠道表面树突状细胞(DCs)及炎症细胞因子VIP、IL-1β在肠功能紊乱时的表达, 以及外周血中VIP、IL-1β的表达, 探讨大鼠肠道免疫耐受的变化.
方法: 将60只Wistar大鼠随机分为实验组和对照组, 建立冷-束缚应激动物模型. 将大鼠处死后, 取大鼠回肠末端、远端结肠各长约2 cm的肠段, 免疫组织化学法检测肠道表面CD11c、VIP、IL-1β的表达, 留取腹主动脉血清用ELISA方法检测外周血清中VIP、IL-1β的表达.
结果: 在回肠末端, 实验组大鼠CD11c的表达较对照组无显著差异性; 实验组大鼠VIP、IL-1β表达较对照组均明显增加, 差异有显著性(177.67±35.44 vs 92.64±22.19, 359.56±45.48 vs 216.46±41.56, 均P<0.05). 并且VIP的表达与IL-1β呈正相关(r = 0.78, P<0.01). 在远端结肠, 实验组大鼠CD11c、IL-1β的表达较对照组均无显著差异性; 而实验组大鼠远端结肠VIP的表达较对照组明显增高, 差异有显著性(380.15±33.24 vs 254.04±40.53, P<0.05); 在外周血中, 与对照组相比较, VIP、IL-1β表达均增高, 差异有显著性(149.03 ng/L±56.82 ng/L vs 104.24 ng/L±39.03 ng/L, 8.82 ng/L±3.91 ng/L vs 5.49 ng/L±3.79 ng/L, P<0.05).
结论: 冷-束缚应激后肠功能紊乱大鼠中, 末端回肠和远端结肠黏膜存在轻度的炎症反应, DCs尚不能解释肠功能紊乱后肠道存在轻度炎症反应的发病机制.
引文著录: 姜道亮, 王巧民, 宋继中, 周政, 徐雪梅, 代子艳. 大鼠肠道DCs及相关细胞因子在冷-束缚应激诱导肠功能紊乱后的表达. 世界华人消化杂志 2010; 18(1): 89-93
Revised: December 3, 2009
Accepted: December 7, 2009
Published online: January 8, 2010
AIM: To investigate the expression of CD11c, vasoactive intestinal peptide (VIP) and interleukin-1β (IL-1β) in the intestine and peripheral blood of rats with intestinal dysfunction induced by cold-restraint stress, and analyze the changes in intestinal immune tolerance in these rats.
METHODS: Sixty Wistar rats were randomly divided into control group and experimental group. Intestinal dysfunction was induced in rats by cold-restraint stress. The macroscopic and histological changes in the terminal ileum and distal colon were scored. Immunohistochemistry was used to detect the expression of CD11c, VIP and IL-1β in the intestine. The levels of VIP and IL-1β in peripheral blood was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Although there was no significant difference in the expression of CD11c in the terminal ileum between the experimental group and the control group, the expression levels of VIP and IL-1β in the terminal ileum in the experimental group were significantly higher than those in the control group (177.67 ± 35.44 vs 92.64 ± 22.19, and 359.56 ± 45.48 vs 216.46 ± 41.56, respectively; both P < 0.05). A positive linear correlation was noted between the expression of VIP and IL-1β in the terminal ileum (r = 0.78, P < 0.01). No significant differences were noted in the expression levels of CD11c and IL-1β in the distal colon between the experimental group and control group, whereas the expression level of VIP in the experimental group was significantly higher than that in the control group (380.15 ± 33.24 vs 254.04 ± 40.53, P < 0.05). Compared with the control group, the levels of VIP and IL-1β in peripheral blood increased significantly in the experimental group (149.03 ± 56.82 ng/L vs 104.24 ± 39.03 ng/L, and 8.82 ± 3.91 ng/L vs 5.49 ± 3.79 ng/L, respectively; both P < 0.05).
CONCLUSION: Low-grade inflammation is noted in the terminal ileum and distal colon of rats with intestinal dysfunction induced by cold-restraint stress. Dentritic cells may not be involved in the pathogenesis of mild intestinal inflammation response present in the bowel of rats with intestinal dysfunction.
- Citation: Jiang DL, Wang QM, Song JZ, Zhou Z, Xu XM, Dai ZY. Expression of CD11c, VIP and IL-1β in the intestine and peripheral blood of rats with intestinal dysfunction induced by cold-restraint stress. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 89-93
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/89.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.89
肠易激综合征(irritable bowel syndrome, IBS)是持续或间歇发作的腹痛或腹部不适伴大便习惯改变和排便异常, 但尚未发现特异的生化或形态学异常的功能性肠病. 目前仍不了解IBS发病中的确切机制. 不同的应激刺激引起不同程度的消化功能紊乱, 其中束缚加寒冷应激是一种对肠黏膜轻微的, 非溃疡形成的刺激, 因此束缚-寒冷应激诱发排便异常的大鼠模型是研究人IBS的较好的实验动物模型[1]. 树突状细胞(dendritic cells, DCs)是机体主要的抗原递呈细胞(antigen presenting cells, APC), 是肠道免疫系统中的重要组成成员, 在这个高度抗原性的肠腔环境中, 肠道黏膜免疫系统必须维持对共生菌、食物和自身抗原的免疫耐受, 维持肠道自稳, 并启动对病原菌的免疫应答反应, 以预防控制宿主体内的感染, 在这一过程中, 肠道DCs发挥着重要作用. 本实验旨在通过制备束缚加寒冷诱发排便异常变化的大鼠模型, 来检测应激后肠功能紊乱肠道表面DCs、VIP、IL-1β以及外周血中VIP、IL-1β的表达, 进一步探讨肠道免疫耐受的变化.
Ⅱ级♂Wistar大鼠60只, 周龄8 wk, 雌雄各半, 体质量为250-300 g, 购于湖北省武汉疾病控制中心. 兔抗大鼠IL-1β多克隆抗体和兔抗大鼠VIP多克隆抗体均购自北京博奥森生物技术有限公司. 兔抗大鼠CD11c多克隆抗体购自武汉博士德生物工程有限公司. 免疫组织化学试剂盒和浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司. VIP、IL-1β ELISA试剂盒购自上海森雄科技实业有限公司.
1.2.1 造模: 所有大鼠在实验前2 wk都放在25 ℃恒温饲养室中, 由专人饲养, 保持12 h:12 h昼夜交替, 按需原则提供食物和水(饲养房和实验室均在Ⅱ级动物实验室). 适应性喂养2 wk后, 随机分为实验组和对照组, 每组均30只. 实验组采用改良的束缚加寒冷的应激方法, 将大鼠放在大鼠固定器中(23 cm×10 cm×7.5 cm), 部分限制其上半身和前肢运动, 头部可以活动, 在此基础上将大鼠放入8 ℃-10 ℃冷柜中. 2 h后将大鼠取出观察其大便性状, 每天实施应激1次, 持续5 d, 为消除生物节律的影响, 均于早8时开始实验. 实验前禁食18 h, 不禁水. 对照组不予应激, 余操作相同. 于造模后, 即应激后第6天行球囊结直肠扩张(colo-rectal distention, CRD)测定内脏敏感性[2], 分别记录: 肠道初始感觉阈值, 疼痛阈值和最大耐受阈值, 评估两组大鼠的容量阈值有无差异.
1.2.2 肠道组织大体形态观察和病理组织学检查: 模型建立成功后, 将两组大鼠经10%水合氯醛麻醉后处死, 回肠末端(回盲瓣以上3 cm)和远端结肠(肛门以上5 cm)组织各约2 cm, 纵向剪开, 用生理盐水清洗干净[3], 参照文献[4]肉眼观察大体形态. 另外再取这三段肠组织各约2 cm置于甲醛中固定, 石蜡包埋、切片、HE染色, 光镜下观察病理组织学变化.
1.2.3 肠道表面CD11c以及VIP, IL-1β的表达: 应用免疫组织化学方法检测回肠末端和远端结肠组织表面分子CD11c以及VIP, IL-1β, 操作按照免疫组织化学二步法染色试剂说明书进行. 一抗稀释浓度为: CD11c(1:200), VIP(1:150)、IL-1β(1:200). 以缓冲液PBS代替一抗, 作为阴性对照. 结果判断: CD11c标记阳性细胞的胞膜与胞质染成棕黄色, 参照文献[5]每张切片随机选取3个不重复视野, 用图像分析软件测定面积, 将呈现为棕褐色或棕黄色视作阳性目标, 取平均值作为最终结果. VIP和IL-1β阳性表达为免疫组织化学切片胞质, 胞膜和细胞外基质出现浅黄色至棕黄色颗粒, 呈细丝状, 细颗粒状和聚集状态, 无着色为阴性, 参照文献[6]运用图像分析软件对每张切片随机选取5个不重复的视野, 分析VIP和IL-1β表达的阳性面积, 计算均值.
1.2.4 外周血细胞因子VIP和IL-1β的表达: 于感染后第9天, 将两组大鼠经水合氯醛麻醉后处死, 抽取腹主动脉外周血约5 mL, 3000 r/min离心10 min, 分离血清后置-80 ℃冰箱保存备用. 采用ELISA法分别测定血清中VIP和IL-1β的含量.
统计学处理 实验数据以mean±SD表示, 应用SPSS13.0统计软件对各组数据进行统计分析, 组间采用非独立样本t检验, 直线相关分析.
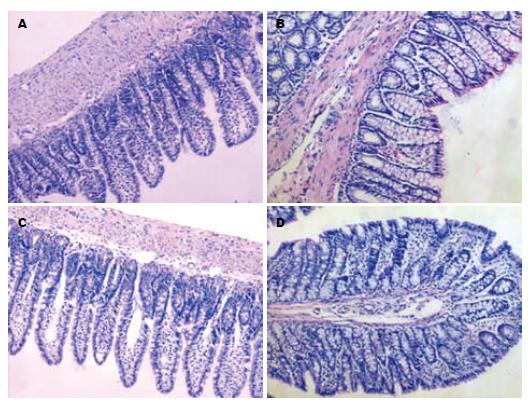
肉眼观察两组大鼠回肠末端和远端结肠黏膜均无充血, 水肿, 溃疡. 光学显微镜下两组大鼠固有腺体无异常, 间质无充血、水肿、炎细胞浸润等病理组织改变, 实验组大鼠肠黏膜符合肠功能紊乱肠黏膜组织学标准(图1).
实验组大鼠内脏敏感性较正常对照组内脏敏感性明显增大, 其肠道的初始阈值, 疼痛阈值和最大耐受阈值较对照组明显下降, 差异有统计学意义(P<0.05, 表1).
在回肠末端, 与正常对照组比较, 实验组大鼠CD11c的表达有增高趋势, 但是差异无显著性(P>0.05); 实验组大鼠VIP、IL-1β较对照组表达明显增加, 差异有显著性(P<0.05), VIP的表达与IL-1β呈正相关(r = 0.78, P<0.01). 在远端结肠, 实验组大鼠CD11c、IL-1β的表达较对照组均无显著差异性(P>0.05); 而实验组大鼠远端结肠VIP的表达较对照组明显增高, 差异有显著性(P>0.05, 表2).
IBS病因和发病机制未完全明了, 涉及因素较多, 包括精神、食物、内脏感觉过敏、胃肠动力改变、感染、免疫、神经和内分泌等. 目前认为IBS发病是多因素综合作用的结果, 其中神经-免疫-内分泌网络调控失调近年来备受重视[7], 对非选择性IBS患者深入研究发现肠道黏膜存在炎症反应[8,9], 近年来大量研究发现, 与健康志愿者相比, IBS患者回肠和结肠黏膜中免疫细胞的数量明显增加, 如肠嗜铬细胞、肥大细胞、T细胞、巨噬细胞等[10,11], 至今关于IBS患者肠道DCs的研究较少, 本实验从大鼠肠功能紊乱动物模型来了解DCs的变化. DCs是具有较强抗原提呈功能的专职抗原提呈细胞, 肠道DCs主要分布于Peyer's结和肠系膜淋巴结(mesenteric lymphnodes, MLN), 少量分布于肠道黏膜固有层(laminapropria, LP). DCs主要的两种功能是: 摄取抗原和激活初始T细胞. 通常由未成熟的DCs在外周组织中摄取抗原, 在摄取抗原和(或)受到某些因子(如LPS、TNF-α)刺激后, 分化为成熟DCs并同时迁移到次级淋巴器官. DCs成熟过程中, 上调主要组织相容性复合体Ⅱ类分子和共刺激分子的表达, 并获得激活初始T细胞的能力. 本实验采用传统的束缚-冷应激的方法建立肠功能紊乱动物模型, 应激可以增强免疫细胞活性, 改变消化系运动和内脏感受阈值, 同时, 可以增加潜在致病菌数量, 引起胃肠道菌群显著改变[12], 在应激缓解后, 肠黏膜仍可能持续存在低级别炎症, 在肠道共生微生物和各种食物成分的刺激下, 胃肠道固有免疫和适应性免疫面临着很大的挑战. 这些局部的免疫反应需要严格的调控, 而这些调控的结果大多是诱导免疫耐受. CD11c是目前广泛应用的DCs特异性标志物, 本实验结果提示在实验组大鼠CD11c的表达与对照组比较差异没有统计学意义(P>0.05). 因此本实验CD11c的表达结果尚不能解释在肠功能紊乱后免疫耐受被打破, 产生低度炎症反应的具体发病过程. Chorny等[13]研究表明, VIP能通过诱导未成熟DCs而诱导抗原特异性免疫耐受, 其中DCs成熟度的变化对诱导免疫耐受产生很大的影响. 因此将来可以测定肠道DCs的表面组织相容性复合体Ⅱ类分子和共刺激分子, 来了解肠功能紊乱动物模型中肠道成熟DCs的数量的变化, 也可以测定其他抗原提呈细胞如B细胞, 巨噬细胞等在肠功能紊乱动物模型中的表达, 进一步了解肠功能紊乱存在低度炎症的免疫学机制. 本实验结果虽然提示肠道DCs表达与对照组比较没有统计学意义, 但是为将来了解IBS的发病机制提供了一条新的研究思路. IL-1β主要是由单核细胞及受损组织释放的炎性介质, 本实验中, 与对照组相比, 实验组大鼠外周血中的IL-1β的表达升高, 差异有显著性(P<0.05), 与国内外研究结果一致[14,15]. 提示本实验动物模型存在一定的炎症反应和免疫激活. 并且本实验结果表明, 与对照组相比, IL-1β在回肠末端表达升高(P<0.05), IL-1β的产生与应激有关, 大鼠在束缚应激时IL-1β及IL-1β mRNA含量明显升高. 提示肠功能紊乱动物模型局部组织中存在炎症反应, IL-1β对IBS症状的可能作用机制是, 作用于腺管上皮细胞, 诱导炎症反应, 产生炎症性疼痛, 同时也对胃肠分泌和运动有影响, 并可抑制肠道钠-钾-ATP酶的活性, 抑制水、钠吸收产生腹泻, IL-1β还可使胃肠道胆碱能神经对乙酰胆碱及其他炎性介质的敏感性增高[16]. 因此可以部分解释实验组大鼠排便性状改变和内脏敏感性增加的原因. VIP是一种含28个氨基酸残基的碱基多肽, 广泛分布于肠道和神经系统. 在消化系的运动方面, VIP是作为抑制胃肠运动的主要神经递质之一, 具有松弛胃肠平滑肌作用. 本实验发现, 外周血中以及大鼠回肠末端, 远端结肠, VIP的表达均较对照组明显增加, 且差异有显著性(P<0.05), 因此VIP的表达可以作为判断肠功能紊乱动物模型的一个有价值的指标. 大量的实验结果表明, VIP具有促进分泌和吸收功能, 可促进肠道水和电解质的分泌, 因此可以部分解释实验组大鼠排便性状改变的原因. 最新的研究发现, VIP主要通过作用T淋巴细胞膜上VIP受体起到免疫抑制作用[17], 本实验发现, 在T淋巴细胞胞膜和腺上皮上有VIP阳性颗粒表达, 并且在末端回肠VIP和IL-1β的表达具有相关性, 提示VIP可能参与对上皮细胞作用, 其作用可能是: 作用于上皮淋巴细胞, 抑制IL-1β对上皮细胞的致炎作用[18], 因此推测VIP的升高是伴随着IL-1β的升高一种反馈性升高, 维持促炎-抗炎细胞因子的平衡, 能有效控制肠黏膜过度的免疫和炎症反应, 减少肠黏膜损伤. 上述研究结果初步证实, 肠道神经及其递质在IBS的发病机制中起着重要作用. 总之, IBS病因和发病机制涉及因素较多, 其发病机制仍然不是很明确, 目前的研究仍停留在炎症细胞因子的方面, 将来可以从免疫应答的角度来研究其炎症反应的具体发病机制. 因此将来还需要大量的动物实验和临床试验来探讨肠功能紊乱的具体发病机制.
近年来, 许多研究表明肠功能紊乱中肠黏膜存在炎症反应, 但其发生机制尚不清楚, 其中神经-免疫-内分泌网络调控失调近年来备受重视. 所以建立以急性冷应激为诱因、以排便性状改变为特征的肠功能紊乱的动物模型对研究IBS病因及发病机制非常必要而且有实验的可行性.
陈其奎, 教授, 中山大学附属第二医院消化内科; 许文燮, 教授, 上海交通大学医学院生理学教研室.
研究表明肠功能紊乱中肠黏膜存在炎症反应, 目前国内外的研究多是从组织和血液中的炎症因子的表达来阐述其炎症存在, 而从免疫应答的角度来说明肠道黏膜存在炎症的研究较少, 特别是具有抗原递呈作用的树突状细胞(DC)在阐述肠功能紊乱中存在炎症的研究较少.
Gwee等2003年研究证实IL-1β在感染后IBS患者肠道黏膜表达升高, 国内宋继中等2005年的研究证实IL-1β参与IBS的发病, 他们之间存在相关性. 李兆申等2003年的研究证实VIP可能参与了IBS的病理生理过程.
本实验用冷-束缚应激诱导的肠功能紊乱动物模型, 用组织病理学检查以及内脏敏感性来评价该模型是否符合肠功能紊乱动物模型, 用VIP、IL-1β来了解肠道炎症情况, 测定末端回肠和末端结肠DC的表达, 从免疫应答的角度来说明应激后肠功能紊乱动物模型中肠道黏膜存在轻度的炎症反应.
本实验证实了肠功能紊乱后肠道黏膜存在轻度的炎症反应, 虽然实验结果提示DC的表达与对照组比较无明显的差异性, 但是为将来研究肠功能紊乱中存在轻度的炎症反应的发病机制提供新的思路.
本研究创新性尚可, 结果可靠, 对了解肠易激综合征发病机制具有一定的理论意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Barone FC, Deegan JF, Price WJ, Fowler PJ, Fondacaro JD, Ormsbee HS 3rd. Cold-restraint stress increases rat fecal pellet output and colonic transit. Am J Physiol. 1990;258:G329-G337. [PubMed] |
| 2. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 3. | Pimentel M, Chatterjee S, Chang C, Low K, Song Y, Liu C, Morales W, Ali L, Lezcano S, Conklin J. A new rat model links two contemporary theories in irritable bowel syndrome. Dig Dis Sci. 2008;53:982-989. [PubMed] [DOI] |
| 4. | Mei Q, Yu JP, Xu JM, Wei W, Xiang L, Yue L. Melatonin reduces colon immunological injury in rats by regulating activity of macrophages. Acta Pharmacol Sin. 2002;23:882-886. [PubMed] |
| 5. | 戎 兰, 刘 伟, 丁 伟群, 蒋 义斌, 钟 良, 孙 大裕. 美沙拉嗪对结肠炎大鼠肠黏膜免疫反应中DCs的影响. 胃肠病学和肝病 学杂志. 2008;17:1026-1029. |
| 7. | Dinan TG, Quigley EM, Ahmed SM, Scully P, O'Brien S, O'Mahony L, O'Mahony S, Shanahan F, Keeling PW. Hypothalamic- pituitary-gut axis dysregulation in irritable bowel syndrome: plasma cytokines as a potential biomarker? Gastroenterology. 2006;130:304-311. [PubMed] [DOI] |
| 8. | Chadwick VS, Chen W, Shu D, Paulus B, Bethwaite P, Tie A, Wilson I. Activation of the mucosal immune system in irritable bowel syndrome. Gastroenterology. 2002;122:1778-1783. [PubMed] [DOI] |
| 9. | Collins SM, Piche T, Rampal P. The putative role of inflammation in the irritable bowel syndrome. Gut. 2001;49:743-745. [PubMed] [DOI] |
| 10. | Ohman L, Isaksson S, Lindmark AC, Posserud I, Stotzer PO, Strid H, Sjövall H, Simrén M. T-cell activation in patients with irritable bowel syndrome. Am J Gastroenterol. 2009;104:1205-1212. [PubMed] [DOI] |
| 11. | Spiller RC. Role of infection in irritable bowel syndrome. J Gastroenterol. 2007;42 Suppl 17:41-47. [PubMed] [DOI] |
| 12. | Hawrelak JA, Myers SP. The causes of intestinal dysbiosis: a review. Altern Med Rev. 2004;9:180-197. [PubMed] |
| 13. | Chorny A, Gonzalez-Rey E, Fernandez-Martin A, Pozo D, Ganea D, Delgado M. Vasoactive intestinal peptide induces regulatory dendritic cells with therapeutic effects on autoimmune disorders. Proc Natl Acad Sci U S A. 2005;102:13562-13567. [PubMed] [DOI] |
| 14. | Gwee KA, Collins SM, Read NW, Rajnakova A, Deng Y, Graham JC, McKendrick MW, Moochhala SM. Increased rectal mucosal expression of interleukin 1beta in recently acquired post-infectious irritable bowel syndrome. Gut. 2003;52:523-526. [PubMed] [DOI] |
| 16. | Bercík P, Wang L, Verdú EF, Mao YK, Blennerhassett P, Khan WI, Kean I, Tougas G, Collins SM. Visceral hyperalgesia and intestinal dysmotility in a mouse model of postinfective gut dysfunction. Gastroenterology. 2004;127:179-187. [PubMed] [DOI] |
| 17. | Delgado M, Pozo D, Ganea D. The significance of vasoactive intestinal peptide in immunomodulation. Pharmacol Rev. 2004;56:249-290. [PubMed] [DOI] |
| 18. | Egen JG, Kuhns MS, Allison JP. CTLA-4: new insights into its biological function and use in tumor immunotherapy. Nat Immunol. 2002;3:611-618. [PubMed] [DOI] |