修回日期: 2009-12-02
接受日期: 2009-12-07
在线出版日期: 2010-01-08
目的: 观察功能性消化不良(FD)患者焦虑抑郁情绪对脑葡萄糖代谢的影响.
方法: 分别对7例伴有轻度焦虑抑郁(抑郁焦虑组)和8例不伴有焦虑抑郁(非抑郁焦虑组)的FD患者行脑18氟脱氧葡萄糖(18F-FDG)正电子发射型计算机断层扫描(PET-CT), 用统计参数图软件(SPM2)比较两组间脑葡萄糖代谢的差别.
结果: 抑郁焦虑组与非抑郁焦虑组比较, 脑葡萄糖代谢下降的脑区集中于右侧大脑半球, 主要位于颞叶、额叶及边缘系统, 左侧大脑半球较少, 主要位于额下回和中央前回; 脑葡萄糖代谢升高的脑区集中于右侧大脑半球的颞叶、枕叶和左侧大脑半球的顶叶, 枕叶及边缘系统.
结论: FD患者抑郁焦虑情绪的加工和调节涉及广泛的脑区, 左右大脑半球均参与, 主要集中于额叶、颞叶和边缘系统, 枕叶和顶叶也参与了抑郁焦虑的调节.
引文著录: 刘迈兰, 兰蕾, 曾芳, 李学智, 刘旭光, 梁繁荣. 情志因素对功能性消化不良患者脑葡萄糖代谢的影响. 世界华人消化杂志 2010; 18(1): 44-47
Revised: December 2, 2009
Accepted: December 7, 2009
Published online: January 8, 2010
AIM: To observe the influence of depression and anxiety on cerebral glucose metabolism in patients with functional dyspepsia (FD).
METHODS: Seven FD patients with mild depression and anxiety (AD group) and eight patients without depression and anxiety (non-AD group) were enrolled in the study. All the patients were examined by positron emission tomography-computed tomography (PET-CT) with 18F-fluorodeoxyglucose (18F-FDG) to detect glucose metabolism in different brain regions. The difference in cerebral glucose metabolism was compared between the two groups using a semiquantitative method.
RESULTS: Compared with patients in the non-AD group, those in the AD group showed decreased cerebral glucose metabolism mainly in the temporal and frontal lobes and the limbic system in the right cerebral hemisphere and the inferior frontal gyrus and precentral gyrus in the left cerebral hemisphere, and increased cerebral glucose metabolism mainly in the temporal and occipital lobes in the right cerebral hemisphere and the parietal and occipital lobes and limbic system in the left cerebral hemisphere.
CONCLUSION: The emotion processing and regulation in FD patients with depression and anxiety involve multiple cerebral regions in bilateral cerebral hemispheres, mainly including the frontal and temporal lobes, the limbic system, and the parietal and occipital lobes.
- Citation: Liu ML, Lan L, Zeng F, Li XZ, Liu XG, Liang FR. Influence of emotional factors on cerebral glucose metabolism in patients with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 44-47
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/44.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.44
功能性消化不良(functional dyspepsia, FD)是最常见的消化系疾病之一, 约占胃肠专科门诊的1/3以上, 西方国家患病率约为20%-40%, 我国社区人群患病率为18.9%-19.8%[1,2]. FD患者既有神经症躯体形式障碍, 又常伴有焦虑和抑郁等情绪障碍[3]. 据调查统计FD的抑郁和(或)焦虑患病率约23.6%, 消化不良症状程度与抑郁自评量表(SDS)和焦虑自评量表(SAS)标准分呈正相关, 其抑郁和(或)焦虑状况对其疗效有较大的影响[4,5]. 正电子发射型计算机断层扫描(positron emission tomography-computed tomography, PET-CT), 将功能成像和解剖成像的对应点达到空间位置和解剖结构上的完全一致, 代表了当前核医学影像技术的最高水平, 18氟脱氧葡萄糖(18F-FDG)PET-CT通过脑内葡萄糖代谢反映脑的功能状况[6,7]. 本文将运用18F-FDG PET-CT显像探讨FD患者抑郁焦虑伴随情况对脑葡萄糖代谢特征的影响, 现报道如下.
2008-09/2008-12校园招募FD患者, 其中伴随抑郁焦虑(抑郁焦虑组)7例, 无抑郁焦虑(非抑郁焦虑组)8例, 均为右利手. 采用抑郁自评量表(SDS)和焦虑自评量表(SAS)自行评估, SDS 和SAS统计指标为标准总分, 即总粗分乘以1.25后取其整数. 抑郁焦虑组中男2例, 女5例, 年龄20-23(平均22.0±1.0)岁, SDS标准总分54.1分±3.1分, SAS标准总分54.1分±3.7分; 非抑郁焦虑组男3例, 女5例, 年龄21-29(平均22.6±2.6)岁, SDS标准总分34.2±3.2, SAS标准总分34.2分±2.5分. 两组的性别构成(Z = -0.354, P = 0.724)和年龄(t = 0.593, P = 0.225)差异无显著性. 本研究已通过道德伦理委员会的批准, 已由患者本人签署临床研究知情同意书.
PET/CT扫描仪为西门子公司生产, 型号为Biograph DUO BGO, 示踪剂采用加速器(Minitrace, GE)生产的18F-FDG, 其放化纯度均>95%. PET/CT显像数据采集: 受检者禁食4 h以上, 测定身高、体质量、血糖, 向患者简要交待显像过程、时间、显像中的要求; 在受试者左前臂建立静脉通道, 患者戴黑色眼罩和耳塞(LR-1型慢回弹性耳塞), 常规封闭视听. 建立静脉通道后, 在躺椅上舒适休息20 min, 使受试者思想平静、血压稳定、呼吸平稳. 静脉注射18F-FDG 185 MBq, 继续视听封闭休息40 min后, 行PET/CT扫描. 让受试者平卧于检查床, 头放于头托内, 保持舒适位置, 切无偏转, 眦耳线(OM线)与地面垂直. 要求患者在显像过程中保持不动. 保持室内光线柔和、安静, 室温20 ℃-24 ℃. 先同机CT扫描, 电压110 kV, 130 mAs, 矩阵128×128, 放大2倍, 层厚3 mm; 再同机PET扫描, 3D采集, 头部1个床位, 扫描时间12 min, 计数3×108. 图像重建条件: 通过有序子集最大期望值迭代法(OSEM)重建, 16个子集(16 subset), 6次迭代(6 iterative), 高斯平滑(滤波核为8 mm×8 mm×8 mm), 处理成矢状、冠状、横断层全部图像.
统计学处理 图像数据的处理: 采用统计参数图(statistical parametric mapping, SPM2)进行数据分析. 处理步骤及条件: 先将数据进行格式转换, 然后在Matlab(version 6.5)平台上, 应用SPM2(Statistical Parametric Mapping 2, Department of Cognitive Neurology, Institute of Neurology, University College London, UK . http://www.fil.ion.ucl.ac.uk/spm)软件对PET图像每一像素点数据进行分析, 首先进行空间标准化, 并采用15 mm×15 mm×15 mm的高斯核做平滑处理; 统计分析基于广义线性模型GLM, 统计检验采用单边t检验, 差异的显著性(P值)设置为0.005, 连续30个激活像素定义为激活区, 将抑郁焦虑组、非抑郁焦虑组图像分别与一组正常人的PET扫描图像进行对比, 并用成组t检验对两组患者的PET图像反应的脑功能变化区进行比较, 并用Talarich坐标图和Mni-Space utility软件对所得代谢变化的脑区进行神经解剖定位.
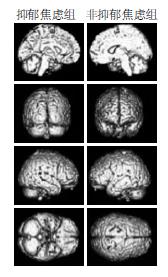
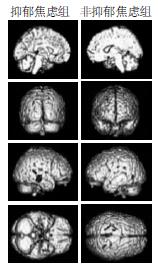
SPM分析抑郁焦虑组与非抑郁焦虑组脑葡萄糖代谢率比较, 结果显示: 抑郁焦虑组左侧额下回及中央前回, 右侧额上回、额中回、颞上回、颞中回及岛叶的葡萄糖代谢率较非抑郁焦虑组减低(图1), 以上脑区所对应的Brodmann区、Talairach坐标、Z值及P值见表1; 抑郁焦虑组右侧颞上回、颞中回及枕叶舌回, 左侧顶下叶、枕下回、枕中回及外核、丘脑、胼胝体的葡萄糖代谢率较非抑郁焦虑组增高(图2), 以上脑区所对应的Brodmann区、Talairach坐标、Z值及P值见表2.
| 脑功能区 | Brodmann Area | Talairach坐标 | Z值 | P值 | ||
| X | Y | Z | ||||
| 左额下回, 中央前回 | 6 | -32 | 0 | 34 | 3.29 | 0.001 |
| 右额上回, 额中回 | 6 | 4 | -6 | 66 | 2.99 | 0.001 |
| 右颞上回, 岛叶 | 13 | 50 | -40 | 16 | 2.83 | 0.002 |
| 右颞中回 | 21 | 50 | -26 | -6 | 2.77 | 0.003 |
| 右颞中回, 颞上回 | 22 | 48 | -36 | 2 | 2.76 | 0.003 |
| 脑功能区 | Brodmann Area | Talairach坐标 | Z值 | P值 | ||
| X | Y | Z | ||||
| 右颞上回 | 22 | 66 | -40 | 12 | 3.49 | 0.000 |
| 右颞中回 | 22 | 70 | -34 | 4 | 2.78 | 0.003 |
| 右枕叶, 舌回 | 19 | 24 | -58 | 0 | 3.18 | 0.001 |
| 左顶下叶 | 40 | -54 | -24 | 26 | 3.29 | 0.000 |
| 左枕下回, 枕中回 | 37 | -38 | -66 | 0 | 3.14 | 0.001 |
| 左脑下叶, 外核, 丘脑, 胼胝体 | - | -8 | -32 | 6 | 3.03 | 0.001 |
目前, 大量临床研究表明, FD可以分为情志障碍型和非情志障碍型, 而抗焦虑抑郁药物治疗伴随情志障碍的FD有效. 目前多从医院调查、临床流行病学统计方面收集了相关的信息, 但其原因尚未得到阐述. 脑功能成像研究, 已经广泛运用于胃肠功能病变的研究, 尤其伴随脑肠轴学说的兴起, 更加引起了国内外研究者的广泛关注. 而分析脑功能成像技术的方法众多, 其中, 脑葡萄糖代谢定量测定较常用的有感兴趣区法(region of interest, ROI)、统计参数图(statistical parametric mapping, SPM)等方法. ROI方法直观、方便, 但主观性强、重复性差. SPM方法可对图像进行位置校正, 可根据Talairach标准脑图谱确定ROI及其坐标, 可与SPM内部的MRI模板进行图像融合, 重复性强, 是目前国际上最权威最具优势的基于像素水平的图像分析方法, 但SPM的局限性在于不能分析单独个体的区域像素资料, 可能将有些图像信息当作噪声去除从而增加假阴性[8,9]. 近年来, 脑功能成像技术包括fMRI、SPECT和PETCT等运用于胃肠功能病变的研究, 初步揭示了脑与胃肠病变之间的特定联系. Ladabaum等[10]运用fMRI观察发现: 有害胃底扩张刺激激活了广泛的大脑区域, 主要为额叶-边缘系统, 包括脑桥脑干、丘脑、小脑、双侧岛叶皮质、前后扣带回皮质、右侧额叶和顶下叶; Zeng等[11]运用PETCT研究发现: FD患者与正常人比较, 脑葡萄糖代谢升高的区域为左侧颞下回, 代谢降低区域为右侧眶回、左侧尾状核尾部和扣带回. 近年来, 对于抑郁症的神经影像学研究则更深入, 既有抑郁症对脑结构影响的研究, 也不乏脑功能代谢影响的研究. 抑郁症对脑结构影响方面[12], 多聚焦于额叶、颞叶皮质, 海马和基底节等体积的变化. 抑郁症对脑功能代谢影响方面, Brooks等[13]研究提出皮质边缘失调假说, 即抑郁症状与组成前旁边缘网络的脑区(前扣带、颞前皮质、前额背外侧皮质、旁海马回和杏仁核)相关, 伴随前边缘的活动增强和前额叶的活动减弱; 许多研究者[13-17]发现抑郁症相对于健康人, 脑功能代谢多表现为广泛的前额叶皮质(背外侧、内侧、腹外侧)、右侧前颞叶皮质以及边缘系统(前扣带回喙部、左侧纹状体, 双侧杏仁核、双侧旁海马回)的激活, 和双侧背外侧前额叶皮质、右侧杏仁核、纹状体和尾状核的负激活. 此次研究运用PET-CT观察抑郁焦虑因素对FD患者脑葡萄糖代谢的影响, 抑郁焦虑组较非抑郁焦虑组, 左侧额下回, 右侧额上回、额中回, 右侧颞上回、颞中回, 中央前回及岛叶的葡萄糖代谢率减低; 抑郁焦虑组较非抑郁焦虑组, 右侧颞上回、颞中回, 左侧顶下叶, 右侧枕叶舌回, 左侧枕下回、枕中回及外核、丘脑、胼胝体的葡萄糖代谢率增高. 研究结果表明: (1)FD患者抑郁焦虑情绪的加工和调节涉及广泛的脑区, 左右大脑半球均参与, 主要集中于额叶、颞叶和边缘系统, 枕叶和顶叶也参与了抑郁焦虑的调节; (2)与既往对FD的研究结果有一致的地方, 如额叶-边缘系统的激活, 但脑区的代谢差异更明显; (3)与既往对抑郁症的研究结果有相似性, 即抑郁焦虑组较非抑郁焦虑组, 脑葡萄糖代谢率增高的脑区主要集中于颞叶(右侧颞上回、颞中回)和边缘系统(外核、丘脑、胼胝体), 而脑葡萄糖代谢率减低的脑区主要集中于额叶(左侧额下回、右侧额上回、额中回)和岛叶; 但也有不同, 如右侧颞叶上回、中回既有脑葡萄糖代谢升高, 又有代谢降低, 枕叶和顶叶也参与了抑郁焦虑的调节, 而额叶的脑葡萄糖代谢仅表现为降低, 因既往研究多为抑郁患者与健康人之间的比较, 而此次研究为FD患者之间的抑郁焦虑伴随情况比较.
功能性消化不良(FD)是最常见的消化系疾病之一, 患者常伴有焦虑和抑郁等情绪障碍, 其抑郁和(或)焦虑状况对其疗效有较大的影响, 通常服用抗抑郁和(或)抗焦虑药物有利于提高治疗效果.
杨建民, 教授, 浙江省人民医院消化内科.
正电子发射型计算机断层扫描(PET-CT), 代表了当前核医学影像技术的最高水平, 能反映脑内葡萄糖的代谢状况, 观察抑郁焦虑伴随情况对脑内葡萄糖代谢影响的差异, 阐明情绪因素对大脑功能影响的分子基础.
近年来, 脑功能成像技术包括fMRI、SPECT和PETCT等运用于胃肠功能病变的研究, 初步揭示了脑与胃肠病变之间的特定联系. 有学者运用fMRI观察发现: 有害胃底扩张刺激激活了广泛的大脑区域, 主要为额叶-边缘系统; 研究者运用PETCT研究发现: FD患者与正常人比较, 脑葡萄糖代谢升高的区域为左侧颞下回, 代谢降低区域为右侧眶回、左侧尾状核尾部和扣带回.
本研究分析了抑郁焦虑伴随情况对功能性消化不良患者大脑的葡萄糖代谢的差异.
PET-CT: 即正电子发射型计算机断层扫描, 是一种无创核医学影像诊断设备, 能在细胞分子水平上进行人体功能代谢显像, 可显示人脑、心、全身其他器官及肿瘤组织的生理和病理功能及代谢情况, 可以从体外对体内的代谢物或药物的变化进行定量动态监测.
本文比较了情志障碍型和非情志障碍型FD患者的大脑18F-FDG PET-CT影像学变化, 发现了一些有意义的现象, 论文设计科学, 书写规范, 可读性强, 值得推荐给广大读者.
编辑: 李军亮 电编:吴鹏朕
| 3. | Haug TT, Wilhelmsen I, Ursin H, Berstad A. What are the real problems for patients with functional dyspepsia? Scand J Gastroenterol. 1995;30:97-100. [PubMed] [DOI] |
| 5. | 连 传朋. 功能性消化不良患者抑郁及焦虑状况调查. 现代保健: 医学创新研究. 2007;4:51-52. |
| 6. | Turkington TG. Introduction to PET instrumentation. J Nucl Med Technol. 2001;29:4-11. [PubMed] |
| 7. | Townsend DW, Carney JP, Yap JT, Hall NC. PET/CT today and tomorrow. J Nucl Med. 2004;45 Suppl 1:4S-14S. [PubMed] |
| 8. | 左 传涛, 林 祥通, 李 殿友, 管 一晖, 赵 军, 孙 伯民. 18F-FDG PET显像观察强迫症患者内囊前肢毁损术后脑内环路的改变. 中华核医学杂志. 2003;23:222-223. |
| 9. | 左 传涛. 正电子发射断层(PET)基础与临床研究: 脑PET功能影像学技术平台的建立及脑功能重塑研究中的应用. 上海: 复旦大学华山医院影像医学与核医学 2004; 30-34. |
| 10. | Ladabaum U, Roberts TP, McGonigle DJ. Gastric fundic distension activates fronto-limbic structures but not primary somatosensory cortex: a functional magnetic resonance imaging study. Neuroimage. 2007;34:724-732. [PubMed] [DOI] |
| 11. | Zeng F, Song WZ, Liu XG, Xie HJ, Tang Y, Shan BC, Liu ZH, Yu SG, Liang FR. Brain areas involved in acupuncture treatment on functional dyspepsia patients: a PET-CT study. Neurosci Lett. 2009;456:6-10. [PubMed] [DOI] |
| 13. | Brooks JO 3rd, Hoblyn JC, Woodard SA, Rosen AC, Ketter TA. Corticolimbic metabolic dysregulation in euthymic older adults with bipolar disorder. J Psychiatr Res. 2009;43:497-502. [PubMed] [DOI] |
| 14. | Hassel S, Almeida JR, Kerr N, Nau S, Ladouceur CD, Fissell K, Kupfer DJ, Phillips ML. Elevated striatal and decreased dorsolateral prefrontal cortical activity in response to emotional stimuli in euthymic bipolar disorder: no associations with psychotropic medication load. Bipolar Disord. 2008;10:916-927. [PubMed] [DOI] |
| 15. | Forbes EE, Hariri AR, Martin SL, Silk JS, Moyles DL, Fisher PM, Brown SM, Ryan ND, Birmaher B, Axelson DA. Altered striatal activation predicting real-world positive affect in adolescent major depressive disorder. Am J Psychiatry. 2009;166:64-73. [PubMed] [DOI] |
| 16. | Ebmeier K, Rose E, Steele D. Cognitive impairment and fMRI in major depression. Neurotox Res. 2006;10:87-92. [PubMed] [DOI] |
| 17. | Taylor Tavares JV, Clark L, Furey ML, Williams GB, Sahakian BJ, Drevets WC. Neural basis of abnormal response to negative feedback in unmedicated mood disorders. Neuroimage. 2008;42:1118-1126. [PubMed] [DOI] |