修回日期: 2009-12-12
接受日期: 2009-12-14
在线出版日期: 2010-01-08
目的: 分析食管鳞癌组织及其对应癌旁组织中Syk蛋白和mRNA的表达, 探讨其与食管鳞癌临床恶性生物学行为的关系.
方法: 采用免疫组织化学法检测48例食管鳞癌组织及其对应癌旁组织中Syk蛋白的表达; RT-PCR法检测43例食管鳞癌组织及其对应癌旁组织中Syk mRNA的表达, 并观察其与食管鳞癌患者肿瘤大小、TNM分期、淋巴结转移的关系.
结果: 食管鳞癌组织Syk蛋白表达阳性率显著低于癌旁组织(16.67% vs 89.58%, P<0.05); Syk蛋白表达与肿瘤TNM分期相关(χ2 = 6.713, P<0.05); Syk在淋巴结转移组中的阳性表达率显著低于无淋巴结转移组 (3.03% vs 29.41%, P<0.05); Syk表达与肿瘤大小无关(χ2 = 0.017, P>0.05). 食管鳞癌组织中Syk mRNA的表达量明显低于其在对应癌旁组织中的表达量(t = -11.27, P<0.05).
结论: Syk蛋白和mRNA在食管鳞癌中表达缺失与其发生及转移倾向相关, Syk可能是食管鳞癌的肿瘤抑制基因, 可能作为分子标记而用于食管鳞癌的早期诊治.
引文著录: 刘泓基, 臧真真, 侯巧燕, 陆竞艳, 杨峻, 林中, 赵永忠. Syk基因在食管鳞癌组织中的表达及临床意义. 世界华人消化杂志 2010; 18(1): 33-38
Revised: December 12, 2009
Accepted: December 14, 2009
Published online: January 8, 2010
AIM: To investigate the expression of spleen tyrosine kinase (Syk) mRNA and protein in human esophageal squamous cell carcinoma (ESCC) and analyze its correlation with the malignant biological behavior of ESCC.
METHODS: The expression of Syk protein in 48 ESCC specimens and matched adjacent non-carcinoma specimens was detected by immunohistochemistry. The expression of Syk mRNA in 43 ESCC specimens and matched adjacent non-carcinoma specimens was assayed by reverse transcription-polymerase chain reaction (RT-PCR). The correlations of Syk expression with tumor size, TNM stage and lymph node metastasis were analyzed.
RESULTS: The positive rate of Syk protein expression in ESCC tissue was significantly lower than that in adjacent non-carcinoma tissue (16.67% vs 89.58%, P < 0.05). The expression of Syk protein was correlated with tumor TNM stage in ESCC (χ2 = 6.713, P < 0.05). A significant difference was noted in Syk expression between ESCC with and without lymph node metastasis (3.03% vs 29.41%, P < 0.05). No significant correlation was observed between Syk expression and tumor size (χ2 = 0.017, P > 0.05). RT-PCR analysis showed that the expression level of Syk mRNA was significantly lower in ESCC than in adjacent non-carcinoma tissue (t = -11.27, P < 0.05).
CONCLUSION: Downregulation of Syk gene expression may be involved in the carcinogenesis and metastasis of ESCC. Syk gene is a novel candidate tumor suppressor gene in ESCC and can be used as a molecular marker for early diagnosis and treatment of ESCC.
- Citation: Liu HJ, Zang ZZ, Hou QY, Lu JY, Yang J, Lin Z, Zhao YZ. Clinical significance of Syk expression in human esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 33-38
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/33.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.33
食管癌是世界上第七大肿瘤死亡原因, 在我国排位于肿瘤死因的第4位. 蛋白酪氨酸激酶(protein tyrosine kinase, PTKs)是一组能催化底物蛋白酪氨酸残基磷酸化的酶蛋白, 参与多种信号转导途径,并在控制细胞分化、增殖和扩散中起重要作用. 现在已发现90余种PTKs具有癌基因功能, 而脾酪氨酸激酶(spleen tyrosine kinase, Syk)是目前发现的唯一具有抑癌作用的PTKs. 近年来Syk基因作为候选抑癌基因, 在肿瘤组织的表达与功能受到高度重视. 近来陆续多项研究发现多种肿瘤组织中存在Syk表达缺失, 但迄今未见到Syk在食管鳞癌组织表达的相关报道. 本实验应用免疫组织化学法和RT-PCR法检测食管鳞癌患者肿瘤组织及其对应癌旁组织中Syk蛋白和mRNA的表达, 并探讨其与食管鳞癌发生及转移的可能关系及临床意义.
收集桂林医学院2002-2008年手术获得的食管鳞癌标本48例. 所有标本经40 g/L甲醛溶液固定, 石蜡包埋, 作4 µm切片, 分别做常规HE染色和免疫组织化学Syk染色. 收集桂林医学院及中国医科大学附属盛京医院2008-2009年手术获得的食管鳞癌标本43例, 全部食管鳞癌病例术前均未行放疗、化疗及生物制剂治疗. 手术标本切除后立即取材, 避开肿瘤坏死与出血部位, 于无菌条件下取肿瘤组织及癌旁组织(距瘤块组织5 cm以上)各1块, 标本大小约1 cm×1 cm×1 cm. 手术切除后立刻置于-196 ℃液氮中储存, 实验时置于-70 ℃冻存, 用于RT-PCR实验. 所有肿瘤标本都经病理证实. 鼠抗人Syk单克隆抗体及即用型快捷免疫组化Max VisionTM试剂盒购自福州迈新生物技术公司. RT-PCR试剂盒为TaKaRa公司产品. 应用Premier5.0软件设计引物, 引物由上海英骏生物技术有限公司合成, Syk上游引物: 5'-CTG CCACTACCACTCCC-3', Syk下游引物: 5'-CAGCACCTTCCCTTCG-3'. 内参β-actin上游引物: 5'-GAT TGCCTCAGGACATTTCTG-3'; β-actin下游引物: 5'-GATTGCTCAGGACATTTCTG-3'. 扩增片段长度分别为379、690 bp.
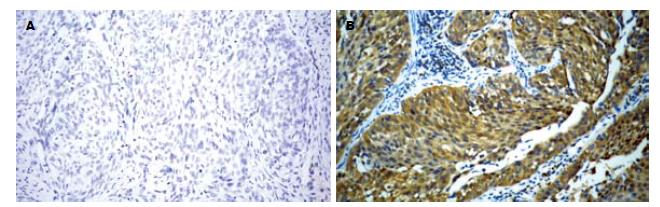
1.2.1 Max VisionTM快捷免疫组织化学染色法检测Syk蛋白表达: 石蜡切片脱蜡和水化后, 用PBS冲洗3次, 每次3 min. 柠檬酸钠加热法对抗原进行修复. 室温下, 切片置于3%过氧化氢中10 min, PBS冲洗3次, 每次3 min, 除去PBS液. 加一抗室温下孵育60 min. PBS冲洗3次, 每次3min, 除去PBS液. 加Max VisionTM试剂室温下孵育10-15 min. PBS冲洗3次, 每次3 min, 除去PBS液. 加新鲜配制的二氨基联苯胺(diaminobenzidine, DAB)显色溶液, 显微镜下观察3-5 min. 用自来水冲洗后加入苏木素复染, 再用自来水冲洗返蓝. 切片经梯度酒精脱水干燥、二甲苯透明、中性树胶封片, 显微镜下观察、照相. 每批染色均设阴性空白对照, 即以PBS代替一抗作阴性对照, 用人Burkitt淋巴瘤细胞作阳性对照. 由两位病理科医师分别双盲阅片, Syk以细胞质中出现棕黄色颗粒为阳性, 每例切片至少计数10个400倍视野, 计数阳性细胞占所有细胞的百分数, 以10%-30%细胞呈弱、中等强度阳性反应为标准, 分为阴性和阳性两个等级.
1.2.2 组织RNA提取: 组织标本放入研钵中并倒入液氮研磨, 组织磨碎后加入1 mL TRIzol研磨成粉状, 移至1.5 mL的经DEPC水处理过的无菌离心管中, 其余步骤严格按TRIzol RNA提取试剂说明书进行, 所得RNA经紫外分光光度仪测定A260和A280值, 检测总RNA的纯度和含量.
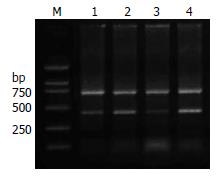
1.2.3 RT-PCR扩增: 逆转录总体系为20 µL严格按照试剂盒说明书步骤合成cDNA. 以cDNA为模板进行PCR扩增. 扩增条件为94 ℃预变性3 min; 94 ℃变性40 s, 退火温度53.5 ℃, 40 s, 72 ℃延伸40 s, 35个循环; 72 ℃, 7 min. PCR产物于15 g/L的琼脂糖凝胶做电泳, 采用凝胶成像系统对电泳条带进行扫描和半定量分析, 检测图像灰度值.
统计学处理 应用SPSS13.0软件进行统计分析, 率的比较用χ2检验、Fisher精确检验, 均数比较用t检验, 结果以mean±SD表示. 检验水准α = 0.05, P<0.05为差异有统计学意义.
Syk蛋白主要定位于细胞质, 呈棕黄色颗粒状染色, 食管鳞癌及其对应癌旁组织中Syk蛋白呈阳性表达的患者分别为8例(16.67%)、43例(89.58%). 食管鳞癌组织与癌旁组织中Syk蛋白阳性表达率的差异有显著统计学意义(P<0.05, 表1, 图1).
| 阳性数(n) | 阳性率(%) | χ2值 | P值 | |
| 肿瘤组织 | 8 | 16.67 | 51.24 | 0.00 |
| 癌旁组织 | 43 | 89.58 |
Syk蛋白表达与肿瘤TNM分期及淋巴结转移相关(P<0.05), 与肿瘤大小无关(P>0.05, 表2).
| 临床病理指标 | n | 阳性 n(%) | χ2值 | P值 |
| TNM分期 | ||||
| 早期(Ⅰ+Ⅱ) | 22 | 7(31.82) | 6.713 | 0.010 |
| 中晚期(Ⅲ+Ⅳ) | 26 | 1(3.85) | ||
| 淋巴结转移 | ||||
| 阳性 | 33 | 1(3.03) | 14.140 | 0.000 |
| 阴性 | 15 | 7(29.41) | ||
| 组织大小(cm) | ||||
| >5 | 25 | 4(16.00) | 0.017 | 0.897 |
| ≤5 | 23 | 4(17.39) |
Syk mRNA在癌组织和癌旁组织中平均灰度值分别是0.2641±0.1330和0.7708±0.3335, 两者的平均灰度值比较有统计学意义(t = -11.27, P<0.05), Syk mRNA在食管鳞癌组织中表达下调(图2).
食管癌是世界上最常见的十种恶性肿瘤之一, 我国每年因食管癌死亡者约15万人, 占全部恶性肿瘤死亡人数近四分之一, 其中鳞状细胞癌占90%. 食管癌患者早期常缺乏明显症状, 后期多死于局部浸润、远处转移及术后复发. 目前尚缺乏准确检测食管癌早期病变和监测食管癌早期转移和复发的方法, 也缺乏治疗食管癌的有效手段. 目前认为食管癌恶性生物学特性的表达依赖于多因素影响和多基因调控, 基因变异(包括癌基因的激活、抑癌基因的变异和缺失等)对食管癌生成和转移的影响是近年来食管癌研究的热点. 有研究发现一些基因的异常如p53突变、p16和/或p15表达的缺失、Rb蛋白的表达降低、Cyclin D1基因扩增、c-myc、环氧合酶2(cyclooxygenase 2, COX-2)、TMEM16A、Cyclin B1和CDK1高表达等可能导致食管鳞癌的发生[1-4]. 已知食管鳞癌的发生是一个多因素、多阶段、多步骤的渐进过程[5], 近年来一种新型非受体型酪氨酸激酶基因-Syk基因作为候选抑癌基因在肿瘤发生中的作用受到关注. Syk基因由日本学者Taniguchi等[6]于1991年从猪脾cDNA克隆出来. 该基因位于人类染色体9q22, 蛋白质相对分子质量为72 kDa, 由629个氨基酸组成. 最初Syk被认为是造血细胞特有的信号分子, 在淋巴细胞的成熟和免疫细胞的激活中发挥作用[7]. Syk可能通过参与这些细胞中免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif, ITAM)介导的信号转导过程从而影响免疫细胞的增殖、分化及吞噬等功能[8]. 有研究认为Syk可促进B淋巴细胞的增长[9]. 近来发现, Syk在多种非造血细胞如乳腺上皮细胞[10]、血管内皮细胞[11]、气道上皮细胞[12]、黑色素细胞[13]等细胞中也有广泛表达. 自从Coopman等[14]首先发现乳腺癌细胞中有Syk表达缺失现象后大量研究先后证明在多种肿瘤如胃癌[15,16]、肝细胞癌[17]、胰腺癌[18]、结直肠癌[19]、口腔癌[20]等的肿瘤组织中亦广泛存在Syk表达缺失的现象. 本研究发现, Syk蛋白和mRNA在食管鳞癌癌旁组织中阳性表达率明显高于食管鳞癌肿瘤组织中的阳性表达率, 表明Syk的表达缺失亦为食管鳞癌发生过程中的重要分子事件, 提示Syk可能是抑制食管鳞癌肿瘤发生的重要因子. Syk基因在肿瘤组织中出现表达缺失的机制及在肿瘤发生中的意义尚不清楚, 多数研究支持Syk在肿瘤发生过程中发挥抑制性调节作用, 其可能的作用机制有: (1)影响免疫细胞活性: Sada等[21]研究显示, Syk基因表达缺失会导致免疫细胞发育及成熟障碍, 严重者还可能出现重症联合免疫缺陷病(severe combined immunodeficiency disease, SCID). Syk功能低下时会削弱机体的免疫监测能力, 从而导致机体对突变、异常增生的细胞失去免疫力, 进而导致肿瘤的发生; (2)影响血管内皮细胞功能: Carter等[22]发现, Syk与HER2/neu是一对功能相反的抑癌/癌基因, HER2/neu的过度表达可诱导血管内皮细胞的收缩, 从而使肿瘤细胞易于穿过血管屏障而易于发生转移; 而Syk可抑制HER2/neu的收缩血管内皮细胞作用从而抑制肿瘤的转移; (3)影响细胞信号转导通路: Mahabeleshward等[23]的研究表明Syk可以抑制磷脂酰肌醇激酶-3(phosphatidylinositol 3 kinase, PI3 K)的活性, 进而抑制肿瘤细胞的分裂及核因子-B(Nuclear factor-B, NF-B)调节的尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)的激活分泌, 而研究已经发现uPA的激活、分泌与多种恶性肿瘤的发生、发展及转移的信号转导通路密切相关, 提出Syk可能是通过影响细胞信号的转导而影响肿瘤的发生; (4)影响肿瘤细胞的成瘤能力: Zyss等[24]观察到Syk于细胞中心小体内能抑制细胞分裂和增殖从而抑制肿瘤细胞的成瘤能力, 因此肿瘤细胞中心小体异常有可能在Syk促使细胞过度增殖恶性转化的过程中发挥作用. (5)与Syk基因甲基化水平有关: Wallner等[25]研究发现, 血清甲基化Syk持续存在可以作为直肠癌患者术后肿瘤组织残存的标志, 动态观察血清甲基化Syk的水平和变化, 可以了解直肠癌患者的病情变化和转归, 同时也可以预测直肠癌患者术后的生存. Wang等[26]研究发现, 胃癌组织Syk基因表达低于相邻正常胃组织, 胃癌组织Syk基因启动子甲基化比率显著高于相邻正常组织. Lee等[27]发现在肝癌患者中存在Syk基因甲基化. 我们先前的研究[28]发现相当一部分乳腺癌细胞发生非选择性的Syk基因超甲基化, 而所有临近的正常乳腺组织的DNA不发生甲基化. 应用甲基化抑制因子5-aza-2'-deoxycytidine处理细胞可以使Syk阴性的乳腺癌细胞重新表达. 上述Syk与肿瘤相关性的研究提示Syk基因表达缺失会导致肿瘤的发生和发展, 为我们展示了一个极有前景的肿瘤防治新领域[29,30]. 本实验研究还证明, Syk的低表达与食管鳞癌的淋巴结转移倾向有关, 支持Syk基因有抑制食管鳞癌肿瘤淋巴道转移的作用及Syk在食管鳞癌组织中呈现明显的表达缺失与其恶性转移倾向有关的假说. 同时也表明食管鳞癌发生过程中存在Syk基因在转录水平的明显缺失. Syk对食管鳞癌的恶性生物学行为影响是否与上述机制有关, Syk如何影响食管鳞癌的发生及转移还有不少问题需要一步阐明: (1)不同分子亚型Syk在食管鳞癌细胞中的具体定位及功能差异对食管鳞癌发生发展的影响; (2)Syk在食管鳞癌恶性生物学行为中涉及的信号转导通路及与其他癌基因及抑癌基因的相互作用; (3)Syk在食管鳞癌中异常基因产物及其病理效应的分子调控机制等. 目前在临床上尚未发现针对Syk基因进行肿瘤诊疗的报道. 根据我们以上实验结果, 我们认为以下针对Syk与食管鳞癌的诊疗思路值得探讨: (1)基因诊断: 建立以Syk为分子靶标, 具有高度敏感性和高度特异性、适合临床开展的Syk基因诊断技术可望对早期食管鳞癌诊断及监测食管鳞癌术后复发转移的提供有用的帮助; (2)基因治疗: 如能将Syk基因转染入免疫细胞, 将可能实现激活更多的免疫细胞发挥抗食管鳞癌免疫作用; 而将Syk基因转染入食管鳞癌细胞, 将有可能阻止肿瘤细胞的生长与扩散; 或将Syk基因联合转染给这两种细胞可望促进这两种细胞发挥协同抗肿瘤作用; (3)应用甲基化抑制剂开展抗肿瘤治疗: 通过早期检测食管鳞癌组织中Syk基因启动子甲基化状态, 选择性应用甲基化抑制剂以恢复Syk基因表达, 可望发挥其抑癌作用. 目前已经有学者开始运用DNA甲基化抑制剂调节肿瘤细胞中Syk的表达情况进行抗肿瘤研究. 相信随着对Syk研究的不断深入, 必将在不久的将来为临床上食管鳞癌的防治提供崭新的途径.
ESCC是全球最常见的恶性肿瘤之一, 在我国肿瘤死因中居第4位. 食管癌患者早期常缺乏明显症状, 后期多死于局部浸润、远处转移及术后复发, ESCC的恶性生物学行为发生机制尚未阐明, 目前认为ESCC的发生是多病因、多基因、多阶段相互作用的过程. 近来发现一种非受体酪氨酸激酶Syk在多种肿瘤组织中存在表达缺失, 这些现象与肿瘤生物学行为的关系受到关注.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心.
目前研究认为Syk与多种肿瘤的发生及转移有关, 相关分子机制的研究中还有不少问题需要一步阐明: (1)不同分子亚型Syk在食管鳞癌细胞中的具体定位及功能差异对食管鳞癌发生发展的影响; (2)Syk在食管鳞癌恶性生物学行为中涉及的信号转导通路及与其他癌基因及抑癌基因的相互作用; (3)Syk在食管鳞癌中异常基因产物及其病理效应的分子调控机制等.
已有多项研究支持Syk在肿瘤发生过程中发挥抑制性调节作用, 目前对其可能的机制研究主要包括促进免疫细胞活性、影响血管内皮细胞功能、影响细胞信号转导通路及肿瘤细胞的成瘤能力等. 不少研究认为Syk基因在肿瘤组织中表达的缺失与Syk基因甲基化水平有关.
Syk是目前发现的唯一具有抑癌作用的酪氨酸激酶. 多项研究发现, Syk表达缺失可能与多种肿瘤的形成和转移有关. 但迄今未见Syk在食管鳞癌组织表达的研究报道.
本研究表明Syk的表达缺失是食管鳞癌发生过程中的重要分子事件, 提示Syk可能是抑制食管鳞癌肿瘤发生的重要因子. 本研究为进一步阐明食管鳞癌的发生发展过程中Syk基因表达及其在PTKs相关信号转导通路中的作用, 探讨Syk基因表达异常作为食管癌早期诊断生物学标志和可能分子治疗靶标提供科学的实验依据.
免疫受体酪氨酸活化基序(ITAM): 免疫细胞活化相关受体(如BCR/Igα/Igβ, TCR/CD3、FcαR和FcRγ等)胞质区所共有的以酪氨酸残基(tyrosine,Y)为基础的氨基酸序列基序, 其特征为: 两个酪氨酸残基被大约13个其他氨基酸残基隔开(...YXX [L/V] X 7-11 YXX [L/V]...), 其中酪氨酸是蛋白激酶磷酸化位点, 被磷酸化后能够与信号转导途径下游的信号分子结合, 导致细胞的活化.
本研究选题尚可, 设计合理, 结果可靠, 为Syk在食管鳞癌发生和发展及其在食管鳞癌防治中的进一步研究提供了一个很好的思路.
编辑: 李军亮 电编:吴鹏朕
| 1. | Felin IP, Grivicich I, Felin CR, Regner A, Rocha AB. [p53, p16 E COX-2 expression in esophageal squamous cell carcinoma and histopathological association]. Arq Gastroenterol. 2008;45:308-312. [PubMed] [DOI] |
| 2. | Stoner GD, Gupta A. Etiology and chemoprevention of esophageal squamous cell carcinoma. Carcinogenesis. 2001;22:1737-1746. [PubMed] [DOI] |
| 3. | 赵 春玲, 陈 丽梅, 高 志芹, 杜 长青, 潘 智芳, 于 文静. Cyclin B1、CDK1在食管鳞癌组织中的表达及临床意义. 世界华人消化杂志. 2009;17:2374-2378. [DOI] |
| 5. | Mandard AM, Hainaut P, Hollstein M. Genetic steps in the development of squamous cell carcinoma of the esophagus. Mutat Res. 2000;462:335-342. [PubMed] [DOI] |
| 6. | Taniguchi T, Kobayashi T, Kondo J, Takahashi K, Nakamura H, Suzuki J, Nagai K, Yamada T, Nakamura S, Yamamura H. Molecular cloning of a porcine gene syk that encodes a 72-kDa protein-tyrosine kinase showing high susceptibility to proteolysis. J Biol Chem. 1991;266:15790-15796. [PubMed] |
| 7. | Abtahian F, Guerriero A, Sebzda E, Lu MM, Zhou R, Mocsai A, Myers EE, Huang B, Jackson DG, Ferrari VA. Regulation of blood and lymphatic vascular separation by signaling proteins SLP-76 and Syk. Science. 2003;299:247-251. [PubMed] [DOI] |
| 8. | Turner M, Schweighoffer E, Colucci F, Di Santo JP, Tybulewicz VL. Tyrosine kinase SYK: essential functions for immunoreceptor signalling. Immunol Today. 2000;21:148-154. [PubMed] [DOI] |
| 9. | Gururajan M, Dasu T, Shahidain S, Jennings CD, Robertson DA, Rangnekar VM, Bondada S. Spleen tyrosine kinase (Syk), a novel target of curcumin, is required for B lymphoma growth. J Immunol. 2007;178:111-121. [PubMed] |
| 10. | Repana K, Papazisis K, Foukas P, Valeri R, Kortsaris A, Deligiorgi E, Kyriakidis D. Expression of Syk in invasive breast cancer: correlation to proliferation and invasiveness. Anticancer Res. 2006;26:4949-4954. [PubMed] |
| 11. | Bijli KM, Fazal F, Minhajuddin M, Rahman A. Activation of Syk by protein kinase C-delta regulates thrombin-induced intercellular adhesion molecule-1 expression in endothelial cells via tyrosine phosphorylation of RelA/p65. J Biol Chem. 2008;283:14674-14684. [PubMed] [DOI] |
| 12. | Ulanova M, Puttagunta L, Marcet-Palacios M, Duszyk M, Steinhoff U, Duta F, Kim MK, Indik ZK, Schreiber AD, Befus AD. Syk tyrosine kinase participates in beta1-integrin signaling and inflammatory responses in airway epithelial cells. Am J Physiol Lung Cell Mol Physiol. 2005;288:L497-L507. [PubMed] [DOI] |
| 13. | Bailet O, Fenouille N, Abbe P, Robert G, Rocchi S, Gonthier N, Denoyelle C, Ticchioni M, Ortonne JP, Ballotti R. Spleen tyrosine kinase functions as a tumor suppressor in melanoma cells by inducing senescence-like growth arrest. Cancer Res. 2009;69:2748-2756. [PubMed] [DOI] |
| 14. | Coopman PJ, Do MT, Barth M, Bowden ET, Hayes AJ, Basyuk E, Blancato JK, Vezza PR, McLeskey SW, Mangeat PH. The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells. Nature. 2000;406:742-747. [PubMed] [DOI] |
| 15. | Nakashima H, Natsugoe S, Ishigami S, Okumura H, Matsumoto M, Hokita S, Aikou T. Clinical significance of nuclear expression of spleen tyrosine kinase (Syk) in gastric cancer. Cancer Lett. 2006;236:89-94. [PubMed] [DOI] |
| 17. | Yuan Y, Wang J, Li J, Wang L, Li M, Yang Z, Zhang C, Dai JL. Frequent epigenetic inactivation of spleen tyrosine kinase gene in human hepatocellular carcinoma. Clin Cancer Res. 2006;12:6687-6695. [PubMed] [DOI] |
| 18. | Layton T, Stalens C, Gunderson F, Goodison S, Silletti S. Syk tyrosine kinase acts as a pancreatic adenocarcinoma tumor suppressor by regulating cellular growth and invasion. Am J Pathol. 2009;175:2625-2636. [PubMed] [DOI] |
| 20. | Ogane S, Onda T, Takano N, Yajima T, Uchiyama T, Shibahara T. Spleen tyrosine kinase as a novel candidate tumor suppressor gene for human oral squamous cell carcinoma. Int J Cancer. 2009;124:2651-2657. [PubMed] [DOI] |
| 21. | Sada K, Takano T, Yanagi S, Yamamura H. Structure and function of Syk protein-tyrosine kinase. J Biochem. 2001;130:177-186. [PubMed] |
| 22. | Carter WB, Hoying JB, Boswell C, Williams SK. HER2/neu over-expression induces endothelial cell retraction. Int J Cancer. 2001;91:295-299. [PubMed] [DOI] |
| 23. | Mahabeleshwar GH, Kundu GC. Syk, a protein-tyrosine kinase, suppresses the cell motility and nuclear factor kappa B-mediated secretion of urokinase type plasminogen activator by inhibiting the phosphatidylinositol 3'-kinase activity in breast cancer cells. J Biol Chem. 2003;278:6209-6221. [PubMed] [DOI] |
| 24. | Zyss D, Montcourrier P, Vidal B, Anguille C, Mérezègue F, Sahuquet A, Mangeat PH, Coopman PJ. The Syk tyrosine kinase localizes to the centrosomes and negatively affects mitotic progression. Cancer Res. 2005;65:10872-10880. [PubMed] [DOI] |
| 25. | Wallner M, Herbst A, Behrens A, Crispin A, Stieber P, Göke B, Lamerz R, Kolligs FT. Methylation of serum DNA is an independent prognostic marker in colorectal cancer. Clin Cancer Res. 2006;12:7347-7352. [PubMed] [DOI] |
| 26. | Wang S, Ding YB, Chen GY, Xia JG, Wu ZY. Hypermethylation of Syk gene in promoter region associated with oncogenesis and metastasis of gastric carcinoma. World J Gastroenterol. 2004;10:1815-1818. [PubMed] |
| 27. | Lee HS, Kim BH, Cho NY, Yoo EJ, Choi M, Shin SH, Jang JJ, Suh KS, Kim YS, Kang GH. Prognostic implications of and relationship between CpG island hypermethylation and repetitive DNA hypomethylation in hepatocellular carcinoma. Clin. Cancer Res. 2009;15:812-820. [PubMed] [DOI] |
| 28. | Yuan Y, Liu H, Sahin A, Dai JL. Reactivation of SYK expression by inhibition of DNA methylation suppresses breast cancer cell invasiveness. Int J Cancer. 2005;113:654-659. [PubMed] [DOI] |