修回日期: 2009-03-07
接受日期: 2009-03-09
在线出版日期: 2009-03-28
目的: 观察三叶因子1(TFF1)和血管内皮生长因子(VEGF)在正常胃黏膜组织、癌旁组织和胃癌组织中的表达, 并探讨TFF1与胃癌发生发展过程中血管生成的关系.
方法: 采用SP免疫组化方法检测42例正常组织、66例癌旁组织和66例胃癌组织中TFF1和VEGF的表达, 以CD34标记血管内皮, 测定MVD.
结果: TFF1表达在正常胃黏膜组织→癌旁组织→胃癌组织中呈逐渐减弱趋势(209.40±16.00, 199.12±16.68, 189.17±16.20), 差异具有显著性(P<0.01), 而VEGF的表达和MVD呈逐渐上升趋势(69.7%, 40.9%, 35.7%; 38.90±6.74, 28.68±5.08, 25.13±4.46). MVD值与TFF1灰度值呈正相关(r = 0.811, P<0.01), 即MVD值与TFF1的表达呈负相关.
结论: TFF1作为一种胃癌特异性抑制因子, 在胃癌发生发展过程中并未促进新生血管的生成.
引文著录: 赖铭裕, 廖晓霞, 林瑶光, 梁志海, 陈晖, 李素艳, 蒋敦科, 刘莹. 三叶因子1与胃癌发生发展过程中血管生成的关系. 世界华人消化杂志 2009; 17(9): 931-934
Revised: March 7, 2009
Accepted: March 9, 2009
Published online: March 28, 2009
AIM: To investigate the expression of trefoil factor 1 (TFF1) and vascular endothelial growth factor (VEGF) in normal gastric mucosa, adjacent carcinoma and gastric carcinoma and to explore its role in neovas-cularization.
METHODS: The expressions of TFF1, VEGF and MVD (CD34 monoclonal antibody labeling) were determined by immunohistochemical method in 174 gastric specimens including 42 normal gastric mucosa, 66 adjacent carcinoma and 66 gastric carcinomas.
RESULTS: In normal control group, adjacent carcinoma and gastric carcinoma group, the expression of TFF1 had a decreasing tendency (209.40 ± 16.00, 199.12 ± 16.68, 189.17 ± 16.20, P < 0.01), but the expression of VEGF and the MVD had a increasing tendency (69.7%, 40.9%, 35.7%; 38.90 ± 6.74, 28.68 ± 5.08, 25.13 ± 4.46). MVD was positively correlated with grey levels of TFF1 (r = 0.811, P < 0.01), in other words, there was a negative correlation between the MVD values and the expression of TFF1.
CONCLUSION: TFF1, a specific anti-oncogene for gastric carcinoma, doesn't have a close correlation with tumor vessel neogenesis.
- Citation: Lai MY, Liao XX, Lin YG, Liang ZH, Chen H, Li SY, Jiang DK, Liu Y. Expression of trefoil factor 1 in gastric cancer and its correlation with neovascularization. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 931-934
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.931
近年来, 关于胃癌发病机制的研究中, 三叶因子(trefoil factors, TFFs)与胃癌的发生、发展逐渐引起关注. TFF1是三叶因子家族之一, 其分子中具有特定的三叶草结构域, 这种结构的稳定性使其具有明显的抗酸、抗蛋白酶和抗热分解特性, 对胃肠道黏膜有保护和修复作用. 有研究发现TFF1具有血管内皮生长因子(vascular endothelial growth factor, VEGF)同样的血管生成作用, 可促进鸡胚绒毛尿囊膜的血管生成, 可诱导人脐静脉内皮细胞形成类微血管结构. 因此, 我们用免疫组织化学方法研究TFF1和VEGF在正常胃黏膜组织、癌旁组织和胃癌组织的表达情况, 初步探讨其与胃癌发生发展中血管生成的关系.
选取广西医科大学第一附属医院2005-01/2007-09接受胃大部切除术的胃癌标本66例, 均经组织病理学检查证实. 所有标本术前均未接受非甾体抗炎药治疗及放化疗. 其中, 男44例, 女22例, 年龄29-74(中位年龄55.9)岁. 其中高、中分化腺癌18例, 低未分化腺癌48例; 未侵及浆膜层者26例, 侵及浆膜层及浆膜外者40例; 发生局部淋巴结转移者29例, 无局部淋巴结转移者37例. 同时取距癌缘3-5 cm的癌旁组织66例, 正常胃黏膜组织42例作为对照组. 试剂采用鼠抗人TFF1 mAb(即用型)、链霉菌抗生素蛋白-生物素-过氧化物酶(SP)免疫组织化学试剂盒、二氨基联苯(DAB)显色剂均购自福建迈新生物技术开发公司, 鼠抗人VEGF mAb、鼠抗人CD34 mAb(工作浓度1:50), 购自美国Santa Cruz公司.
所有标本均经100 g/L甲醛固定, 常规脱水、透明、渗蜡、包埋, 4 μm厚连续切片. 常规脱蜡、水化, 采用免疫组织化染色超敏两步法(SP染色), DAB显色, 苏木素复染, 吹干, 具体操作按SP试剂盒说明书进行. 阴性对照采用生理盐水磷酸盐缓冲液(PBS)代替一抗, 余步骤相同.
阳性信号为细胞胞质和胞膜上出现黄色或棕黄色染色. 每例取5个高倍视野(×400), 用病理图像分析仪测定阳性信号平均灰度值, 灰度值越高, TFF1表达越弱. 每张切片中看到有>5%的肿瘤细胞胞质或胞膜染色阳性, 即判定为VEGF阳性. 任何被染成棕色的血管内皮细胞或血管内皮细胞簇均作为一个血管计数. 每例先在低倍镜(×100)下观察全片以确定肿瘤内血管密度最高处, 再在高倍镜(×200)下记录5个视野内的微血管数, 取其平均值作为该病例的MVD值.
统计学处理 使用统计学软件SPSS11.5进行分析, 采用χ2检验, P<0.05为差异具有统计学意义.
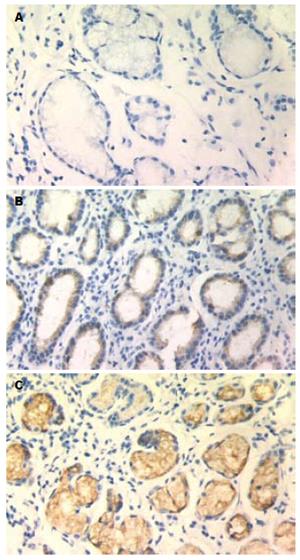
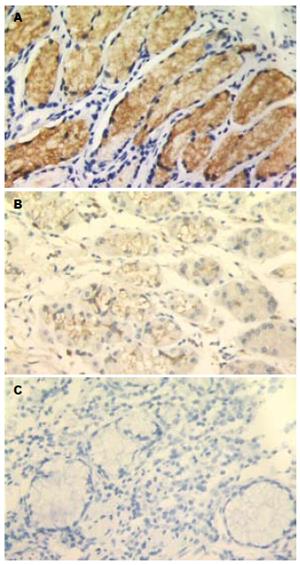
TFF1在胃癌组织、癌旁组织和正常胃黏膜组织中的阳性信号平均灰度值分别为209.40±16.00, 199.12±16.68和189.17±16.20, 各组间两两比较, 差异均有统计学意义(P<0.01). VEGF在胃癌组织、癌旁组织和正常胃黏膜组织中的阳性表达率分别为69.7%(46/66), 40.9%(27/66), 35.7%(15/42), 各组间两两比较, 差异均有统计学意义(P<0.01, 图1-2).
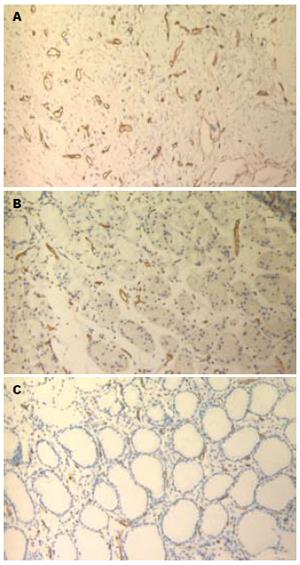
MVD在胃癌组织、癌旁组织和正常组织中的平均值分别为38.90±6.74, 28.68±5.08, 25.13±4.46, 各组间两两比较, 差异有统计学意义(P<0.01, 图3).
TFF1在VEGF阳性表达组和阴性表达组中的阳性信号平均灰度值分别为213.02±16.29和201.09±11.99(P<0.01); VEGF阳性表达组和阴性表达组中MVD平均值分别为41.08±6.93, 33.90±2.01, VEGF阳性表达组的MVD值高于阴性表达组中的MVD值(P<0.01); MVD值与TFF1灰度值呈正相关(r = 0.811, P<0.01), 即MVD值与TFF1的表达呈负相关.
肿瘤的增殖和转移依赖于血管生成[1]. 多数研究表明[2], 实体肿瘤的生长需要血管来提供营养和排泄自身代谢产物. 当肿瘤的体积<1 mm3时这一过程可通过组织渗透来完成, 当其体积>2 mm3时, 其发展必须依赖新生血管的形成, 进而发生扩散转移. 恶性肿瘤发展由无血管期过渡到血管期, 具有诱导血管生成的能力, 此外肿瘤细胞周边的一些细胞也可能接受某些信号传递, 分泌某些生长因子促进肿瘤毛细血管生成. 目前常采用MVD来定量评估肿瘤的新生血管.
VEGF是1989年Ferrara et al从牛垂体滤泡星状细胞培养液中首先纯化出来, 并发现具有促进血管内皮细胞有丝分裂的活性[3]. VEGF是由各种肿瘤细胞及某些正常细胞产生的[4-5], 被认为是肿瘤血管形成中最关键的驱动因子. Ichikuta et al[6]研究发现VEGF在胃癌组织中阳性表达率为39%, 与血管浸润有密切关系. Kakeji et al[7]研究发现VEGF在胃癌中的阳性率为42%, 而且VEGF阳性表达的胃癌更易发生血行转移.
TFF1于1982年由Masiakowski et al[8]在雌激素诱导的人乳腺癌细胞系MCF-7中获得. TFF1在正常组织中主要由胃窦和胃体的隐窝及表层上皮的黏膜细胞产生, 而在食管、结肠、胰腺、肝脏、前列腺、卵巢等组织中低水平表达甚至不表达. 大量研究发现TFF1表达于正常胃黏膜, 在胃黏膜肠化、不典型增生到胃癌的发展过程中TFF1表达逐渐降低, 50%甚至更多的胃癌组织TFF1表达缺失[9-10]. 提示TFF1进行性缺失参与早期胃癌发生. Park et al[11]对基因图谱分析时发现, 原发性胃癌发生时, 人染色体21q22常有复位基因的缺失, 而此位点正是TFF1的基因所处位置, 表明TFF1在胃癌发生的早期起作用, 进而可能影响相关癌基因及抑癌基因的改变, 促进胃癌的发生. 认为TFF1可能是一种胃癌特异性抑制因子[12-13]. 研究发现TFF1可促进鸡胚绒毛尿囊膜的血管生成, 诱导人脐静脉内皮细胞形成类微血管结构[14]. 本研究显示在正常胃黏膜组织→癌旁组织→胃癌组织中, TFF1表达呈逐渐减弱趋势, 差异具有显著性(P<0.01), 而VEGF的表达和MVD呈逐渐上升趋势(P<0.01). TFF1在VEGF阳性表达组中的表达低于阴性表达组, 而MVD值则相反, TFF1的表达与MVD呈负相关. 可认为TFF1作为一种胃癌特异性抑制因子, 在胃正常组织中高表达, 而在胃癌发生发展过程中表达逐渐减少, 而VEGF的表达渐增加, 诱导血管的生成, 为肿瘤的浸润、转移创造条件. 胃癌组织中TFF1与血管生成的关系有待进一步的研究, 明确其在胃癌增殖、浸润及转移中的作用机制为胃癌的防治开辟新的思路.
血管新生是肿瘤生长转移的主要原因, 血管内皮生长因子(VEGF)与肿瘤血管新生过程中发挥关键作用. 国外研究发现TFF1具有VEGF同样的血管生成作用, 但TFF1作为胃癌的一个抑制因子, 在胃癌的发生发展过程中与血管生成的关系未明.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
TFF1作为胃癌的特异性抑制因子已有研究证实, 但其在胃癌生长转移中的作用未明. 本文通过研究探讨其与肿瘤中血管新生的关系.
研究发现TFF1可促进鸡胚绒毛尿囊膜的血管生成, 诱导人脐静脉内皮细胞形成类微血管结构.
本实验联合检测胃癌组织的TFF1、血管内皮生长因子及微血管密度, 有助于了解TFF1在胃癌发病机制中的作用途径, 了解他与其他指标的相互关系, 以及各观察指标在胃癌发病机制中各自的地位.
本文初步探讨了三叶因子1在胃癌发生发展过程中与新生血管生成的关系, 对该领域的进一步研究提供了实验依据, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Folkman J. Angiogenesis and angiogenesis inhibition: an overview. EXS. 1997;79:1-8. [PubMed] [DOI] |
| 2. | Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell. 1996;86:353-364. [PubMed] [DOI] |
| 3. | Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun. 1989;161:851-858. [PubMed] [DOI] |
| 4. | Collins PD, Connolly DT, Williams TJ. Characterization of the increase in vascular permeability induced by vascular permeability factor in vivo. Br J Pharmacol. 1993;109:195-199. [PubMed] [DOI] |
| 5. | Zagzag D. Angiogenic growth factors in neural embryogenesis and neoplasia. Am J Pathol. 1995;146:293-309. [PubMed] |
| 6. | Ichikura T, Tomimatsu S, Ohkura E, Mochizuki H. Prognostic significance of the expression of vascular endothelial growth factor (VEGF) and VEGF-C in gastric carcinoma. J Surg Oncol. 2001;78:132-137. [PubMed] [DOI] |
| 7. | Kakeji Y, Koga T, Sumiyoshi Y, Shibahara K, Oda S, Maehara Y, Sugimachi K. Clinical significance of vascular endothelial growth factor expression in gastric cancer. J Exp Clin Cancer Res. 2002;21:125-129. [PubMed] |
| 8. | Masiakowski P, Breathnach R, Bloch J, Gannon F, Krust A, Chambon P. Cloning of cDNA sequences of hormone-regulated genes from the MCF-7 human breast cancer cell line. Nucleic Acids Res. 1982;10:7895-7903. [PubMed] [DOI] |
| 9. | Luqmani Y, Bennett C, Paterson I, Corbishley CM, Rio MC, Chambon P, Ryall G. Expression of the pS2 gene in normal, benign and neoplastic human stomach. Int J Cancer. 1989;44:806-812. [PubMed] [DOI] |
| 10. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [PubMed] [DOI] |
| 11. | Park WS, Oh RR, Park JY, Yoo NJ, Lee SH, Shin MS, Kim SY, Kim YS, Lee JH, Kim HS. Mapping of a new target region of allelic loss at 21q22 in primary gastric cancers. Cancer Lett. 2000;159:15-21. [PubMed] [DOI] |
| 12. | Lefebvre O, Chenard MP, Masson R, Linares J, Dierich A, LeMeur M, Wendling C, Tomasetto C, Chambon P, Rio MC. Gastric mucosa abnormalities and tumorigenesis in mice lacking the pS2 trefoil protein. Science. 1996;274:259-262. [PubMed] [DOI] |
| 13. | Machado JC, Carneiro F, Ribeiro P, Blin N, Sobrinho-Simões M. pS2 protein expression in gastric carcinoma. An immunohistochemical and immunoradiometric study. Eur J Cancer. 1996;32A:1585-1590. [PubMed] [DOI] |