修回日期: 2009-01-20
接受日期: 2009-02-09
在线出版日期: 2009-03-28
目的: 探讨永生化骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)的生物学特性.
方法: 通过质粒pCMVSV40T/PUR导入大鼠BMSCs, 建立永生化BMSCs. 在倒置显微镜下观察细胞形态; 采用检测碱性磷酸酶的活性, 了解永生化BMSCs是否可分化为成骨细胞; 采用裸鼠皮下接种实验检测细胞的致瘤性; 应用不同血清浓度进行细胞培养及冻存, 描绘其生长曲线及复苏后的活性.
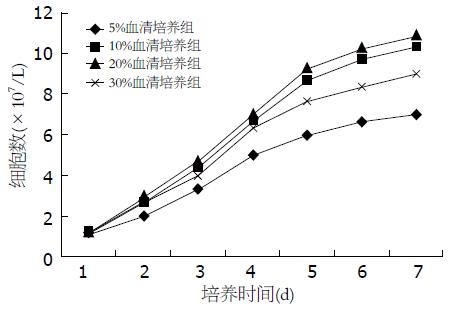
结果: 未导入质粒的BMSCs培养至15代后细胞不能继续传代, 呈明显衰老迹象, 而永生化BMSCs培养至5代后仍可保持较好的活性, 但具有明显接触抑制; 永生化BMSCs具有分化为成骨细胞的能力; 裸鼠接种后无致瘤性; 与其他血清浓度相比, 20%血清培养组的细胞生长速度较快; 50%及90%血清组其复苏后较20%血清组活性高(P<0.05).
结论: 在体外, pCMVSV40T/PUR构建的永生化BMSCs具有活性较好等特性, 且无成瘤性, 可为BMSCs的研究及应用提供大量的细胞来源.
引文著录: 方驰华, 程斌, 范应方. 永生化骨髓间充质干细胞的生物学特性. 世界华人消化杂志 2009; 17(9): 882-885
Revised: January 20, 2009
Accepted: February 9, 2009
Published online: March 28, 2009
AIM: To study biological characteristics of immortalizing bone marrow mesenchymal stem cells (BMSCs).
METHODS: Plasmid pCMVSV40T/PUR containing the simian virus 40 large T antigene gene (SV40Tag) was transfected into BMSCs. The cell shape of immortalized BMSCs was observed. Its capacity to differentiate into osteoblast cells was detected through the activity of ALP. Its tumorigenicity was examined using the nude mice experiment. Growth curve of cells in different serum concentration culture was described and its activity was measured.
RESULTS: Untreated BMSCs, after fifteenth passages, could not passage, while immortalized BMSCs of this passage preserved good activity but with contact inhibition. Immortalized BMSCs differentiated into osteoblasts. The cells, which were injected into nude mice, had no tumorigenicity. The immortalized BMSCs, cultured in 20% serum concentration, growed faster than that in other serum concentrations. The activity of immortalized BMSCs, which were frozen by 50% and 90% of serum concentration, were higher than that of 20%.
CONCLUSION: In vitro, the immortalized BMSCs, with pCMVSV40T/PUR, have good activity, but no tumorigenicity. The immortalized BMSCs can provide a large number of cells.
- Citation: Fang CH, Cheng B, Fan YF. Biological characteristics of immortalized bone marrow mesenchymal stem cells. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 882-885
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/882.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.882
越来越多的研究表明, 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs) 治疗器官功能衰竭有很好的疗效[1]. 同时发现BMSCs具有体外易衰老等缺点, 这严重影响了BMSCs进一步研究及临床应用[2]. 本研究通过质粒pCMVSV40T/PUR导入永生化基因SV40T建立了永生化BMSCs, 并对其特性进行分析.
DMEM培养基购自Hyclone公司, 胰蛋白酶购自Amersco公司, 胎牛血清购自美国Gibco公司, 胎盘蓝为Amersco公司产品, 碱性磷酸酶(ALP)检测试剂购置盒晶美生物工程公司, 倒置生物显微镜购置重庆光学仪器厂, 脂质体Lipofectamine2000和小剂量质粒提取试剂盒购自美国Gibco公司, pCMVSV40T/PUR质粒由瑞典Jan Holgersson教授惠赠.
1.2.1 pCMVSV40T/PUR的鉴定及转染: 采用percoll梯度离心法分离纯化大鼠的BMSCs[3]. 挑选生长状态良好、80%汇合的第3代BMSCs, 以脂质体Lipofeotin2000为载体通过质粒pCMVSV40T/PUR转染后, 细胞通过嘌呤霉素筛选后, 克隆扩大培养, 建成永生化BMSCs.
1.2.2 ALP检测成骨细胞: 取永生化BMSCs细胞, 以1×105/cm2的种植密度接种到预置盖玻片的六孔培养板中培养, 使用成骨添加剂的条件培养基(高糖DMEM完全培养液中加入地塞米松100 nmol/L、β-甘油磷酸钠10 mmol/L、维生素C 50 mg/L)持续培养, 细胞培养3 d后, 取出六孔培养板中的盖玻片, PBS冲洗5 min, 3次, 将ALP底物(按照ALP试剂盒配制: A液为2 mol/L乙二醇胺缓冲液, 每50 mL含乙二醇胺10 mL、MgCl2·6H2O 100 mg, 用浓盐酸约1.95 mL调pH至10.0; B液为30 mmol/L磷酸对硝基苯酚, 临用前将A、B液等量混合), 加2滴于盖玻片上, 和细胞内ALP直接反应, 镜下观察, 阳性细胞呈蓝黑色.
1.2.3 裸鼠接种检测细胞致瘤性: 取第15代永生化BMSCs, 用无血清培养基制备成单细胞悬液(1×1010/L). 在无菌条件下分别接种于5只周龄为4-6 wk的BALB/c-nu/nu裸小鼠腋窝皮下, 每只0.2 mL, 观察4 wk.
1.2.4 绘制永生化BMSCs生长曲线: 将永生化BMSCs以1.2×104/cm2密度置于24个6孔板内, 每板为一个单位. 根据不同的血清浓度培养分为4个组, 每组6个单位, 培养24 h后每天取各组1个单位进行计数, 取平均数, 绘制其生长曲线, 实验重复3次. 通过预实验发现下列各组细胞传代时间较短, 细胞活性较好: (1)5%胎牛血清+95% DMEM培养基(简称5%血清培养组); (2)10%胎牛血清+90% DMEM培养基(简称10%血清培养组); (3)20%胎牛血清+80% DMEM培养基(简称20%血清培养组); (4)30%胎牛血清+70% DMEM培养基(简称30%血清培养组). 本实验采用上述几组血清浓度进行细胞培养, 找到最佳的血清培养浓度.
1.2.5 检测永生化BMSCs复苏后的活性: 永生化BMSCs采用以下不同的血清浓度组进行细胞冻存: 10% DMSO+20%胎牛血清+70% DMEM培养基(简称20%血清组); 10% DMSO+50%胎牛血清+40% DMEM培养基(简称50%血清组); 10% DMSO+90%胎牛血清(简称90%血清组), 每组5个单位. 复苏后采用胎盘蓝染色进行细胞活性检测.
统计学处理 采用SPSS13.0统计软件包进行统计分析, 计量资料以mean±SD表示, 当不同组间方差齐时, 采用F检验分析, 并通过SNK-q进行两两比较; 当方差不齐时, 采用近似F检验-Wilch法, 通过Dunnett's T3进行两两比较. P<0.05为差异有显著性.
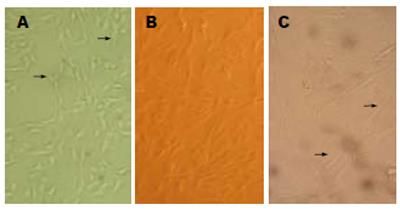
永生化BMSCs随着传代次数的增加其形态未见明显改变, 细胞传代至15代时, 细胞增长速度无减慢趋势, 图中箭头所示: 形态胞核明显, 胞质丰富, 清晰(图1A), 与4-5代未转染pCMVSV40T/PUR质粒的细胞相似(图1B), 约7-9 d传代一次, 但仍具有生长抑制特性. 未转染的BMSCs在第7代时细胞增长速度减慢, 约10 d传一代, 且细胞形态有所改变. 图中箭头所示: 当细胞传至15代时, 细胞表现出皱缩, 体积增大, 胞体变平, 很难继续传代(图1C).
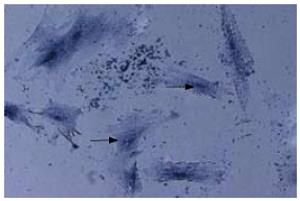
永生化BMSCs在条件培养基培养1 wk后, 细胞变为多角形, 细胞周边出现长丝状突出; 胞质中可见蓝黑色的细小颗粒, 数个细胞连成块状, 染色较强, 而散在的细胞染色略弱, 细胞边界清楚. 诱导2 wk以上, 细胞基质中可见钙沉积, 逐渐出现的矿化物至4 wk时已形成明显骨结节, 染色将结节中沉积的钙染成黑色(图2).
永生化BMSCs接种接种于4-6 wk的BALB/c-nu/nu裸小鼠后, 观察4 wk, 未见肿瘤形成.
各组细胞冻存1 mo后进行复苏, 通过胎盘蓝拒染率计算细胞存活率. 通过方差齐性分析发现各组间方差齐(P>0.05). 采用方差及SNK-q分析: 不同浓度组之间永生化BMSCs复苏后的存活率进行方差分析示差异有显著性意义(P<0.01). 进一步SNK-q两两比较显示: 90%血清组、50%血清组细胞存活率显著性高于20%血清组(P<0.01); 50%血清组与90%血清组存活率差异无统计学意义(P>0.05).
研究表明, BMSCs具有极强的自我复制能力和多向分化潜能, 来源广泛, 易于获取, 而且BMSCs具有低免疫原性, 应用方便[4-5]. Ozawa et al[6-7]表明, BMSCs暴露于受损的肝脏组织中时, 可帮助修复受损的肝脏; 同时有研究发现BMSCs在体外仍可分化为肝细胞[8-9]; Dasa et al[10-11]发现人BMSCs移植入受损的大鼠神经系统中, 可分化为少突神经胶质细胞, 使神经系统恢复较好; 还有研究表明人BMSCs可分化为软骨细胞[12-13]. 因此, BMSCs的诱导分化和移植是目前研究的热点之一.
虽然如此, 但有研究表明BMSCs传代至6代后细胞生长逐渐缓慢,呈现衰老现象[14]. 本研究室通过BMSCs细胞培养发现当传代至7代后, 细胞呈明显的衰老, 传代时间明显延长. 故细胞存在数量不足、体外扩增困难、体外传代、保存及复苏后增殖及分化能力下降等问题, 严重影响其进一步广泛应用.
Zhang et al[15]发现SV40T具有避免细胞凋亡及延长细胞寿命的特性, 通过将pCMVSV40T/PUR质粒导入前软骨细胞后, 发现细胞的生长呈S形, 随着培养时间的延长, 细胞数量随之增加, 端粒酶长度也未见明显减短, 且在无细胞生长因子的情况下当传代至30代时仍无向其他细胞分化的趋势. 但永生化BMSCs尚无进一步报道.
本研究室成功通过pCMVSV40T/PUR质粒将永生化基因SV40T导入BMSCs中, 建立了永生化BMSCs, 并传代至15代, 发现永生化BMSCs胞核明显, 胞质丰富, 活性较好, 与4代细胞相似, 而第15代未处理的BMSCs出现细胞皱缩等衰老形态, 且很难继续扩增, 表明导入永生化基因SV40T后可体外大量获取BMSCs.
实验还通过永生化BMSCs置于成骨添加剂的条件培养基中培养后可分化为成骨细胞, 由此可见其仍保留BMSCs的基本特性-分化为成骨细胞能力. 通过不同的血清浓度培养该细胞发现当血清浓度为20%时细胞生长速度最快且活性较好; 永生化BMSCs通过50%血清冻存复苏后细胞的活性与90%血清组无显著性差异, 但显著性高于20%血清组.
本研究镜下观察发现永生化BMSCs细胞间仍存在接触抑制, 且通过裸鼠皮下注射永生化BMSCs后, 观察4 wk后, 未见瘤体的出现, 表明细胞为良性细胞可能性大.
体外将pCMVSV40T/PUR质粒的导入, 使得BMSCs其具有体外大量扩增等优点, 且不具有成瘤性, 为今后BMSCs的研究及应用提供大量的细胞来源.
越来越多的研究表明, 骨髓间充质干细胞(BMSCs)治疗器官功能衰竭有很好的疗效. 同时发现BMSCs具有体外易衰老等缺点, 这严重影响了BMSCs进一步研究及临床应用.
程树群, 副教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗三科
Zhang et al通过将pCMVSV40T/PUR质粒导入前软骨细胞后, 细胞可在体外大量培养. 但永生化BMSCs尚无进一步报道.
本研究通过pCMVSV40T/PUR质粒建立永生化BMSCs可在体外提供大量的活性较好的细胞, 为其进一步研究及应用提供细胞来源.
本文有较强的科学性和创新性, 条理清楚, 逻辑严密, 结论可信, 语言表达流畅简洁.
编辑: 李军亮 电编:吴鹏朕
| 1. | Xu R, Jiang X, Guo Z, Chen J, Zou Y, Ke Y, Zhang S, Li Z, Cai Y, Du M. Functional analysis of neuron-like cells differentiated from neural stem cells derived from bone marrow stroma cells in vitro. Cell Mol Neurobiol. 2008;28:545-558. [PubMed] [DOI] |
| 2. | Nakahara M, Takagi M, Hattori T, Wakitani S, Yoshida T. Effect of Subcultivation of Human Bone Marrow Mesenchymal Stem on their Capacities for Chondrogenesis, Supporting Hematopoiesis, and Telomea Length. Cytotechnology. 2005;47:19-27. [PubMed] [DOI] |
| 3. | 程 斌, 方 驰华, 范 应方, 李 晓锋. 骨髓间充质干细胞提取方法的改良. 中国组织工程研究与临床康复. 2008;12:9293-9296. |
| 4. | Kulig KM, Vacanti JP. Hepatic tissue engineering. Transpl Immunol. 2004;12:303-310. [PubMed] [DOI] |
| 5. | Shimizu K, Ito A, Honda H. Mag-seeding of rat bone marrow stromal cells into porous hydroxyapatite scaffolds for bone tissue engineering. J Biosci Bioeng. 2007;104:171-177. [PubMed] [DOI] |
| 6. | Ozawa K, Sato K, Oh I, Ozaki K, Uchibori R, Obara Y, Kikuchi Y, Ito T, Okada T, Urabe M. Cell and gene therapy using mesenchymal stem cells (MSCs). J Autoimmun. 2008;30:121-127. [PubMed] [DOI] |
| 7. | Khan AA, Parveen N, Mahaboob VS, Rajendraprasad A, Ravindraprakash HR, Venkateswarlu J, Rao SG, Narusu ML, Khaja MN, Pramila R. Safety and efficacy of autologous bone marrow stem cell transplantation through hepatic artery for the treatment of chronic liver failure: a preliminary study. Transplant Proc. 2008;40:1140-1144. [PubMed] [DOI] |
| 10. | Cízková D, Rosocha J, Vanický I, Jergová S, Cízek M. Transplants of human mesenchymal stem cells improve functional recovery after spinal cord injury in the rat. Cell Mol Neurobiol. 2006;26:1167-1180. [PubMed] [DOI] |
| 12. | Matsuda C, Takagi M, Hattori T, Wakitani S, Yoshida T. Differentiation of Human Bone Marrow Mesenchymal Stem Cells to Chondrocytes for Construction of Three-dimensional Cartilage Tissue. Cytotechnology. 2005;47:11-17. [PubMed] [DOI] |
| 13. | 许 澍洽, 许 扬滨. BMSCs构建组织工程软骨的研究进展. 中国修复重建外科杂志. 2008;22:163-166. |
| 14. | 赵 凌云, 钱 淑琴, 赵 廷宝. 人骨髓间充质干细胞的贴壁分离与体外培养. 中国组织工程研究与临床康复. 2007;11:5649-5651. |
| 15. | Zhang S, Chen A, Hu W, Li M, Liao H, Zhu W, Song D, Guo F. Immunological purification of rat precartilaginous stem cells and construction of the immortalized cell strain. Arch Orthop Trauma Surg. 2008;128:1339-1344. [PubMed] [DOI] |