修回日期: 2009-01-16
接受日期: 2009-01-19
在线出版日期: 2009-03-28
目的: 建立同种异体大鼠骨髓及肝联合移植动物模型, 探讨骨髓移植诱导肝移植术后免疫耐受的可行性及其可能机制.
方法: 将SD大鼠(♂)、Wistar大鼠(♀)分成三组: Ⅰ、Ⅱ组和Ⅲ组, Ⅱ组Wistar大鼠(♀)TBI(11 Gy), 4 h后输入SD大鼠(♂)BMC(8×107), Ⅲ组Wistar大鼠(♀)TBI(7 Gy), 4 h后输入SD大鼠(♂)BMC(8×107), 2 d后CTX(50 mg/kg)腹腔注射, 三组均于28 d后Kamada"二袖套法"行SD→Wistar大鼠肝移植. 分别于BMT后10、20 d通过PCR方法检测Ⅱ组和Ⅲ组Wistar大鼠体内的SD大鼠源性Y染色体特异性片段. 并比较三组大鼠肝移植术后1 wk生存率、生存状况、生存时间, 以及移植肝脏的病理变化.
结果: Ⅱ组和Ⅲ组大鼠外周血均检测出SD大鼠源性嵌合体. DTH检查结果显示Ⅱ组和Ⅲ组大鼠对SD大鼠产生免疫耐受, Ⅱ组和Ⅲ组DTH足掌厚度差值较Ⅰ组小(0.22±0.028 mm, 0.23±0.032 mm vs 0.71±0.026 mm, 均P<0.01). 肝移植结果显示: Ⅱ组和Ⅲ组Wistar大鼠对SD大鼠肝移植的存活时间较Ⅰ组大鼠肝移植物存活时间明显延长(8.14±2.53 d, 8.33±2.11 d vs 3.79±0.83 d, 均P<0.01). 依据Banff方案病理评分, Ⅱ组和Ⅲ组为轻度(Ⅰ级), Ⅰ组为重度(Ⅲ级).
结论: 应用7 Gy TBI+CTX+供体BMT可成功建立同种异体大鼠嵌合体模型, 诱导特异性免疫耐受, 可提高肝移植术后大鼠的生存状况及生存时间.
引文著录: 傅锦波, 王效民, 黄小进, 罗琪, 尹震宇, 卢明珠, 余德. 同种异体大鼠骨髓移植诱导肝移植免疫耐受. 世界华人消化杂志 2009; 17(9): 867-872
Revised: January 16, 2009
Accepted: January 19, 2009
Published online: March 28, 2009
AIM: To establish the allogeneic animal bone marrow and orthotopic liver transplantation model in rats, and to investigate the feasibility and possible mechanism of immune tolerance induced by allogeneic animal bone marrow tansplantation.
METHODS: SD rats (donor, ♂) and Wistar rats (recipient, ♀) were randomly and averagely divided into three groups and conditioned by three methods. Group II Wistar rats (recipient, ♀) were induced with sublethal total body irradiation (TBI, 11 Gy) and group III with TBI (7 Gy), followed by infusion of SD (donor, ♂) rat bone marrow cells (8×107) within 4 h, then rats in group III were administered intraperitoneally with cytoxan (CTX, 50 mg/kg) 2 days later. Then three groups were performed orthotopic liver transplantations using modified Kamada's two-cuff technique in rats 28 days later. According to the GenBank, the specific primer of rat SRY gene was designed. Recipient rats were detected for donor origin cells in the peripheral blood lymphocyte on day 10, 20 using polymerase chain reaction (PCR). PCR product was analyzed by electrophoresis. Delayed type hypersensitivity (DTH), survival time and the histopathologic changes in liver after liver transplantation in rats were compared.
RESULTS: Chimera of SD rats was found in the peripheral blood lymphocytes of the Wistar rats in Group II and III. DTH results showed that Wistar rats were specifically tolerant to the SD rats. The DTH in group II or III is obviously lower than that in group I (0.22 ± 0.028 mm, 0.23 ± 0.032 mm vs 0.71 ± 0.026 mm, P < 0.01). The rats in Group I died 4-5 days later. The survival rate in Group II or III were significantly higher than that in group I (8.14 ± 2.53 d, 8.33 ± 2.11 d vs 3.79 ±0.83 d, P < 0.01). According the Banff scores, the rats in group II and III showed lighter pathological changes than in group I.
CONCLUSION: Treatment of 7 Gy TBI and the injection of CTX (50 mg/kg) plus donor bone marrow transplantation (BMT) establishes a rat chimera model successfully and enhance the survival time of liver transplantation model in rats. Infusion of the bone marrow cells might be an effective method for maintaining the tolerant state and for prolonging survival time of liver transplantation model in rats.
- Citation: Fu JB, Wang XM, Huang XJ, Luo Q, Yin ZY, Lu MZ, Yu D. Immune tolerance in orthotopic liver transplantation induced by allogenic bone marrow transplantation in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 867-872
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/867.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.867
目前, 肝脏移植(liver transplantation, LT)已成为治疗终末期肝病最有效的方法. 然而, 同种异体排斥反应仍然是器官移植的主要障碍, 肝移植术后急性排斥反应发生率仍可高达12%-34%[1]. 为了研究嵌合体和移植耐受的关系, 人们已经成功建立了一些嵌合体的动物模型[2-4]. 如事先移植同源供体的骨髓细胞可以重建受体的免疫系统, 之后再进行同源供肝移植, 在新的免疫环境受体对供肝可能产生特异性免疫耐受. 本实验将在这方面作深入的研究探讨其建立的可行性及机制.
近交系封闭群♂SD大鼠60只(♂供体), ♀Wistar大鼠60只(♀受体, 上海实验动物中心提供), 体质量250-300 g, 供体体质量低于受体20-50 g, 术前12 h禁食, 不禁水.
1.2.1 分组: 将SD大鼠和Wistar大鼠随机分为3组, 每组20只, 并分别编号, 如SD大鼠Ⅰ组1号称SD1.1, Wistar大鼠Ⅱ组8号称W2.8. Ⅰ组大鼠Kamada"二袖套法"行SD→Wistar大鼠肝移植; Ⅱ组Wistar大鼠(♀)全身照射(Total Body Irradiation, TBI)11 Gy, 4 h后输入SD大鼠(♂)(Bone Marrow Cells, BMC)8×107, 28 d后Kamada"二袖套法"行SD→Wistar大鼠肝移植; Ⅲ组Wistar大鼠(♀)TBI 7 Gy, 4 h后输入SD大鼠(♂)BMC 8×107), 2 d后环磷酰胺(Cytoxan, CTX)50 mg/kg腹腔注射, 28 d后Kamada"二袖套法"行SD→Wistar大鼠肝移植.
1.2.2 骨髓细胞移植: (1)大鼠处死后置于750 mL/L乙醇中浸泡10 min, 无菌条件下采集两侧股骨骨髓, 用RPMI 1640冲洗骨髓腔, 200目钢筛过滤制成单细胞悬液, 离心后配制成2×1013个/L, 直接放入4℃冰箱保存. (2)在移植当天将Wistar大鼠用100 g/L水合氯醛0.2-0.3 g/kg作腹腔注射麻醉后, 置于20×20 cm2照射野内, 采用60Co γ射线全身照射. Ⅱ组为11 Gy, 剂量率为0.9 Gy/min; Ⅲ组为7 Gy, 剂量率为0.5 Gy/min. (3)两组Wistar大鼠均于照射后4 h内自尾静脉输入相应编号SD大鼠骨髓细胞8×107, 2 d后Ⅲ组大鼠腹腔内注射CTX 50 mg/kg.
1.2.3 肝移植: 采用Kamada"二袖套法"[5-7], 即肝下下腔静脉(infrahepatic vena cava, IVC)与门静脉(portal vein, PV)分别用套管吻合, 胆管用支架管吻合, 肝上下腔静脉(suprahepatic vena cava, SVC)直接吻合的方法. (1)术前准备: 术前准备好PV、IVC套管, 分别采用聚乙烯静脉穿刺针的套管制成, 长约4 mm, 外径分别为2.1 mm和2.7 mm, 管体与管柄各半, 管体中段环形刻下浅槽, 以防血管套上后滑脱并有利于固定结扎线. 胆总管插管采用硬膜外麻醉导管, 长约3 mm. 采用上海手术器械厂的显微外科手术器械包, Satinsky钳, 5-0、7-0医用无损伤缝合针线, 在手术显微镜下双人操作完成. (2)供肝的获取: 供体采用100 g/L水合氯醛0.2-0.3 g/kg作腹腔注射麻醉. 腹部去毛消毒, 十字切口入腹. 游离肝下下腔静脉, 结扎右肾上腺静脉, 并切断右肾动静脉. 顺时针方向游离肝周韧带, 近肝侧结扎并离断左膈下静脉, 结扎并切断左肝至食管高位血管支, 游离肝外胆管并行胆管内插入支架管并固定, 经门静脉主干向肝脏内匀速灌注含肝素50 U的4℃乳酸林格液10 mL, 行肝脏冷灌注. 当肝脏变白时, 在靠近左肾静脉入口处剪断肝下下腔静脉, 形成灌注液流出道, 在膈肌上方Satinsky钳钳夹肝上下腔静脉及部分膈肌, 横断肝上下腔静脉, 在胆总管分叉下方1 cm左右切断胆总管, 剪断肝固有动脉, 脾静脉上缘切断门静脉, 将供肝取出, 置于4℃乳酸林格液中保存备用. (3)供肝修剪及套管安装: 紧贴膈肌环剪去膈肌水平以上SVC及膈肌组织, 仅保留膈肌环. SVC左右两侧7-0无损伤缝线各缝1针. 修整IVC及PV, 在4℃乳酸林格液中将门静脉与肝下下腔静脉壁外翻, 分别套在自制的聚乙烯管上, 用5-0丝线环扎固定, 完成袖套制备. (4)受体原位肝移植: 大鼠乙醚吸入麻醉后, 上腹部直切口入腹, 采用自制拉钩, 腰桥充分暴露手术野. 分步游离受体肝脏, 游离完毕后将受体肝脏取出. 将供肝自4℃乳酸林格液保存液中取出置于受体原位, 冰生理盐水纱布覆盖肝脏, 并间断用冰生理盐水冲洗肝脏表面, 7-0无损伤线吻合肝上、下腔静脉, 吻合时, 向肝上、下腔静脉内注入4℃生理盐水, 驱出血管腔内的空气. 吻合成功后, 经门静脉向供肝内灌注4℃生理盐水5 mL, 排除肝内的肝素乳酸林格液, 夹闭肝下下腔静脉, 将供肝门静脉套管插入受体门静脉内, 开放门静脉及肝上、下腔静脉阻端夹, 结束无肝期. 肝下下腔静脉的吻合方法与门静脉相同, 最后将供体胆管插入受体胆管插管内, 检查腹腔内无出血后迅速用38-39℃生理盐水20 mL复温. 术后灯光照射复温3 h, 自由饮食.
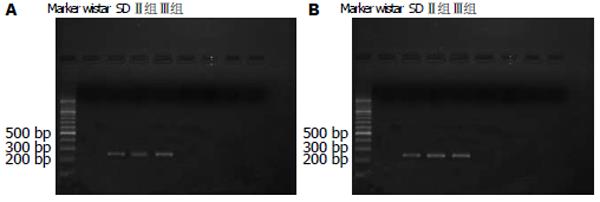
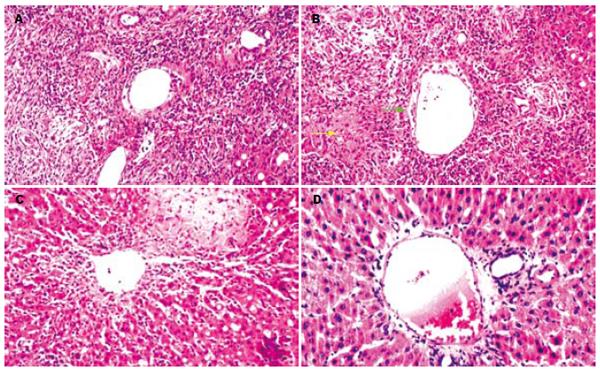
1.2.4 观察指标: (1)术前、术后同条件下饲养, 术后每天观察各组Wistar大鼠生存状况及存活率, 并将异常者做好相应记录, 包括精神状态、体温、进食水量、体质量、皮毛特点、活动情况, 对外界刺激反应等. 死亡大鼠进行尸检, 查清死亡原因. (2)术后10、20 d分别取外周血抽提DNA, 检测SD大鼠源性Y染色体的特异性片段, 采用PCR方法, 引物序列来自大鼠SRY基因库: Sry F17: 5'-catctctgacttcctggttgcaa-3', Sry R16: 5'-atgctgggattctgttgagcc-3'(上海英骏生物工程有限公司合成). PCR产物为241 bp, 对应于大鼠sry基因273-514位点之间. 同时以Wistar大鼠(♀)和雄性SD大鼠(♂)作为阴性和阳性对照. (3)脾细胞制备: 将SD大鼠脾脏置于200目钢筛上, 玻璃注射器内芯研磨, 红细胞裂解液去除红细胞, 用含50 mL/L庆大霉素RPMI 1640冲洗过滤制成单细胞悬液, 用大鼠淋巴细胞分离液分离并洗涤计数制成细胞数为5×109/L. (4)迟发型超敏反应(DTH): 各组Wistar大鼠腹股沟皮下注射1×107(50 µL)SD大鼠脾细胞预致敏, 7 d后于右后脚掌注射1×107相同的脾细胞, 左后脚掌注射50 µL生理盐水作对照. 24 h后测量两脚掌的厚度, 取其差值作为DTH指标. (5)肝移植存活时间的观察: Ⅰ组大鼠饲养28 d, Ⅱ组和Ⅲ行骨髓细胞移植(bone marrow transplantation, BMT)28 d后, 采用Kamada"二袖套法"进行原位肝移植, 观察大鼠的生存时间. (6)病理组织学检查: Ⅰ组肝移植术后4 d, Ⅱ组和Ⅲ组肝移植术后7 d分别处死3只大鼠, 取出肝脏组织, 常规石蜡切片, 光镜下观察急性排斥反应情况. 依据移植肝排斥反应活检诊断与分级的Banff标准[8-10]: 无排斥: 汇管区三体(肝动脉、门静脉和胆管) 炎细胞浸润最多只有二体; 不明确: 炎细胞浸润程度未达到急性排斥的诊断标准, 且不能排除缺血性损伤; 轻度(Ⅰ级): 排斥性炎细胞浸润少数汇管区的胆管和血管, 炎细胞数量较少, 仅局限在汇管区间隙中; 中度(Ⅱ级): 排斥性炎细胞浸及多数或全部汇管区的胆管和血管; 重度(Ⅲ级)在中度的基础上, 炎细胞浸润汇管区周围, 伴有中-重度静脉炎并扩展到肝实质, 引起静脉周肝细胞坏死. 观察结果由2位病理学专家同时观察并判定.
统计学处理 数据以mean±SD表示, 利用SPSS10.0统计软件分析, 两两比较采用t检验.
Ⅰ组大鼠肝移植, 术后死亡2例, 均因术后肝上、下腔静脉吻合口出血而死亡, 大鼠均在4-5 d死亡; Ⅱ组BMT移植2 d后开始出现弓背翘毛, 活动及进食水明显减少, 10-12 d部分大鼠死亡, 眼睛、鼻腔、口腔及多个内脏出血(尸检), 15 d后症状减轻, 逐渐恢复, 死亡率为25%(5/20), 肝移植术后出血死亡2例, 门静脉血栓1例, 1 wk存活率80%(12/15); Ⅲ组BMT移植后症状出现时间较晚且明显较轻, 恢复快, 死亡率为5%(1/20), 尸检脏器出血亦较轻, 肝移植术后出血死亡1例, 胆漏1例, 门静脉血栓1例, 1 wk存活率84.2%(16/19). Ⅱ组和Ⅲ组间差异无统计学意义(P>0.05), 但与Ⅰ组比较差异有统计学意义(P<0.01).
BMT 10、20 d后, Wistar大鼠(♀)外周血检测SD大鼠(♂)源性嵌合体, 均发现了Y染色体特异性片段, 嵌合体诱导成功, 在10 d时Ⅱ组比Ⅲ组明显, 两组在20 d时无明显区别(图1).
BMT 20 d后, DTH反应结果见表1. Ⅱ组和Ⅲ组对SD大鼠脾细胞DTH反应均在较低水平, 差异无统计学意义, 但两组与Ⅰ组比较差异均有统计学意义(P<0.01).
Ⅱ组和Ⅲ组Wistar大鼠对SD大鼠肝移植的存活时间, 差异无统计学意义, 但较Ⅰ组大鼠肝移植物存活时间明显延长, 差异有统计学意义(P<0.01, 表1).
诱导形成供受体嵌合体可使受体产生对供体特异性免疫无反应性[11-12]. 在骨髓细胞移植后可形成稳定的供受体嵌合体, 受体可产生对来自同一供体的后续器官移植的耐受[13-16]. 目前研究最多的是建立异基因骨髓嵌合体诱导免疫耐受, 但是, 以往建立嵌合体需要对受体进行去髓性预处理(如致死量照射、大剂量细胞毒性药物等), 清除淋巴细胞, 这种方法的后果是以增加肿瘤和感染以及移植物抗宿主病(graft versus host disease, GVHD)的发生率为代价, 而且在临床上难以推广应用. 因此, 我们采用比较温和的诱导方法[17-18], 即低剂量TBI联合注射CTX, 促进形成稳定的嵌合体. 本实验研究经过上述两种方法诱导, 并于BMT 10 d和20 d后检测受体Wistar大鼠(♀)外周血(PCR), 均发现了供体SD大鼠(♂)Y染色体特异性片段, 说明了两种方法都能成功诱导嵌合体形成. 在10 d时Ⅱ组比Ⅲ组明显, 两组在20 d时无明显区别. 但同时也观察到, Ⅱ组大鼠(亚致死TBI 11 Gy)生存情况明显不如Ⅲ组(7 Gy TBI+腹腔注射50 mg/kg CTX), 死亡率达25%, 较Ⅲ组5%明显高. 这可能包含以下原因: (1)Ⅱ组TBI剂量较大, 骨髓抑制迅速、强烈, 早期嵌合体容易形成, 但是容易引起急性放射病, 骨髓造血功能严重障碍, 另一方面移植骨髓中含有供体T淋巴细胞, 与受体同种异型抗原发生应答, 产生GVHD, 部分受体不能承受致死; (2)Ⅲ组TBI剂量较小, 早期骨髓抑制可能不够充分, 但随着CTX发挥作用, CTX可以清除大部分供体反应性T细胞而减轻GVHD[19-21], 在受体内形成稳定的嵌合体. 有临床实验表明, 较低剂量的TBI即可以杀伤95%以上的外周淋巴细胞, 仅保留了少量的自体淋巴细胞, 这样既能促进骨髓细胞移植, 形成稳定的嵌合体, 同时减少了GVHD的发生. 进一步研究证实, 受体Wistar大鼠对SD大鼠已产生特异性耐受, 表现为DTH反应呈抑制状态, 而未行骨髓移植的Wistar大鼠对SD大鼠仍有强烈反应. 上述实验结果说明耐受和嵌合体之间存在着一定的特异性关系.
建立同种异体大鼠骨髓及肝联合移植动物模型对移植免疫学研究有着深远意义, 目前还鲜有报道. 诱导器官移植受者对供者器官特异的免疫耐受, 是解决器官移植排斥最彻底的方法. 诱导稳定的嵌合体的形成, 并成功建立肝移植动物模型, 是我们实验的主要目的. 嵌合体的形成有助于提高移植器官的存活率, 这种观点现已经成为大多数的学者的共识. SD→Wistar大鼠的肝移植为高排异组合, 可作为肝移植排斥反应的研究模型[22-24]. 本实验研究发现, Ⅰ组大鼠肝移植后均于4-5 d出现肝功能衰竭症状而死亡, 病理证实为急性排斥反应; 而Ⅱ组和Ⅲ组BMT移植后再行肝移植, 存活率和存活时间明显延长. 由此可见, 骨髓细胞输注有利于形成稳定的嵌合体, 对供体产生了一定的免疫耐受, 由于受体造血及免疫系统未被完全破坏, 使受体与供体的造血干细胞群可在受体内混合存在, 这样可使GVHD发生率明显下降, 同时可达到诱导并维持移植器官的长期耐受, 因此具有良好的临床应用前景.
总之, 通过上述诱导方法, 成功地建立了同种异体大鼠骨髓及肝联合移植动物模型, 为今后研究有关嵌合体与耐受的关系提供了有益的尝试, 为临床应用提供了理论基础及可靠依据, 为同源供肝移植提供了一个新方法, 并期待着在临床上得到应用.
铂类配合物是临床上广泛应用的抗肿瘤药物, 其中最常用的有顺铂、卡铂、奥沙利铂. 这些药物均有一定的毒副作用, 抗肿瘤谱窄, 易产生耐药性; 而且, 分子量小, 仅能识别2-3个碱基, 特异性不高, 易损伤正常细胞的DNA. 另外, 他们与靶分子的结合作用弱, 与DNA单加合后, 会引起DNA结构的改变, 从而导致药效的降低. 因此, 研究与经典铂类配合物结构不同的非经典的配合物, 克服现有的铂类配合物的缺点, 增加疗效, 是目前研究的重点和热点.
张宗明, 教授, 清华大学第一附属医院普通外科; 邱双健, 副教授, 复旦大学中山医院肝肿瘤外科
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
CCP的研究已经得到国家科技部"863"创新药物重大专项资助. 本文是有关药效学研究的部分内容. 经研究已明确, CCP在动物体外和体内均有杀伤肿瘤细胞的作用, 疗效高于卡铂, 副作用小, 有望进入正式的临床实验.
1 超分子化学: 多个分子间以非共价键紧密结合形成的分子聚合体, 具有新的选择、识别、信息传递、能量转移等一系列特定功能和性质; 他包括诸如"主-客体化学"、"超分子器件"、"超分子开关"等一系列全新的科学概念.
2 超分子药物: 是由主体药物分子和特别的客体分子在一定的条件下, 通过分子间的非共价键力, 组装成结构稳定的超分子, 他们改进了药物的稳定性和在人体内的运输机制.
本文研究具有科学性, 实验手段先进, 结果结论可信.
编辑: 李军亮 电编:吴鹏朕
| 1. | Kwekkeboom J, Tha-In T, Tra WM, Hop W, Boor PP, Mancham S, Zondervan PE, Vossen AC, Kusters JG, de Man RA. Hepatitis B immunoglobulins inhibit dendritic cells and T cells and protect against acute rejection after liver transplantation. Am J Transplant. 2005;5:2393-2402. [PubMed] [DOI] |
| 2. | Kawai T, Cosimi AB, Wee SL, Houser S, Andrews D, Sogawa H, Phelan J, Boskovic S, Nadazdin O, Abrahamian G. Effect of mixed hematopoietic chimerism on cardiac allograft survival in cynomolgus monkeys. Transplantation. 2002;73:1757-1764. [PubMed] [DOI] |
| 3. | Sogawa H, Boskovic S, Nadazdin O, Abrahamian G, Colvin RB, Sachs DH, Cosimi AB, Kawai T. Limited efficacy and unacceptable toxicity of cyclophosphamide for the induction of mixed chimerism and renal allograft tolerance in cynomolgus monkeys. Transplantation. 2008;86:615-619. [PubMed] [DOI] |
| 4. | Tillson M, Niemeyer GP, Welch JA, Brawner W, Swaim SF, Rynders P, Lenz SD, Dean B, Lothrop CD. Hematopoietic chimerism induces renal and skin allograft tolerance in DLA-identical dogs. Exp Hematol. 2006;34:1759-1770. [PubMed] [DOI] |
| 5. | Kamada N, Calne RY. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 1979;28:47-50. [PubMed] [DOI] |
| 6. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 7. | Delrivière L, Gibbs P, Kobayashi E, Goto S, Kamada N, Gianello P. Detailed modified technique for safer harvesting and preparation of liver graft in the rat. Microsurgery. 1996;17:690-696. [PubMed] [DOI] |
| 8. | Tanaka T, Kyo M, Kokado Y, Takahara S, Hatori M, Suzuki K, Hasumi M, Toki K, Ichimaru N, Yazawa K. Correlation between the Banff 97 classification of renal allograft biopsies and clinical outcome. Transpl Int. 2004;17:59-64. [PubMed] [DOI] |
| 9. | Bates WD, Davies DR, Welsh K, Gray DW, Fuggle SV, Morris PJ. An evaluation of the Banff classification of early renal allograft biopsies and correlation with outcome. Nephrol Dial Transplant. 1999;14:2364-2369. [PubMed] [DOI] |
| 10. | Mueller A, Schnuelle P, Waldherr R, van der Woude FJ. Impact of the Banff '97 classification for histological diagnosis of rejection on clinical outcome and renal function parameters after kidney transplantation. Transplantation. 2000;69:1123-1127. [PubMed] [DOI] |
| 11. | Wekerle T, Sykes M. Mixed chimerism and transplantation tolerance. Annu Rev Med. 2001;52:353-370. [PubMed] [DOI] |
| 12. | Wekerle T, Blaha P, Langer F, Schmid M, Muehlbacher F. Tolerance through bone marrow transplantation with costimulation blockade. Transpl Immunol. 2002;9:125-133. [PubMed] [DOI] |
| 13. | Sayegh MH, Fine NA, Smith JL, Rennke HG, Milford EL, Tilney NL. Immunologic tolerance to renal allografts after bone marrow transplants from the same donors. Ann Intern Med. 1991;114:954-955. [PubMed] [DOI] |
| 14. | Helg C, Chapuis B, Bolle JF, Morel P, Salomon D, Roux E, Antonioli V, Jeannet M, Leski M. Renal transplantation without immunosuppression in a host with tolerance induced by allogeneic bone marrow transplantation. Transplantation. 1994;58:1420-1422. [PubMed] |
| 15. | Sorof JM, Koerper MA, Portale AA, Potter D, DeSantes K, Cowan M. Renal transplantation without chronic immunosuppression after T cell-depleted, HLA-mismatched bone marrow transplantation. Transplantation. 1995;59:1633-1635. [PubMed] |
| 17. | Neipp M, Exner BG, Ildstad ST. A nonlethal conditioning approach to achieve engraftment of xenogeneic rat bone marrow in mice and to induce donor-specific tolerance. Transplantation. 1998;66:969-975. [PubMed] [DOI] |
| 18. | Neipp M, Gammie JS, Exner BG, Li S, Chambers WH, Pham SM, Ildstad ST. A partial conditioning approach to achieve mixed chimerism in the rat: depletion of host natural killer cells significantly reduces the amount of total body irradiation required for engraftment. Transplantation. 1999;68:369-378. [PubMed] [DOI] |
| 19. | Mayumi H, Umesue M, Nomoto K. Cyclophosphamide-induced immunological tolerance: an overview. Immunobiology. 1996;195:129-139. [PubMed] [DOI] |
| 20. | Zhang QW, Mayumi H, Umesue M, Tomita Y, Nomoto K, Yasui H. Fractionated dosing of cyclophosphamide for establishing long-lasting skin allograft survival, stable mixed chimerism, and intrathymic clonal deletion in mice primed with allogeneic spleen cells. Transplantation. 1997;63:1667-1673. [PubMed] [DOI] |
| 21. | Morrissey NJ, Blom D, Ryan CK, Fisher T, Bronsther O, Orloff MS. Tolerance induction permits the development of graft-versus-host disease: donor-mediated attack following small bowel transplantation in mixed chimeras. Transpl Immunol. 1999;7:19-25. [PubMed] [DOI] |
| 22. | Kamada N. The immunology of experimental liver transplantation in the rat. Immunology. 1985;55:369-389. [PubMed] |
| 24. | 孙 倍成, 王 学浩, 胡 建平, 张 浩, 李 相成. 大鼠肝移植技术改进及免疫排斥初步观察. 南京医科大学学报(自然科学版). 2001;21:281-283. |