修回日期: 2009-02-21
接受日期: 2009-02-23
在线出版日期: 2009-03-28
目的: 探讨阿司匹林体外培养条件下对H pylori定植相关因子的影响及其机制.
方法: 阿司匹林与H pylori共同培养, 电镜观察其形态结构, 3 g/L的琼脂穿刺培养观察细菌动力, 酶联免疫吸附试验(ELISA)检测不同浓度阿司匹林对H pylori黏附性的影响. SYBR greenⅠ实时定量PCR测定编码H pylori鞭毛蛋白基因(flaA、flaB)、尿素酶基因(ureA、ureB)以及黏附素基因(babA、sabA、alpA、alpB、hpaA、hopZ)的表达.
结果: 体外培养条件下, 阿司匹林导致H pylori形态发生改变, 细菌胞壁不完整, 且发生不同程度的凹陷变形, 细菌细胞壁和细胞膜间出现空隙, 胞质分布不均匀, 出现高电子密度颗粒, 并有溶菌样改变. 阿司匹林显著降低H pylori的鞭毛动力, 并剂量依赖性的抑制H pylori对AGS细胞的黏附. 阿司匹林降低H pylori鞭毛蛋白基因(flaA、flaB)mRNA水平的表达, 增加尿素酶基因(ureA、ureB)及黏附素基因(babA、sabA、alpA、alpB、hpaA、hopZ) mRNA水平的表达(均P<0.05).
结论: 阿司匹林通过破坏H pylori的正常结构, 降低细菌的动力及黏附性, 从而降低细菌的定植能力.
引文著录: 王静, 王蔚虹, 李江, 刘芳勋. 阿司匹林对幽门螺杆菌定植的影响. 世界华人消化杂志 2009; 17(9): 854-861
Revised: February 21, 2009
Accepted: February 23, 2009
Published online: March 28, 2009
AIM: To investigate effects of aspirin on H pylori colonization and the related mechanism.
METHODS: After co-incubation with aspirin, the morphology of H pylori was observed by transmission electron microscopy. The flagellar motility was assessed by 0.3% stab agar motility test. The adherence to AGS cells was determined using enzyme linked immunosorbent assay (ELISA). The mRNA expression levels of flagellar genes (flaA, flaB), urease genes (ureA, ureB) and adhesin genes (babA, sabA, alpA, alpB, hpaA, hopZ) were determined using SYBR green I real-time PCR.
RESULTS: Separation and non-integrity of cell wall, rarefaction and asymmetry of cytoplasm, and even lysis of the bacteria were the morphological effects of aspirin on H pylori. When incubated H pylori in the presence of aspirin, the ability of flagellar motility and adherence to AGS cells were inhibited. The expression of ureA, ureB, babA, sabA, alpA, alpB, hpaA, hopZ were up-regulated in the presence of aspirin, while the expression of flaA, flaB were down-regulated.
CONCLUSION: Aspirin decreases the colonization of H pylori by inhibiting flagellar motility, adherence ability and destructing normal structure of the bacteria.
- Citation: Wang J, Wang WH, Li J, Liu FX. Effects of aspirin on Helicobacter pylori colonization. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 854-861
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/854.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.854
H pylori感染在世界范围广泛存在, 在发达国家30%的人群长期慢性感染, 在发展中国家则高达90%[1-2], 非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)是目前处方量最大的药物之一[3], 二者被认为是导致胃黏膜损伤及溃疡形成的主要因素. 使用NSAIDs同时合并H pylori感染在临床上不少见, 但二者同时存在时的致病性并不清楚, 临床及流行病学的研究结果尚存在分歧[4-5]. 体外研究显示阿司匹林和选择性的COX-2抑制剂塞莱昔布可剂量依赖性的抑制H pylori的生长, 抑制H pylori尿素酶及空泡毒素的活性, 并通过改变H pylori外膜蛋白的表达而增强其对抗生素的敏感性[6-10], 提示NSAIDs对H pylori致病性的拮抗作用. H pylori感染和NSAIDs共同存在时, 对胃黏膜的作用不是两者简单的相加, 二者之间可能存在某种相互作用, 从而影响H pylori在胃肠道的致病性. 定植是H pylori致病的前提, H pylori的定植需要有完整的螺旋状的形态、鞭毛的动力、黏附素及其受体的特异结合、尿素酶为细菌的定植提供适宜的微环境[11]. 本研究旨在进一步探讨阿司匹林对H pylori定植相关因子: 细菌的形态、鞭毛的动力、黏附性的影响, 并探讨其相关机制.
标准菌株H pylori 26695购自ATCC (American Type Culture Collection), 由中国疾病预防控制中心传染病预防控制所张建中教授惠赠. 阿司匹林购自美国Sigma公司, 溶于二甲基亚砜(DMSO)备用. 胃癌上皮细胞株AGS细胞(CRL-1739, ATCC)由北京肿瘤研究所分子生物学实验室吕有勇教授惠赠. SYBR Green Real-time PCR Master Mix购自ToYoBo公司.
1.2.1 培养基的制备: 配制含有1 mmol/L的阿司匹林及溶媒对照(DMSO)(1/1000)的哥伦比亚血平皿.
1.2.2 琼脂穿刺培养动力测定: 收集培养48 h生长状态良好的H pylori, 悬于脑心浸液(37 g/L), 并调整菌液浓度至1011 CFU/L, 取10 μL接种于含3 g/L琼脂, 80 g/L脱纤维羊血的布氏肉汤半固体培养基, 置于37℃, 含850 mL/L氮气、50 mL/L 氧气和150 mL/L二氧化碳的混合气, 饱和湿度环境培养5 d, 测量晕圈直径[12-13].
1.2.3 超微结构观察: 收集培养48 h的H pylori, PBS漂洗3次, 加入25 g/L的戊二醛4℃固定2 h 后, 用PBS漂洗3次, 每次10 min, 再用10 g/L的锇酸4℃固定30 min, 接着用PBS漂洗3次. 依次用系列丙酮在4℃下脱水后, Epon812包埋, 超薄切片, 醋酸铀、枸椽酸铅双染色, JEM1230型透射电镜下观察.
1.2.4 ELISA检测细菌对AGS细胞的黏附性: 胃癌上皮细胞株AGS, 在无抗生素的含100 mL/L 胎牛血清的1640培养基中培养, 置于37℃、含50 mL/L二氧化碳、饱和湿度的环境, 每天弃去旧液, 换以新鲜培养基, 并于细胞生长约80%融合时用含0.2 g/L EDTA的胰蛋白酶消化, 以104/孔接种于96孔细胞培养板, 培养20 h后, 以107/孔加入分别以0.5、1.0、1.5 mmol/L阿司匹林预处理6 h的H pylori, 37℃, 60 r/min, 振荡培养30 min. 阳性对照只加H pylori; 阴性对照细菌、细胞均不加; 另设只加AGS细胞不加细菌的对照. 10 g/L的多聚甲醛固定1 h, 50 g/L的BSA封闭30 min, 抗H pylori的单克隆抗体作为一抗, 4℃过夜, 抗鼠的IgG-HRP作为二抗, 室温孵育1 h, 100 µL TMB显色30 min后, 2 mol/L的硫酸终止反应, 450 nm酶标仪读取A值. 黏附率计算公式: A(AGS细胞加H pylori)-A(AGS细胞)/A(阳性对照)-A(阴性对照)×100[14].
1.2.5 H pylori总RNA的提取及逆转录: 收集培养48 h的H pylori 26695, 以Tris-Hcl洗涤. 依次采用TRIzol裂解细菌, 氯仿进行液相分离, 异丙醇沉淀RNA, 最后以750 mL/L乙醇洗盐. 紫外分光光度法测定RNA浓度, 取RNA 4 μg, 用无RNA酶的DNA酶Ⅰ处理以去除DNA污染, 加Random Primers 1.5 μL, DEPC水稀释后70℃, 5 min, 冰上15 min, 加入5×RT Buffer 10 μL, dNTPs 2.5 μL, M-MLV 2 μL, 37℃ 1 h, 70℃ 10 min, 得到cDNA 50 μL, -20℃保存.
1.2.6 实时定量PCR: 内参为16SrRNA基因, 鞭毛蛋白基因(flaA、flaB), 尿素酶基因(ureA、ureB)及黏附素基因(babA、sabA、alpA、alpB、hpaA、hopZ)引物设计采用Primer Express3.0软件(Applied Biosystem Perkin-Elmer), 核苷酸序列5'-3'见表1. 25 μL PCR反应体系包括: SYBR Green Realtime PCR Master Mix(Toyobo) 12.5 μL, 上、下游引物各1 μL (5pmol/L), cDNA 2.5 μL, DEPC水补至25 μL. 反应循环参数95℃ 10 min, 预变性, 95℃15 s, 61℃ 1 min, 40个循环; 熔解曲线95℃ 15 s, 61℃ 30 s, 96℃ 15 s, 分析Real-time PCR反应产物的纯度以判断实验的特异性. ABI PRISM 7300Detector System自动检测每个PCR循环Reporter荧光的释放, 根据已知初始cDNA分子数的标准曲线, 得出样本的cDNA分子数, 与该样本16SrRNA的cDNA分子数相比进行标准化.
| 引物名称 | 核苷酸序列(5'-3') |
| flaA-F | ATTGGCGTGTTAGCAGAAGTGA |
| flaA-R | TGACTGGACCGCCACATC |
| flaB-F | ACATCATTGTGAGCGGTGTGA |
| flaB-R | GCCCCTAACCGCTCTCAAAT |
| ureA-F | GCTGGTGCGATTGGCTTTA |
| ureA-R | GGATAGCGACTTGCACATCGT |
| ureB-F | TCCTGATGGGACAAAACTCGTA |
| ureB-R | ACGGCTTTTTTGCCTTCGT |
| babA-F | TGCTCAGGGCAAGGGAATAA |
| babA-R | ATCGTGGTGGTTACGCTTTTG |
| sabA-F | GGTGTGCTGCAACAGACTCAA |
| sabA-R | CATAAGCTGTTGCGCCAAATT |
| alpA-F | GCACGATCGGTAGCCAGACT |
| alpA-R | ACACATTCCCCGCATTCAAG |
| alpB-F | ACGCTAAGAAACAGCCCTCAAC |
| alpB-R | TCATGCGTAACCCCACATCA |
| hpaA-F | GAGCGTGGTGGCTTTGTTAGT |
| hpaA-R | TCGCTAGCTGGATGGTAATTCA |
| hopZ -F | GCGCCGTTACTAGCATGATCA |
| hopZ-R | GAAATCTTTCGGCGCGTTT |
| 16SrRNA-F | CCGCCTACGCGCTCTTTAC |
| 16SrRNA-R | CTAACGAATAAGCACCGGCTAAC |
统计学处理 所有实验均重复3次, 实验数据mean±SD表示, 采用t检验, 以SPSS11.0软件进行处理.
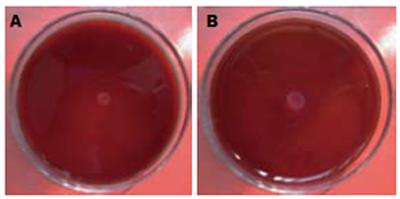
阿司匹林组晕圈直径(5.17±1.33 mm)显著小于DMSO溶媒对照组(8.21±1.63 mm), 差异有统计学意义(P<0.05, 图1).
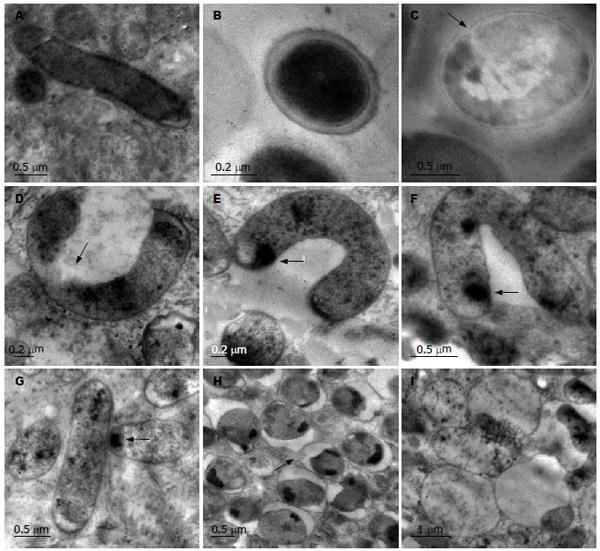
透射电镜下, 溶媒对照组细菌切面多呈杆状, 细胞壁、细胞膜完整, 胞质均匀, 电子密度中等. 阿司匹林(1 mmol/L)处理后, H pylori胞壁变薄不完整, 有的菌体部分或全部细胞壁脱落消失, 细菌发生不同程度的凹陷变形, 甚至有溶菌样改变. H pylori细胞壁和细胞膜间出现空隙, 胞质内容物稀疏, 电子密度降低. 细菌内部结构消失, 胞质分布不均匀, 出现高电子密度颗粒(图2).
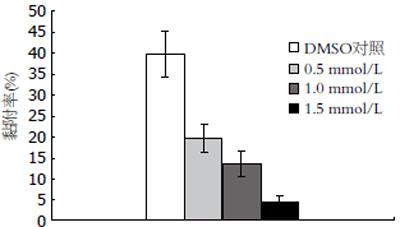
阿司匹林明显降低H pylori对AGS细胞的黏附性, 且呈剂量依赖性, 阿司匹林各浓度组与DMSO对照组(1/1000)相比, 差异具有统计学意义(P<0.05, 图3).
作为胃黏膜损害的两个最主要的致病因子, H pylori和NSAIDs共同存在时的致病性及致病机制尚存在争议. 临床研究显示伴有H pylori感染的NSAIDs服用者较单纯H pylori感染或单纯服用NSAIDs发生消化性溃疡的风险增加[15]. 对需要长期服用NSAIDs维持治疗的消化性溃疡患者, 根除H pylori溃疡复发率及其并发症的发生率均显著降低[16]. 然而目前为止还有很多研究并未证实二者同时存在时对胃黏膜的损害作用增强[4-5]. 在NSAIDs服用者中, 胃肠道不良反应的发生率H pylori阳性与阴性者相比无显著性差异[17], 另有数据显示, NSAIDs使用者胃黏膜前列腺素的合成在H pylori阳性者显著高于H pylori阴性者[18-19], 即H pylori的定植减轻了NSAIDs对前列腺素合成的抑制. 动物实验观察到H pylori与NSAIDs共同作用比单独应用NSAIDs的胃黏膜炎症积分低, 两者间有显著性差异[20]; 预先给与H pylori灌胃后再给与吲哚美辛较先给相同剂量及疗程的吲哚美辛再给与H pylori灌胃组胃黏膜的炎症反应轻[21].
H pylori感染致病最基本的条件是定植, 其定居的因素包括鞭毛的动力、尿素酶和黏附素等. 正常的螺旋状形态以及H pylori的鞭毛动力使其快速穿过黏液层移动到相对中性的胃黏膜表面, 尿素酶中和胃酸, 保证H pylori定植的微环境呈中性, 黏附是定植的关键[22-23]. 如果没有黏附素与宿主细胞表面的黏附受体结合, H pylori在胃内长期定植几乎没有可能. H pylori若不能黏附于胃黏膜, 就会因表面上皮细胞和黏液层的脱落而被快速清除. NSAIDs通过抑制环氧化酶, 导致胃肠黏膜生理性的PG合成不足, 从而使得黏液和碳酸氢盐的分泌减少、黏膜血流减少, 并可直接产生细胞毒作用而损害胃黏膜屏障[24-25], 因此推测其可能使H pylori更易于定植, 但是很多研究并未证实这种推测[4,26-29], 甚至有研究表明NSAIDs服用者, H pylori感染率反而是下降的[30-31]. 我们的体外研究发现阿司匹林可以破坏H pylori的正常结构, 降低细菌的鞭毛动力、尿素酶的活性[10]及黏附性, 可能部分解释这一现象.
黏附素是位于细菌特定结构的一种蛋白, 是细菌黏附定植的物质基础, 目前得到证实的黏附素有以下几种: BabA、SabA、AlpA、AlpB、HpaA及HopZ[32-37]. BabA、SabA、AlpA、AlpB、HpaA及HopZ均经证实为外膜蛋白, 且他们之间具有氨基酸的同源性, 在基因组中至少包含一个高度同源序列[38]. H pylori黏附素为数众多, 而且不同的环境和培养条件下, 黏附素的表达种类和数量变化很大. 我们的体外研究显示阿司匹林降低H pylori对AGS细胞的黏附性, 但却增加黏附素基因babA、sabA、alpA、alpB、hpaA、hopZ mRNA水平的表达, 究竟基因水平表达增加的黏附素是否伴随有活性的蛋白产物的增加, 抑或是药物对H pylori生长及黏附活性的抑制、细菌结构的破坏造成的代偿性增加, 尚需进一步进行表达蛋白质组、结构蛋白质组及功能蛋白质组的研究来明确. 同一宿主黏附素受体表达的可变性以及不同宿主受体表达的遗传变异性进一步加剧了黏附系统的复杂性. 有研究表明, H pylori与宿主的黏附可以使宿主细胞受体的表达暂时性升高[39]. 本研究中阿司匹林降低细菌对AGS细胞的黏附, 从而可能减少AGS细胞黏附素受体的表达, 这样即使H pylori本身表达的黏附素增加, 总的黏附活性也是降低的.
H pylori合成的尿素酶量很大, 约占菌体总蛋白的10%[40], 而且几乎所有的H pylori均含有尿素酶. 尿素酶可水解人类代谢的废物, 释放氨和二氧化碳, 氨产生的细菌微环境中的低酸和高pH使细菌能够顺利穿过胃黏液层到达黏膜表面, 从而达到定植和损伤胃黏膜的目的. 多项研究表明尿素酶对于H pylori的初始定植是必需的[41-43], 抗溃疡药物依卡倍特干扰H pylori定植的机制之一即抑制细菌尿素酶活性[44]. 阿司匹林剂量依赖性的降低尿素酶的活性[10], 因此可能进一步降低细菌的定植.
尿素酶由两个亚单位: UreA和UreB组成, 包括九个基因: ureC、D、A、B、I、E、F、G、H, 其中ureA和ureB为结构基因, ureC和ureD位于结构基因之前, ureI、ureE、ureF、ureG和ureH为辅助基因, 他们与结构基因一起为表达尿素酶的活性所必须[45]. 尿素酶是一种镍金属酶, 其活性由其活性部位的镍含量所决定. 该酶的活性需要在全酶的六个活性位点上插入两个Ni2+, 这个插入过程由尿素酶基因簇中辅助基因编码的蛋白来完成. 目前已发现多种蛋白能够通过影响镍离子来调节尿素酶的活性. 除了蛋白调节外, 不同的离子浓度对尿素酶的活性也有重要的调节作用[46]. 尿素酶抑制剂可以被分为两大类: (1)活性位点导向的(即底物类似物); (2)机制导向的. 前者主要是与尿素酶活性位点的两个Ni2+形成连接, 使得活性位点的Ni2+和氨基酸残基的定位与尿素酶底物类似而发挥对酶的抑制; 后者主要是通过干扰尿素酶的催化机制使酶失活. 体外研究观察到阿司匹林可以剂量依赖性的降低H pylori尿素酶的活性, 然而却增加了尿素酶结构基因ureA、ureB mRNA水平的表达, 阿司匹林降低H pylori尿素酶活性的机制尚不清楚, 可能是源于蛋白的翻译或是翻译后的修饰, 也可能是通过上述机制干扰了尿素酶的活性.
有鞘的鞭毛是H pylori介导感染宿生的毒力因子之一, 低动力菌株在宿主的定植及生存能力均显著低于高动力菌株. 悉生乳猪动物模型研究表明, 菌株动力性与其在宿主的感染率成正比, 动力最强的菌株感染率可达100%, 而动力最差的菌株感染率仅为17%[47]. 无鞭毛菌株或鞭毛突变株由于不能定居与胃黏膜, 因而失去了致病力[48]. H pylori的鞭毛由A和B两个亚单位组成, 分别由鞭毛基因flaA和flaB编码. flaB基因缺失的菌株鞭毛结构正常, 保留部分功能, 细菌动力为野生株的60%[13,49], flaA基因缺失的菌株鞭毛变短, 只能轻微移动, flaA、flaB基因均缺失的菌株没有鞭毛, 也不具有动力[13]. 水杨酸盐可以剂量依赖性地抑制大肠杆菌, 普通变形菌(proteus vulgaris)和米氏变形菌(proteus mirablis), 雷氏普罗威登斯菌(providencia rettgeri), 斯氏普罗威登斯菌(providencia stuartiii)和洋葱伯霍尔德杆菌(burkholderia cepacia)的运动[50]. 同时, 水杨酸盐类还可以通过抑制构成鞭毛的单体-鞭毛素的生成来抑制大肠杆菌鞭毛的产生[51]. 本研究与上述观点一致, 并进一步证实, 阿司匹林通过降低鞭毛素基因flaA和flaB, 尤其是前者的表达而影响H pylori的动力.
很多研究涉及细菌动力程度与炎症因子水平及疾病严重程度的关系. 有些研究表明, 鞭毛的运动性越强, 刺激外周血和胃黏膜淋巴细胞分泌IL-8的能力越强. IL-8是中性粒细胞的强烈激活剂, 被激活的中性粒细胞会释放反应性的氧代谢产物和蛋白溶解酶, 产生急性炎症反应[52]. 分离自残胃炎的H pylori动力明显低于分离自慢性胃炎、消化性溃疡以及胃癌的菌株, 这提示胃部疾病的类型和疾病分期会对高动力的菌株产生选择性压力[53]. 阿司匹林是否可以通过降低H pylori的动力而影响H pylori相关性疾病的转归, 有待于进一步研究.
透射电镜观察发现, 阿司匹林处理后H pylori菌胞壁变薄不完整, 且发生不同程度的凹陷变形, 有的菌体部分或全部细胞壁脱落消失, 细胞壁和细胞膜间出现空隙, 提示阿司匹林与H pylori外膜作用. 同时本研究还发现, 经阿司匹林作用后H pylori菌胞质内容物稀疏, 电子密度下降, 空隙明显扩大, 提示细菌内容物的渗漏. 此外, 可见细菌内部结构消失, 胞质分布不均匀, 并出现高电子密度颗粒, 提示阿司匹林进入了细菌内并与胞质作用, 改变了胞质的结构. 这些发现从细菌形态学角度进一步说明, 阿司匹林不仅可改变H pylori的形态, 而且可作用于细菌外膜, 破坏其结构与功能, 并能进入细菌内与胞质作用, 从而抑制细菌的生长.
胃癌居全球肿瘤发病率和癌症死亡率的第4位和第2位[54], 高危人群数目众多, 因此化学预防是目前最有前景的降低胃癌发病率和死亡率的方法. H pylori是胃癌发生的明确的危险因素, WHO将其定为Ⅰ类致癌因子[55], H pylori感染率随年龄的增加而增加[56]; 50%以上的NSAIDs使用者年龄大于60岁, NSAIDs可通过环氧化酶依赖的和非依赖的途径抑制微血管生成、诱导上皮细胞凋亡, 从而有利于胃癌的化学预防, 并可预防胃癌的淋巴转移. 一项荟萃分析显示长期应用NSAIDs包括阿司匹林可以显著降低非贲门部胃癌的发生率, 并呈剂量依赖性的关系[57]. 本实验进一步证实NSAIDs可能降低H pylori的定植. 因此, 尽管对于胃癌发生风险较低的人群, 常规服用阿司匹林来预防胃癌可能弊大于利, 但是对于那些胃癌发生风险高及H pylori感染风险高的人群, 服用阿司匹林尤其是胃肠道副作用相对较少的选择性的COX-2抑制剂, 预防胃癌可能是可行的.
H pylori感染在世界范围广泛存在, 非甾体抗炎药是目前处方量最大的药物之一, 二者被认为是导致胃黏膜损伤及溃疡形成的主要因素. 使用NSAIDs同时合并H pylori感染在临床上并不少见, 但二者同时存在时的致病性及致病机制并不清楚. 来自临床及流行病学的研究结果, 尚存在分歧.
张小晋, 主任医师, 北京积水潭医院消化内科
胃黏膜损害的两个最主要的致病因子, H pylori和NSAIDs共同存在时的致病性, 尚存在争议, 多项研究表明, 二者之间的作用不是简单的相加, 协同或拮抗, 二者之间可能存在复杂的相互作用, 从而影响对方的致病性. NSAIDs服用者是否必须根除H pylori治疗, H pylori阳性是否是NSAIDs使用的禁忌, 是目前临床医生面临的问题, 也是研究的热点.
Wang et al研究发现, 体外培养条件下, 阿司匹林剂量依赖性地抑制H pylori的生长, 并提高H pylori对抗生素的敏感性. Shirin et al研究显示, 布洛芬、吲哚美辛及选择性COX-2抑制剂NS-398亦可以抑制H pylori的生长. 马惠霞 et al研究发现阿司匹林及COX-2抑制剂塞莱昔布剂量依赖性地抑制H pylori毒力因子尿素酶、空泡毒素的活性, 并能改变其外膜蛋白的表达. 张孝平 et al进一步研究发现, 阿司匹林通过提高H pylori外膜对抗生素的通透性, 从而提高H pylori对甲硝唑和克拉霉素的敏感性.
本研究发现阿司匹林、塞莱昔布可以破坏H pylori的正常结构, 降低细菌的动力、尿素酶的活性、黏附性, 从而降低H pylori的定植能力.
H pylori是胃癌发生的明确的危险因素, 而NSAIDs可以降低H pylori的定植并可以诱导上皮细胞凋亡及调节血管生成, 因此可用于胃癌的化学预防. 另外, 本研究有助于理解临床及流行病学研究所见的伴有H pylori感染的NSAIDs服用者的胃黏膜损害的特征.
SYBR Green Real-time PCR: 在PCR反应体系中, 加入过量SYBR green 1荧光染料, SYBR green 1荧光染料特异性地掺入DNA双链后, 发射荧光信号. 由于荧光染料能和任何dsDNA结合, 因此使实验容易产生假阳性信号, 特异性低的问题目前可以用带有熔解曲线(melting curve)分析的软件加以解决.
本研究立题较好, 方法科学, 结果可靠, 结论明确, 与临床紧密结合, 是一篇较好的论文.
编辑: 李军亮 电编:吴鹏朕
| 1. | Telford JL, Covacci A, Rappuoli R, Chiara P. Immunobiology of Helicobacter pylori infection. Curr Opin Immunol. 1997;9:498-503. [PubMed] [DOI] |
| 2. | Walker MM, Crabtree JE. Helicobacter pylori infection and the pathogenesis of duodenal ulceration. Ann N Y Acad Sci. 1998;859:96-111. [PubMed] [DOI] |
| 3. | Antonov KI, Isacson DG. Prescription and nonprescription analgesic use in Sweden. Ann Pharmacother. 1998;32:485-494. [PubMed] [DOI] |
| 4. | Loeb DS, Talley NJ, Ahlquist DA, Carpenter HA, Zinsmeister AR. Long-term nonsteroidal anti-inflammatory drug use and gastroduodenal injury: the role of Helicobacter pylori. Gastroenterology. 1992;102:1899-1905. [PubMed] [DOI] |
| 5. | Stack WA, Atherton JC, Hawkey GM, Logan RF, Hawkey CJ. Interactions between Helicobacter pylori and other risk factors for peptic ulcer bleeding. Aliment Pharmacol Ther. 2002;16:497-506. [PubMed] [DOI] |
| 6. | Gu Q, Xia HH, Wang WH, Wang JD, Wong WM, Chan AO, Yuen MF, Lam SK, Cheung HK, Liu XG. Effect of cyclo-oxygenase inhibitors on Helicobacter pylori susceptibility to metronidazole and clarithromycin. Aliment Pharmacol Ther. 2004;20:675-681. [PubMed] [DOI] |
| 7. | Wang WH, Wong WM, Dailidiene D, Berg DE, Gu Q, Lai KC, Lam SK, Wong BC. Aspirin inhibits the growth of Helicobacter pylori and enhances its susceptibility to antimicrobial agents. Gut. 2003;52:490-495. [PubMed] [DOI] |
| 8. | Wang WH, Hu FL, Benjamin CY, Wong WM, Berg DE, Lam SK. Inhibitory effects of aspirin and indometacin on the growth of Helicobacter pylori in vitro. Chinese J Dig Dis. 2002;3:172-177. |
| 9. | Shirin H, Moss SF, Kancherla S, Kancherla K, Holt PR, Weinstein IB, Sordillo EM. Non-steroidal anti-inflammatory drugs have bacteriostatic and bactericidal activity against Helicobacter pylori. J Gastroenterol Hepatol. 2006;21:1388-1393. [PubMed] [DOI] |
| 11. | Andersen LP. Colonization and infection by Helicobacter pylori in humans. Helicobacter. 2007;12 Suppl 2:12-15. [PubMed] [DOI] |
| 12. | Osaki T, Hanawa T, Manzoku T, Fukuda M, Kawakami H, Suzuki H, Yamaguchi H, Yan X, Taguchi H, Kurata S. Mutation of luxS affects motility and infectivity of Helicobacter pylori in gastric mucosa of a Mongolian gerbil model. J Med Microbiol. 2006;55:1477-1485. [PubMed] [DOI] |
| 13. | Josenhans C, Labigne A, Suerbaum S. Comparative ultrastructural and functional studies of Helicobacter pylori and Helicobacter mustelae flagellin mutants: both flagellin subunits, FlaA and FlaB, are necessary for full motility in Helicobacter species. J Bacteriol. 1995;177:3010-3020. [PubMed] |
| 14. | McGuckin MA, Every AL, Skene CD, Linden SK, Chionh YT, Swierczak A, McAuley J, Harbour S, Kaparakis M, Ferrero R. Muc1 mucin limits both Helicobacter pylori colonization of the murine gastric mucosa and associated gastritis. Gastroenterology. 2007;133:1210-1218. [PubMed] [DOI] |
| 15. | Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet. 2002;359:14-22. [PubMed] [DOI] |
| 16. | Chan FK, To KF, Wu JC, Yung MY, Leung WK, Kwok T, Hui Y, Chan HL, Chan CS, Hui E. Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial. Lancet. 2002;359:9-13. [PubMed] [DOI] |
| 17. | Schaeverbeke T, Broutet N, Zerbib F, Combe B, Bertin P, Lamouliatte H, Perié F, Joubert-Collin M, Mégraud F. Should we eradicate Helicobacter pylori before prescribing an NSAID? Result of a placebo-controlled study. Am J Gastroenterol. 2005;100:2637-2643. [PubMed] [DOI] |
| 18. | Bhang CS, Lee HS, Kim SS, Song HJ, Sung YJ, Kim JI, Chung IS, Sun HS, Park DH, Lee YS. Effects of selective cyclooxygenase-2 inhibitor and non-selective NSAIDs on Helicobacter pylori-induced gastritis in Mongolian gerbils. Helicobacter. 2002;7:14-21. [PubMed] [DOI] |
| 19. | Hudson N, Balsitis M, Filipowicz F, Hawkey CJ. Effect of Helicobacter pylori colonisation on gastric mucosal eicosanoid synthesis in patients taking non-steroidal anti-inflammatory drugs. Gut. 1993;34:748-751. [PubMed] [DOI] |
| 20. | Schraier M, Petrelli L, Bonfanti M, Di Bella A, Pest P, Man F, Adami J, Tokumoto M. [Experimental model of infection of Helicobacter pylori in the mouse. A study of gastric damage caused by indomethacin]. Acta Gastroenterol Latinoam. 2001;31:115-121. [PubMed] |
| 22. | Mobley HL. Helicobacter pylori factors associated with disease development. Gastroenterology. 1997;113:S21-S28. [PubMed] [DOI] |
| 23. | Chow J, Ma L, Ch C. The role of adhesion molecules in gastric ulcer healing. World J Gastroenterol. 1998;4:467-468. [PubMed] [DOI] |
| 24. | Halter F. Mechanism of gastrointestinal toxicity of NSAIDs. Scand J Rheumatol Suppl. 1988;73:16-21. [PubMed] [DOI] |
| 25. | Scarpignato C. Nonsteroidal anti-inflammatory drugs: how do they damage gastroduodenal mucosa? Dig Dis. 1995;13 Suppl 1:9-39. [PubMed] [DOI] |
| 26. | Caselli M, Pazzi P, LaCorte R, Aleotti A, Trevisani L, Stabellini G. Campylobacter-like organisms, nonsteroidal anti-inflammatory drugs and gastric lesions in patients with rheumatoid arthritis. Digestion. 1989;44:101-104. [PubMed] [DOI] |
| 27. | Shallcross TM, Rathbone BJ, Wyatt JI, Heatley RV. Helicobacter pylori associated chronic gastritis and peptic ulceration in patients taking non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther. 1990;4:515-522. [PubMed] [DOI] |
| 28. | Graham DY, Lidsky MD, Cox AM, Evans DJ, Evans DG, Alpert L, Klein PD, Sessoms SL, Michaletz PA, Saeed ZA. Long-term nonsteroidal antiinflammatory drug use and Helicobacter pylori infection. Gastroenterology. 1991;100:1653-1657. [PubMed] |
| 29. | Santucci L, Fiorucci S, Patoia L, Di Matteo FM, Brunori PM, Morelli A. Severe gastric mucosal damage induced by NSAIDs in healthy subjects is associated with Helicobacter pylori infection and high levels of serum pepsinogens. Dig Dis Sci. 1995;40:2074-2080. [PubMed] [DOI] |
| 30. | Taha AS, Nakshabendi I, Lee FD, Sturrock RD, Russell RI. Chemical gastritis and Helicobacter pylori related gastritis in patients receiving non-steroidal anti-inflammatory drugs: comparison and correlation with peptic ulceration. J Clin Pathol. 1992;45:135-139. [PubMed] [DOI] |
| 31. | Laine L, Marin-Sorensen M, Weinstein WM. Nonsteroidal antiinflammatory drug-associated gastric ulcers do not require Helicobacter pylori for their development. Am J Gastroenterol. 1992;87:1398-1402. [PubMed] |
| 32. | Borén T, Falk P, Roth KA, Larson G, Normark S. Attachment of Helicobacter pylori to human gastric epithelium mediated by blood group antigens. Science. 1993;262:1892-1895. [PubMed] [DOI] |
| 33. | Mahdavi J, Sondén B, Hurtig M, Olfat FO, Forsberg L, Roche N, Angstrom J, Larsson T, Teneberg S, Karlsson KA. Helicobacter pylori SabA adhesin in persistent infection and chronic inflammation. Science. 2002;297:573-578. [PubMed] [DOI] |
| 34. | Odenbreit S, Till M, Hofreuter D, Faller G, Haas R. Genetic and functional characterization of the alpAB gene locus essential for the adhesion of Helicobacter pylori to human gastric tissue. Mol Microbiol. 1999;31:1537-1548. [PubMed] [DOI] |
| 35. | Evans DG, Evans DJ Jr, Moulds JJ, Graham DY. N-acetylneuraminyllactose-binding fibrillar hemagglutinin of Campylobacter pylori: a putative colonization factor antigen. Infect Immun. 1988;56:2896-2906. [PubMed] |
| 36. | Evans DG, Karjalainen TK, Evans DJ Jr, Graham DY, Lee CH. Cloning, nucleotide sequence, and expression of a gene encoding an adhesin subunit protein of Helicobacter pylori. J Bacteriol. 1993;175:674-683. [PubMed] |
| 37. | Evans DG, Evans DJ Jr, Lampert HC, Graham DY. Restriction fragment length polymorphism in the adhesin gene hpaA of Helicobacter pylori. Am J Gastroenterol. 1995;90:1282-1288. [PubMed] |
| 38. | Tomb JF, White O, Kerlavage AR, Clayton RA, Sutton GG, Fleischmann RD, Ketchum KA, Klenk HP, Gill S, Dougherty BA. The complete genome sequence of the gastric pathogen Helicobacter pylori. Nature. 1997;388:539-547. [PubMed] [DOI] |
| 39. | Bode G, Malfertheiner P, Ditschuneit H. Pathogenetic implications of ultrastructural findings in Campylobacter pylori related gastroduodenal disease. Scand J Gastroenterol Suppl. 1988;142:25-39. [PubMed] [DOI] |
| 40. | Bauerfeind P, Garner R, Dunn BE, Mobley HL. Synthesis and activity of Helicobacter pylori urease and catalase at low pH. Gut. 1997;40:25-30. [PubMed] [DOI] |
| 41. | Eaton KA, Brooks CL, Morgan DR, Krakowka S. Essential role of urease in pathogenesis of gastritis induced by Helicobacter pylori in gnotobiotic piglets. Infect Immun. 1991;59:2470-2475. [PubMed] |
| 42. | Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infect Immun. 1998;66:4517-4521. [PubMed] |
| 43. | Eaton KA, Gilbert JV, Joyce EA, Wanken AE, Thevenot T, Baker P, Plaut A, Wright A. In vivo complementation of ureB restores the ability of Helicobacter pylori to colonize. Infect Immun. 2002;70:771-778. [PubMed] [DOI] |
| 44. | Ito Y, Shibata K, Hongo A, Kinoshita M. Ecabet sodium, a locally acting antiulcer drug, inhibits urease activity of Helicobacter pylori. Eur J Pharmacol. 1998;345:193-198. [PubMed] [DOI] |
| 45. | Mobley HL, Island MD, Hausinger RP. Molecular biology of microbial ureases. Microbiol Rev. 1995;59:451-480. [PubMed] |
| 46. | Pérez-Pérez GI, Gower CB, Blaser MJ. Effects of cations on Helicobacter pylori urease activity, release, and stability. Infect Immun. 1994;62:299-302. [PubMed] |
| 47. | O'Toole PW, Lane MC, Porwollik S. Helicobacter pylori motility. Microbes Infect. 2000;2:1207-1214. [PubMed] [DOI] |
| 48. | Eaton KA, Morgan DR, Krakowka S. Campylobacter pylori virulence factors in gnotobiotic piglets. Infect Immun. 1989;57:1119-1125. [PubMed] |
| 49. | Suerbaum S, Josenhans C, Labigne A. Cloning and genetic characterization of the Helicobacter pylori and Helicobacter mustelae flaB flagellin genes and construction of H. pylori flaA- and flaB-negative mutants by electroporation-mediated allelic exchange. J Bacteriol. 1993;175:3278-3288. [PubMed] |
| 50. | Kunin CM, Hua TH, Bakaletz LO. Effect of salicylate on expression of flagella by Escherichia coli and Proteus, Providencia, and Pseudomonas spp. Infect Immun. 1995;63:1796-1799. [PubMed] |
| 51. | Farber BF, Wolff AG. The use of nonsteroidal antiinflammatory drugs to prevent adherence of Staphylococcus epidermidis to medical polymers. J Infect Dis. 1992;166:861-865. [PubMed] [DOI] |
| 52. | Watanabe S, Takagi A, Tada U, Kabir AM, Koga Y, Kamiya S, Osaki T, Miwa T. Cytotoxicity and motility of Helicobacter pylori. J Clin Gastroenterol. 1997;25 Suppl 1:S169-S171. [PubMed] [DOI] |
| 53. | Kurihara N, Kamiya S, Yamaguchi H, Osaki T, Shinohara H, Kitahora T, Ishida H, Ozawa A, Otani Y, Kubota T. Characteristics of Helicobacter pylori strains isolated from patients with different gastric diseases. J Gastroenterol. 1998;33 Suppl 10:10-13. [PubMed] |
| 54. | Parkin DM, Bray F, Ferlay J, Pisani P. Estimating the world cancer burden: Globocan 2000. Int J Cancer. 2001;94:153-156. [PubMed] [DOI] |
| 56. | Dooley CP, Cohen H, Fitzgibbons PL, Bauer M, Appleman MD, Perez-Perez GI, Blaser MJ. Prevalence of Helicobacter pylori infection and histologic gastritis in asymptomatic persons. N Engl J Med. 1989;321:1562-1566. [PubMed] [DOI] |
| 57. | Wang WH, Huang JQ, Zheng GF, Lam SK, Karlberg J, Wong BC. Non-steroidal anti-inflammatory drug use and the risk of gastric cancer: a systematic review and meta-analysis. J Natl Cancer Inst. 2003;95:1784-1791. [PubMed] [DOI] |