修回日期: 2009-01-23
接受日期: 2009-02-09
在线出版日期: 2009-03-18
目的: 探讨结肠癌组织中B7-H1的表达及其与肿瘤转移的关系.
方法: 应用免疫组化技术检测64例新鲜结肠癌组织以及18例癌旁正常结肠黏膜组织中B7-H1的表达, 分析B7-H1的表达与结肠癌患者临床病理指标的关系.
结果: 结肠癌组织中有B7-H1蛋白的原位表达, 阳性表达率为48.44%, 而癌旁正常结肠黏膜组织中B7-H1蛋白阳性表达率为22.22%, 两者差异具有统计学意义(P<0.05). B7-H1蛋白的阳性表达率与结肠癌的淋巴结转移有关(P<0.05), 而与浸润深度、分化程度、临床分期等无关.
结论: B7-H1可作为一个预测结肠癌转移潜能的新的生物学指标.
引文著录: 刘书漫, 刘国红, 张钦宪, 刘占举. B7-H1在结肠癌组织中的表达及意义. 世界华人消化杂志 2009; 17(8): 841-843
Revised: January 23, 2009
Accepted: February 9, 2009
Published online: March 18, 2009
AIM: To study the relationship between expression of B7-H1 in colon cancer and neoplasm metastasis.
METHODS: Expressions of B7-H1 in 64 cases of colon cancer and in 18 cases of tumor adjacent normal colon mucous tissue were assayed by immunohistochemical staining, and its correlations with patients' clinical pathological indexes were analyzed.
RESULTS: B7-H1 protein expression was positive in colon cancer tissues, and the positive rate was 48.44%. But the positive rate of B7-H1 protein expression in tumor adjacent colon mucous tissue was 22.22%, and statistically significant difference was observed (P < 0.05). The positive rate of B7-H1 protein in colon cancer tissue was correlated with lymph node metastasis (P < 0.05), but not with the invasion depth, cellular differentiation or pTNM stage.
CONCLUSION: B7-H1 may be used as a new biological indicator to predict metastatic potential of colon cancer.
- Citation: Liu SM, Liu GH, Zhang QX, Liu ZJ. Expression of B7-H1 and its significance in colon cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 841-843
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/841.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.841
B7-H1(PD-L1)是B7家族的一个新成员, 其受体是PD-1. B7-H1与PD-1的相互作用抑制T细胞的增殖和细胞因子的分泌[1]. 已经发现人的胃癌、急性淋巴细胞瘤等肿瘤组织中均有B7-H1的异常表达, 且肿瘤细胞上表达的B7-H1在体外能介导抗原特异性T细胞的凋亡[2-4]. 然而关于结肠癌组织中B7-H1的表达及其临床意义至今国内未见详细报道. 近年来, 结肠癌的发病率逐渐升高, 且我们观察到这样一种现象: 即有些分化较好、发现较早的结肠癌手术时却已存在淋巴结转移, 甚至远处转移[5]. 在此我们运用免疫组化方法研究了结肠癌组织中B7-H1的表达, 并结合传统的临床病理指标, 探讨其与结肠癌淋巴结转移之间的关系.
收集郑州大学第二附属医院2006-10/ 2008-02内镜以及手术切除的共64例新鲜结肠癌标本, 其中18例手术切除的标本均取癌组织、癌旁组织(距癌组织>5 cm的正常组织)各1份, 标本均经病理证实, 新鲜组织标本立即用OCT胶包埋后入-80℃保存. 患者年龄38-71岁, 其中男43例, 女21例, 所有患者术前未接受化疗和(或)放疗.
将用OCT胶包埋好的组织标本用恒冷冰冻切片机(American Optical HistoSTAT MicroTOME)-20℃下连续冠状切片, 切成5 μm厚的冰冻切片, 室温晾干后, 入40 g/L多聚甲醛中固定, 再用PBS冲洗. 以下步骤按照Histostain-Plus Kit(晶美生物工程有限公司)说明书进行操作, 依次经3 mL/L H2O2封闭内源性过氧化物酶, 体积分数为100 g/L山羊血清封闭, 滴加小鼠抗人B7-H1 mAb(1:100), 4℃过夜. 次晨依次加抗小鼠生物素化二抗和标记HRP链亲和素, DAB显色, 苏木素复染细胞核. 以PBS代替一抗作为阴性对照. 每个标本随机观测10个高倍视野(400×), 以细胞质中含大量粗大棕黄色颗粒的细胞为阳性细胞, 基本不含或无粗大棕黄色颗粒的细胞为阴性细胞. 结肠癌组织中着色的B7-H1阳性细胞少于10%为B7-H1表达阴性, 大于10%为表达阳性[6].
统计学处理 应用SPSS12.0统计学软件对数据行χ2检验, 检验水准α = 0.05.
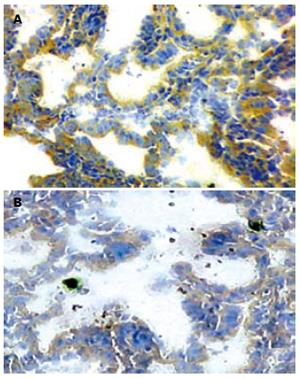
免疫组织化学分析显示, B7-H1蛋白在结肠癌组织中呈阳性表达, 阳性表达率为48.44%(31/64例), 阳性染色位于结肠癌细胞的细胞膜和细胞质中, 呈淡黄色至棕黄色细颗粒, 细胞核不染色(图1); 而B7-H1在结肠癌旁组织中表达较弱或者不表达, 其阳性表达率仅为22.22%(4/18例), 两者间差异有统计学意义(P<0.05).
在64例结肠癌标本中, 有淋巴结转移组B7-H1阳性表达25例(阳性率为65.79%), 与淋巴结转移阴性组6例(阳性率为23.08%)比较有统计学意义(P = 0.015), 而在结肠癌组织中B7-H1的表达与结肠癌的浸润深度、分化程度、临床分期等无关(P>0.05, 表1). 这表明, B7-H1的表达可能与结肠癌淋巴结转移有关.
| 病理类型 | n | 阳性数 | 阳性率(%) | P值 |
| 组织类型 | ||||
| 癌组织 | 64 | 31 | 48.44 | 0.019 |
| 癌旁组织 | 18 | 4 | 22.22 | |
| 淋巴结转移 | ||||
| 有 | 38 | 25 | 65.79 | 0.015 |
| 无 | 26 | 6 | 23.08 | |
| 外浸程度 | ||||
| 黏膜或浅肌层 | 25 | 11 | 44.00 | 0.441 |
| 深肌层以上 | 39 | 20 | 51.28 | |
| 分化程度 | ||||
| 高-中分化 | 36 | 17 | 47.22 | 0.678 |
| 低分化 | 28 | 14 | 50.00 | |
| 临床分期 | ||||
| Ⅰ期+Ⅱ期 | 33 | 18 | 54.55 | 0.332 |
| Ⅲ期+Ⅳ期 | 31 | 13 | 41.94 |
肿瘤的发病机制目前尚不十分清楚, 但是肿瘤发生上的免疫逃避机制是其发生的重要机制之一. 近年来, 围绕肿瘤细胞逃逸免疫的途径做了多方面的研究, B7家族是这方面研究的一个热点. B7-H1是近年发现的B7家族的新成员之一, 其对调节T细胞和B细胞反应有很明显的效应[7]. 研究证实, B7-H1除了在淋巴组织表达外, 还在非淋巴组织表达[8], 且B7-H1在非淋巴组织上的表达可以调节外周器官中T细胞和B细胞的免疫反应和炎症反应.
以往虽有研究证实, B7-H1在体外可通过其抑制性受体PD-1抑制Th1为主的免疫反应, 从而在诱导T细胞凋亡和肿瘤免疫逃避中发挥重要作用[9]. 迄今尚未见B7-H1表达与肿瘤转移相关性的报道. 存在早期淋巴结转移是临床上近年来发现的结肠癌的特点, 并对结肠癌患者的愈后影响很大, 我们迫切需要揭开结肠癌淋巴结转移的机制.
本研究结果表明, B7-H1蛋白在结肠癌组织中的阳性表达率显著高于其在结肠癌旁组织中的阳性表达率, 结合以前在其他肿瘤中的报道[2-4], 提示B7-H1确实参与了结肠癌的发生. 且发现, B7-H1在伴有淋巴结转移的结肠癌组织中的表达要比未发生淋巴结转移的结肠癌组织中含量明显升高, 其发生机制可能与B7-H1的受体PD-1或者另外一个非PD-1受体在淋巴结中的特异性高表达有关[7].
若要证明我们的假设, 尚需设计试验检测筛查PD-1或者非PD-1受体在结肠癌患者转移淋巴结中的表达情况. 如果假设得到证实, 我们认为针对B7-H1/PD-1可设计相应的抗体从而阻断PD-1与B7-H1的结合, 减少其淋巴结转移, 又因为B7-H1在机体外周免疫耐受中发挥重要的作用[1], 似乎针对PD-1的抗体在未来更具有可行性. 这些都为我们下一步的试验指明了方向.
B7-H1分子是近年来发现的一种免疫共刺激分子, 主要表达在抗原提呈细胞上. B7-H1与其表达在淋巴细胞表面程序死亡受体PD-1结合后能诱导T细胞失功能和凋亡, 介导肿瘤免疫逃逸, 促进肿瘤生长, 在外周免疫耐受调节中发挥重要作用. 本文是在我们课题组以往工作的基础上研究了结肠癌组织中B7-H1的表达, 探讨结肠癌组织中B7-H1的表达及其与肿瘤转移的关系.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
近年来, 结肠癌的发病率逐渐升高, 有些分化较好、发现较早的结肠癌手术时却已存在淋巴结转移, 甚至远处转移, 因此结肠癌早期转移的机制已成为当下的研究热点.
国内外有学者发现B7-H1在胃癌, 食管癌, 肝癌等恶性肿瘤组织中异常表达, 并且诱导肿瘤细胞逃避免疫攻击, 促进肿瘤生长, 然而关于结肠癌组织中B7-H1的表达及其与淋巴结转移的关系至今国内未见详细报道.
本文探讨结肠癌组织中B7-H1表达与肿瘤生物学行为的关系, 有重要临床意义.
编辑: 李军亮 电编:何基才
| 1. | Blank C, Mackensen A. Contribution of the PD-L1/PD-1 pathway to T-cell exhaustion: an update on implications for chronic infections and tumor evasion. Cancer Immunol Immunother. 2007;56:739-745. [PubMed] [DOI] |
| 2. | Brown JA, Dorfman DM, Ma FR, Sullivan EL, Munoz O, Wood CR, Greenfield EA, Freeman GJ. Blockade of programmed death-1 ligands on dendritic cells enhances T cell activation and cytokine production. J Immunol. 2003;170:1257-1266. [PubMed] [DOI] |
| 3. | Liu SM, Meng Q, Zhang QX, Wang SD, Liu ZJ, Zhang XF. [Expression and significance of B7-H1 and its receptor PD-1 in human gastric carcinoma]. Zhonghua Zhongliu Zazhi. 2008;30:192-195. [PubMed] |
| 4. | Chen X, Liu S, Wang L, Zhang W, Ji Y, Ma X. Clinical significance of B7-H1 (PD-L1) expression in human acute leukemia. Cancer Biol Ther. 2008;7:622-627. [PubMed] [DOI] |
| 6. | Thompson RH, Kuntz SM, Leibovich BC, Dong H, Lohse CM, Webster WS, Sengupta S, Frank I, Parker AS, Zincke H. Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up. Cancer Res. 2006;66:3381-3385. [PubMed] [DOI] |
| 7. | Wang S, Bajorath J, Flies DB, Dong H, Honjo T, Chen L. Molecular modeling and functional mapping of B7-H1 and B7-DC uncouple costimulatory function from PD-1 interaction. J Exp Med. 2003;197:1083-1091. [PubMed] [DOI] |
| 8. | Liang SC, Latchman YE, Buhlmann JE, Tomczak MF, Horwitz BH, Freeman GJ, Sharpe AH. Regulation of PD-1, PD-L1, and PD-L2 expression during normal and autoimmune responses. Eur J Immunol. 2003;33:2706-2716. [PubMed] [DOI] |
| 9. | Stanciu LA, Bellettato CM, Laza-Stanca V, Coyle AJ, Papi A, Johnston SL. Expression of programmed death-1 ligand (PD-L) 1, PD-L2, B7-H3, and inducible costimulator ligand on human respiratory tract epithelial cells and regulation by respiratory syncytial virus and type 1 and 2 cytokines. J Infect Dis. 2006;193:404-412. [PubMed] [DOI] |