修回日期: 2009-02-12
接受日期: 2009-02-16
在线出版日期: 2009-03-18
目的: 研究Connexin、Par-3在结直肠肿瘤组织中的表达变化及特征, 探讨其临床意义.
方法: 选取2007-05/2008-03在本院诊断治疗结直肠肿瘤患者51例, 取材肿瘤组织并分为3组: 肿瘤组织、癌旁组织(2.0 cm)和正常组织(距肿瘤>5.0 cm). 电镜下观察肿瘤细胞形态变化, HE染色观察肿瘤组织病理变化, 免疫组化及Western blot检测Connexin、Par-3的表达.
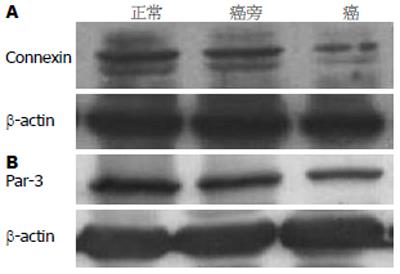
结果: 肿瘤上皮细胞形态不规则, 细胞极性消失, 细胞器排列紊乱, 细胞连接结构破坏, 紧密连接、中间连接和桥粒结构基本消失. 正常上皮细胞形态规则, 细胞极性明显, 细胞连接结构完整. 免疫组化检测显示: 正常肠道组织中Par-3与Connexin的表达水平最高(0.572±0.051, 0.485±0.042), 癌旁组织次之(0.432±0.049, 0.367±0.035), 癌组织表达水平最低(0.290±0.041, 0.227±0.031); 三种组织两两之间的差异性检测有极显著的统计学意义(P<0.05).
结论: Connexin和Par-3的表达下调极可能是癌细胞恶变程度加重与复发转移的前兆.
引文著录: 刘俊, 刘胜洪, 刘金林, 赵刚, 张维康. Par-3及Connexin在结直肠肿瘤中的表达变化. 世界华人消化杂志 2009; 17(8): 785-789
Revised: February 12, 2009
Accepted: February 16, 2009
Published online: March 18, 2009
AIM: To study the expression change and characteristics of Connexin and protease activated receptor 3 (Par-3) and to investigate their clinical significance in colorectal tumor.
METHODS: The 51 tissue samples were collected and divided into three groups: tumor tissue group, tissue adjacent to tumor group (2.0 cm), and normal tissue group (apart from tumor >5.0 cm) respectively. Morphological changes of cells were observed using electronic microscopy, histopathological changes were detected using HE staining, and the expressions of Connexin and Par-3 were detected immunohistochemistry and Western blot.
RESULTS: The tumor tissue was deformed and epithelium polarity was vanished, compared with normal tissue. On electronic microscopy, the organelles of the tumor epithelium was in disorder and the structure of cell junctions, such as tight junction, intermediate junction were disarranged or disappeared. For normal tissue group, epithelial cells were regular in shape, the cell polarity was clear, and the cell junction structure was integrated. Immunohistochemistry showed the expression levels of Connexin and Par-3 were gradually decreased, in such order as normal tissue group (0.572 ± 0.051, 0.485 ± 0.042), tissue adjacent to tumor group (0.432 ± 0.049, 0.367 ± 0.035), and tumor tissue of colorectum group (0.290 ± 0.041, 0.227 ± 0.031). There had been significant difference among them (P < 0.05).
CONCLUSION: Down-regulation of Connexin and Par-3 expression is premonition for cancer cell aggravation and metastasis.
- Citation: Liu J, Liu SH, Liu JL, Zhao G, Zhang WK. Changes in expression of Connexin and Par-3 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 785-789
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/785.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.785
结直肠癌是消化系常见的恶性肿瘤, 占消化系肿瘤发病率的第2位[1], 及早发现和准确诊断结直肠癌转移或复发, 与结直肠癌患者临床治疗效果及预后有密切关系[2-3]. 因此, 相关的研究一直受到重视.
选取2007-05/2008-03在本院诊断治疗结直肠肿瘤患者51例, 男23例, 女28例, 年龄56±2.5岁. 所有病例术前经过纤维结肠镜检查和活组织病理诊断确诊, 组织学分型: 管状腺癌16例, 乳头状腺癌14例, 黏液腺癌21例. 每1病例取材分别为癌组织、肿瘤组织、癌旁2.0 cm组织和距肿瘤>5.0 cm正常组织.
1.2.1 组织病理学处理: 取材组织经过生理盐水冲洗以后, 剪成体积约为0.8 cm3小块置入40 g/L多聚甲醛固定24 h, 组织在0.01 mol/L PBS中漂洗1 h, 用酒精上行脱水、透明、石蜡包埋、切片、粘片备用.
取材组织剪成直径为1 mm3左右的小块, 经过生理盐水冲洗以后, 置入2.5%的戊二醛(0.1 mol/L PB配制)固定24 h. 用0.01 mol/L PBS中漂洗30 min×3.
组织经丙酮脱水(60%、70%、80%、90%、100%), 每一步的时间为2 h. 浸透与包埋. Epon-812作为电镜包埋剂, 先用丙酮与Epon-812按1:1配成预包埋剂, 浸透过夜; 将组织浸入到Epon-812包埋剂中, 浸透后置入包埋器内, 60℃, 24 h, 完成包埋, 组织块修整, 电镜切片机切片, 贴铜网, 电镜观察.
1.2.2 免疫组化SABC法显色: 切片常规脱蜡后用0.01 mol/L PBS漂洗, 30 mL/L H2O2阻断内源性过氧化物酶活性. 再用4% BSA进行封闭; 滴入一抗(connexin26和Par-3为Sant Cruz公司产品), 每组织块30 µL. 将切片放入湿盒, 4℃过夜后室温2 h. 生物素标记的二抗37℃, 1 h, 0.01 mol/L PBS稀释SABC, 37℃, 1 h, B显色. 切片用苏木素复染30 s, 自来水冲10 min. 上行酒精脱水, 透明, 封片.
1.2.3 肿瘤组织总蛋白提取方法: 临床手术切除癌组织, 癌旁组织和正常组织分别置于裂解液(50 mmol/L pH7.5 Tris-Cl, 100 mL/L glycerol, 5 mmol/L醋酸镁, 0.2 mmol/L EDTA, 1 g/L Leupeptin, 1 g/L Pepstatin, 1 g/L Aprotinin, 15.41 g/L DTT, 0.42 kg/L NaF, 0.08 kg/L钒酸钠, 17.4 g/L PMSF, 50 mol/L NaN3)中, 匀浆后, 0℃静置60 min. 超声震荡3 min, 低温离心9000 r/min, 15 min, 取上清液-20℃保存, 待用.
1.2.4 Western blot: 取上述匀浆的上清于100 g/L SDS-PAGE凝胶上进行电泳分离后蛋白湿转入硝酸纤维膜上. 50 g/L牛奶封闭30 min; Par-3和Connexin(1:500)(Santa Cruz公司产品)4℃, 18 h; 辣根过氧化物酶标记的羊抗兔抗体(1:2500, 北京中杉), 37℃孵育1 h; ECL显色曝光.
用Bandscan4.3, 对每个目的条带进行总灰度的分析, 并与β-actin的值相比, 进行标准化.
统计学处理 所有的结果用mean±SD表示, 并用t检验进行两两比较, P<0.05在统计学上有显著性差异.
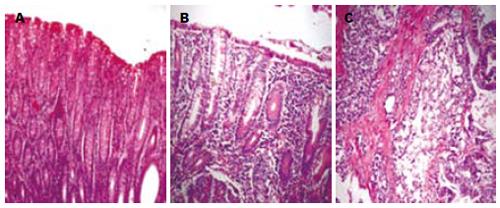
实验所收集的病理标本主要为黏液腺癌和管状、乳头状腺癌, 肉眼可见肿瘤组织向肠腔内隆起, 外观呈红色, 质地坚硬, 形状不规则, 与癌旁组织和与远离癌组织的正常肠道黏膜组织(图1A-B)有明显差别. 上皮细胞失去正常规律排列, 肠腺形状不一, 失去规则, 肠腔大小不一, 癌组织上皮细胞连接松散, 脱落(图1C).
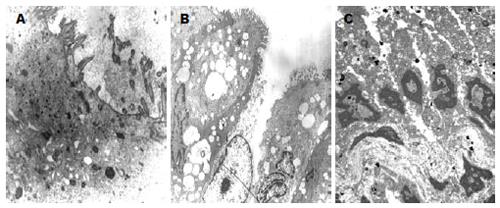
正常上皮细胞形态规则, 细胞极性明显, 细胞器排列清晰, 细胞连接结构完整, 紧密连接、中间连接和桥粒结构由表及里, 细胞间隙不明显. 可见明显的细胞连接复合体, 即紧密连接、中间连接和桥粒.
癌细胞形态不规则, 细胞极性消失, 细胞器排列紊乱, 细胞连接结构破坏, 紧密连接、中间连接和桥粒结构基本消失, 有些上皮细胞的细胞连接复合体破坏(图2A-B), 在较低分化的癌细胞中, 细胞连接完全破坏, 细胞间隙增宽(图2C).
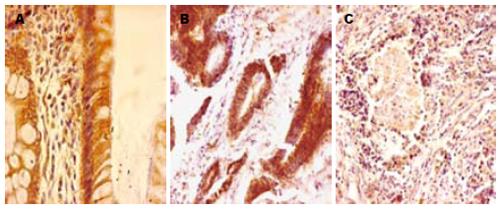
光镜下, Connexin免疫细胞化学反应阳性产物主要定位于肠上皮细胞膜表面(图3A). 在癌旁周组织中, 黏膜上皮细胞轮廓不清晰, Connexin反应呈阳性(图3B). 但在某些低分化的腺癌组织中肠腺结构已不完整, 腺细胞排列紊乱, 数量较少, 散在分布于结缔组织中, 其腺上皮细胞Connexin免疫反应明显减弱, 腺上皮周围结缔组织中, Connexin免疫反应呈阴性显示(图3C).
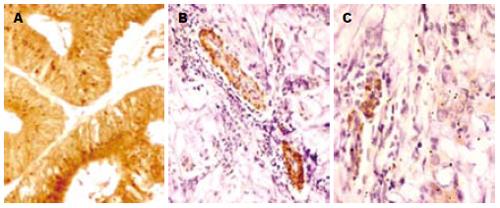
正常肠腺上皮细胞中, Par-3呈阳性点状表达, 定位于上皮细胞胞质或近顶部胞膜处, 常呈颗粒状分布(图4A). 中度分化的腺癌管腔变小, 散在分布在组织中, 腺上皮中Par-3免疫细胞化学反应减弱(图4B); 低分化的腺癌组织中肠腺结构已不完整, 腺细胞排列紊乱, 数量较少, 其腺上皮细胞Par-3免疫反应明显减弱, Par-3表达下降更明显(图4C).
消化系上皮细胞侧面连接是维持上皮组织的整体性的条件之一, 也是癌变细胞必定干扰的结构区[4-7]. 研究发现胃肠道相邻上皮细胞膜上的Connexin可以通过侧面同类分子的相互锁定(interlock)而构成牢固细胞连接[8]. 这种连接的形成需要一种被称为nectin蛋白的介入[9], 他促进募集细胞表面黏附分子形成分子互锁. 而nectin的胞内端则与调节分子Par-3结合[10], 共同参与细胞连接结构的维持和调节. Par-3又称为细胞极性(polarity)蛋白分子, 广泛分布于机体的多种组织和细胞中, 对机体细胞功能调节具有重要作用, 尤其是对上皮细胞连接的形成、维持以及重建均起着重要作用[11-14]. 基因敲除Par-3分子, 可使细胞连接分子表达下降[15], 细胞连接松散, 导致细胞分化的改变, 或肿瘤转移的发生[16]. 但目前关于肠道肿瘤上皮细胞Par-3与Connexin表达之间的相关性研究目前尚无报道.
本实验初步观察的结果显示, 癌组织上皮细胞连接松散, 与癌旁组织和远离癌组织的正常肠道黏膜组织有明显差别. 电镜下可以观察到肿瘤上皮细胞形态不规则, 细胞极性消失, 细胞器排列紊乱, 细胞连接结构破坏, 紧密连接、中间连接和桥粒结构基本消失, 细胞间隙增宽.
本研究免疫组织化学和免疫印迹的结果均显示, 正常肠腺上皮细胞中, Par-3呈阳性点状表达, 定位于上皮细胞胞质或近顶部胞膜处; 中度分化的腺癌管腔变小,散在分布于组织中, 腺上皮中Par-3免疫细胞化学反应减弱; 低分化的腺癌组织中肠腺结构不完整, 腺细胞排列紊乱, 数量较少, 散在分布结缔组织中, 腺上皮中Par-3免疫细胞化学反应几乎消失, 腺上皮周围结缔组织中, Par-3免疫反应呈阴性; 与Par-3反应阳性腺上皮相比, Par-3表达下降更明显. Par-3免疫印迹反应的定量分析结果显示癌组织中Par-3的表达也明显下调. 这与Connexin的表达结果基本一致, 提示他们之间存在一定的协调关系. Yano和Nambara et al在体外肿瘤细胞培养实验中观察到Connexin存在类似表达现象[17-18], 与我们在肿瘤组织切片中的观察的结果基本一致, 因而可以认为Connexin与肿瘤的形成和分化程度有密切关联. 但肿瘤细胞Par-3表达的类似研究, 目前尚未见文献报导. 可以推测直肠肿瘤组织中Connexin表达下调, 可能是导致上皮细胞松散脱落, 细胞出现转化、间变或复发等变化的关键原因之一. 但Par-3与Connexin的表达变化一致的意义目前尚不清楚, 具体的机制需要进一步分子生物学研究的证实.
尽管Par-3在肿瘤研究方面报道较少, 已有研究显示上皮细胞向肿瘤细胞方向转化早期, 即细胞发生间变时, 首先表现为细胞连接的破坏. 文献报道, Par-3与Par-6和aPKC是以一种蛋白复合体的形式存在, 与细胞连接的形成和维持有很重要的关系[19]. 研究发现某些原因使Par-3表达下调时, 会使复合体Par-6和aPKC分子从细胞膜向胞质转位, 其结果使上皮细胞极性消失, 连接松散, 细胞出现间变特征[20]. TGF-β可下调E-cadherin表达, 但这一作用可被过表达Par-3逆转, 因此可以认为, Par-3不仅对细胞侧面连接的蛋白分子的表达具有重要的调控[19]. 而且也可能是上游因子作用的靶点, 上游因子通过Par-3调控下游的细胞连接分子的表达, 进而对上皮细胞的连接结构进行调控.
总之, 由于Connexin和Par-3与细胞连接有关的, 可以推测Par-3和Connexin表达下调可视为细胞间变或恶变的早期信号, 他们的表达变化有助于确定肿瘤细胞恶变程度加重与转移的前兆, 因此, 本研究结果对结直肠癌的分类、预后判断及处理可能具有一定的临床意义.
结直肠癌是是消化系常见的恶性肿瘤, 而消化系上皮细胞侧面连接是维持上皮组织的整体性的条件之一, 也是癌变细胞必定干扰的结构区. 胃肠道相邻上皮细胞膜上的Connexin在nectin蛋白的介入下促进募集细胞表面黏附分子形成分子互锁而构成牢固细胞连接, nectin的胞内端则与Par-3结合, 共同参与细胞连接结构的维持和调节. Par-3分子表达下降, 可使细胞连接分子表达下降, 细胞连接松散, 导致细胞分化的改变, 或肿瘤转移的发生.
秦华东, 教授, 哈尔滨医科大学附属第二医院普外四科
研究结直肠肿瘤细胞生物学特性, 以及与细胞连接相关蛋白分子的表达变化及规律, 不仅是基础医学研究工作的重点, 对其诊断和治疗也具有重要的临床意义.
尽管Par-3在肿瘤研究方面报道较少, 已有研究显示上皮细胞向肿瘤细胞方向转化早期, 即细胞发生间变时, 首先表现为细胞连接的破坏.
Par-3: 又称为细胞极性(polarity)蛋白分子, 广泛分布于机体的多种组织和细胞中, 对机体细胞功能调节具有重要作用, 尤其是对上皮细胞连接的形成、维持以及重建均起着重要作用.
本文所选择的分子学指标较为新颖, 但是一些具体的和确切的机制需要进一步研究, 尤其是具体的分子生物学机制.
编辑: 李军亮 电编:何基才
| 1. | Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol. 2006;24:2137-2150. [PubMed] [DOI] |
| 3. | Nystrom M, Mutanen M. Diet and epigenetics in colon cancer. World J Gastroenterol. 2009;15:257-263. [PubMed] [DOI] |
| 4. | Meyer L, Meyer F, Dralle H, Ernst M, Lippert H, Gastinger I. Insufficiency risk of esophagojejunal anastomosis after total abdominal gastrectomy for gastric carcinoma. Langenbecks Arch Surg. 2005;390:510-516. [PubMed] [DOI] |
| 5. | de Carvalho AD, de Souza W, Morgado-Díaz JA. Morphological and molecular alterations at the junctional complex in irradiated human colon adenocarcinoma cells, Caco-2. Int J Radiat Biol. 2006;82:658-668. [PubMed] [DOI] |
| 6. | Niessen CM. Tight junctions/adherens junctions: basic structure and function. J Invest Dermatol. 2007;127:2525-2532. [PubMed] [DOI] |
| 7. | Li Z, Zhou Z, Donahue HJ. Alterations in Cx43 and OB-cadherin affect breast cancer cell metastatic potential. Clin Exp Metastasis. 2008;25:265-272. [PubMed] [DOI] |
| 8. | Fiorini C, Gilleron J, Carette D, Valette A, Tilloy A, Chevalier S, Segretain D, Pointis G. Accelerated internalization of junctional membrane proteins (connexin 43, N-cadherin and ZO-1) within endocytic vacuoles: an early event of DDT carcinogenicity. Biochim Biophys Acta. 2008;1778:56-67. [PubMed] [DOI] |
| 9. | Rikitake Y, Takai Y. Interactions of the cell adhesion molecule nectin with transmembrane and peripheral membrane proteins for pleiotropic functions. Cell Mol Life Sci. 2008;65:253-263. [PubMed] [DOI] |
| 10. | Iden S, Rehder D, August B, Suzuki A, Wolburg-Buchholz K, Wolburg H, Ohno S, Behrens J, Vestweber D, Ebnet K. A distinct PAR complex associates physically with VE-cadherin in vertebrate endothelial cells. EMBO Rep. 2006;7:1239-1246. [PubMed] [DOI] |
| 11. | Chan JR, Jolicoeur C, Yamauchi J, Elliott J, Fawcett JP, Ng BK, Cayouette M. The polarity protein Par-3 directly interacts with p75NTR to regulate myelination. Science. 2006;314:832-836. [PubMed] [DOI] |
| 12. | Wells CD, Fawcett JP, Traweger A, Yamanaka Y, Goudreault M, Elder K, Kulkarni S, Gish G, Virag C, Lim C. A Rich1/Amot complex regulates the Cdc42 GTPase and apical-polarity proteins in epithelial cells. Cell. 2006;125:535-548. [PubMed] [DOI] |
| 13. | Pilot F, Philippe JM, Lemmers C, Lecuit T. Spatial control of actin organization at adherens junctions by a synaptotagmin-like protein Btsz. Nature. 2006;442:580-584. [PubMed] [DOI] |
| 14. | Ooshio T, Fujita N, Yamada A, Sato T, Kitagawa Y, Okamoto R, Nakata S, Miki A, Irie K, Takai Y. Cooperative roles of Par-3 and afadin in the formation of adherens and tight junctions. J Cell Sci. 2007;120:2352-2365. [PubMed] [DOI] |
| 15. | Lees-Miller SP. The double (strand break) life of Par-3. Nat Cell Biol. 2007;9:363-365. [PubMed] [DOI] |
| 16. | Mizuno K, Suzuki A, Hirose T, Kitamura K, Kutsuzawa K, Futaki M, Amano Y, Ohno S. Self-association of PAR-3-mediated by the conserved N-terminal domain contributes to the development of epithelial tight junctions. J Biol Chem. 2003;278:31240-31250. [PubMed] [DOI] |
| 17. | Yano T, Yamasaki H. Regulation of cellular invasion and matrix metalloproteinase activity in HepG2 cell by connexin 26 transfection. Mol Carcinog. 2001;31:101-109. [PubMed] [DOI] |
| 18. | Nambara C, Kawasaki Y, Yamasaki H. Role of the cytoplasmic loop domain of Cx43 in its intracellular localization and function: possible interaction with cadherin. J Membr Biol. 2007;217:63-69. [PubMed] [DOI] |
| 19. | Wang X, Nie J, Zhou Q, Liu W, Zhu F, Chen W, Mao H, Luo N, Dong X, Yu X. Downregulation of Par-3 expression and disruption of Par complex integrity by TGF-beta during the process of epithelial to mesenchymal transition in rat proximal epithelial cells. Biochim Biophys Acta. 2008;1782:51-59. [PubMed] [DOI] |
| 20. | Hirose T, Izumi Y, Nagashima Y, Tamai-Nagai Y, Kurihara H, Sakai T, Suzuki Y, Yamanaka T, Suzuki A, Mizuno K. Involvement of ASIP/PAR-3 in the promotion of epithelial tight junction formation. J Cell Sci. 2002;115:2485-2495. [PubMed] |