修回日期: 2009-02-16
接受日期: 2009-03-02
在线出版日期: 2009-03-18
目的: 探讨射频消融(RFA)对兔肝VX2肿瘤血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响.
方法: 建立日本大耳白兔肝VX2肿瘤模型, 随机分为3组: 对照组直接处死取肝脏标本; RFA治疗(4 h和24 h)组于射频消融后4 h和24 h处死取出肝脏组织. 并以正常兔肝脏组织为正常对照, 通过免疫组织化学方法和逆转录聚合酶链式反应(RT-PCR)方法检测VEGF的蛋白和基因表达.
结果: VX2肿瘤浸润性生长, 射频后中央消融区呈现大片坏死, 周围见炎性反应带, 外围癌组织残留. 免疫组化和RT-PCR示对照组肿瘤组织VEGF的蛋白和基因表达均高于正常组(VEGF/GAPDH基因灰度比: 1.3048±0.1936 vs 0.8993±0.1107, P<0.05), 射频消融后4 h和24 h表达明显下降(VEGF/GAPDH基因灰度比: 0.7388±0.1503, 0.8935±0.1936, 均P<0.05), 但不同时间段并无明显差异.
结论: RFA治疗能下调肿瘤VEGF基因和蛋白水平的表达, 抑制血管生成, 减少血供, 进而降低了复发和转移几率.
引文著录: 倪雪君, 成建萍, 周国雄, 于秀, 丁晓凌, 张海峰. 射频消融治疗对兔肝VX2肿瘤VEGF表达的影响. 世界华人消化杂志 2009; 17(8): 780-784
Revised: February 16, 2009
Accepted: March 2, 2009
Published online: March 18, 2009
AIM: To investigate the effect of radio frequency ablation (RFA) on vascular endothelial growth factor (VEGF) expression in rabbit liver VX2 tumor models.
METHODS: The liver VX2 tumor models were established by planting the tumor tissue suspension into rabbits' liver and then divided into three groups: Control group were killed directly to obtain liver specimens; treat group were treated with RFA and executed after 4 h and 24 h randomly. And normal rabbit livers were used as the normal group. The expression of VEGF in all groups was detected by immunohistochemistry and reverse transcriptase-polymerase chain reaction (RT-PCR).
RESULTS: VX2 liver tumor showed infiltrative growth. After RFA, large necrosis in the central ablation area, surrounded by inflammatory response belt and peripheral residual tumor tissue, was observed in the specimens from tumors. By immunohistochemistry and RT-PCR, the protein and gene expressions of VEGF in the control group were higher than those in the normal group (VEGF-mRNA/GAPDH-mRNA 1.3048 ± 0.1936 vs 0.8993 ± 0.1107, P < 0.05), while those in treatment group (4 h: 0.7388 ± 0.1503; 24 h: 0.8935 ± 0.1936) were decreased obviously as compared with the control group (both P < 0.05). However, there was no significant difference in the expression of VEGF in the tumor tissue among the different time points of the RFA group (P > 0.05).
CONCLUSION: RFA treatment can effectively down-regulate the protein and gene expression of VEGF, inhibit the angiopoiesis and reduce the blood supply, thus may reduce tumor relapse and metastasis.
- Citation: Ni XJ, Cheng JP, Zhou GX, Yu X, Ding XL, Zhang HF. Effect of radio frequency ablation on vascular endothelial growth factor expression in rabbit liver VX2 tumor models. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 780-784
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/780.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.780
射频消融(radio-frequency ablation, RFA)以其适应证广泛、创伤小、安全性高已经成为肝癌治疗的一种新兴疗法, 但是消融不完全和易复发仍然是临床医师倍感棘手的问题, 大肝癌尤其如此[1]. 本实验通过控制移植肿瘤的大小和RFA的范围, 使部分肿瘤组织残留, 通过免疫组化染色和RT-PCR观察残癌组织中VEGF的表达, 探讨RFA对残癌组织血管生成的影响, 以了解RFA治疗肝癌的分子机制, 为RFA治疗肝癌寻求进一步的依据.
日本大耳白兔20只, 雌雄不限, 兔龄4-6 mo, 体质量2.5±0.5 kg, 由南通大学实验动物中心提供. VX2肿瘤种兔1只, 南通大学公共卫生学院惠赠. 冷循环型射频治疗仪购自美国Radionics公司; Acuson Sequoia 512超声仪购自德国西门子公司; VEGF多克隆抗体购自北京中杉金桥生物技术有限公司; 引物由上海生工合成: 内参GAPDH引物上游: 5'-ATGGGAAGCTGGTCATCAAC-3', 下游: 5'-TTCAGCTCTGGGATGACCTT-3', 扩增产物大小为258 bp. VEGF的引物上游: 5'-CTTGCTGCTCTACCTCCAC-3', 下游5'-ATGTCCACCAAGGTCTCG-3', 扩增产物大小为144 bp. TRIzol、RT-PCR试剂盒分别购自立陶苑Invortrigen和Fermentas MBI公司.
1.2.1 VX2肝肿瘤动物模型制作: 采用瘤组织悬液注射法: 切取VX2肿瘤种兔生长旺盛的肿块剪碎制成组织悬液备用. 将15只实验用兔以30 mL/L戊巴比妥钠按30 mg/kg经耳缘静脉注射麻醉后, 仰卧固定于自制手术台, 备皮局部消毒, 于剑突下1 cm略偏左作3-5 cm纵行切口, 逐层切开入腹. 暴露兔肝脏, 以无菌纱布牵引左叶至腹腔外, 以20 mL注射器针尖注入瘤组织悬液1 mL, 按压2 min待无血液渗出回纳肝脏, 依次缝合切口, 再次消毒, 每日2次肌注青霉素2×105 U共3 d预防感染.
1.2.2 分组及处理: 肿瘤种植10 d-2 wk内行超声检查, 待肿瘤直径达2.5±0.5 cm, 将荷瘤兔随机分为3组: 对照组(5只)直接处死取肝脏标本; RFA治疗两组(4、24 h各5只)麻醉后, 背部脱毛, 将射频电极插入肝脏肿瘤中心, 调节功率为55-60 W, 时间3-4 min, 形成直径约2 cm的消融区, 周边残留0.5-1.0 cm的肿瘤, 术后分别在4 h和24 h处死5只兔子取出肝脏标本. 另外再取5只正常兔肝脏以作为正常对照. 将所取标本部分常规中性甲醛固定24 h, 石蜡包埋, 4 μm切片, HE染色; 部分立即置于-80℃冰箱.
1.2.3 免疫组化法检测VEGF蛋白的表达: 免疫组化染色采用EnVision两部法: 石蜡切片于二甲苯中脱腊, 梯度酒精脱水; 30 mL/L的H2O2室温孵育10 min; 1:50的VEGF抗体室温孵育1 h; 1:50二抗室温孵育30 min; DAB显色, 苏木素复染, 树胶封片, 用PBS液代替一抗作为阴性对照, 以已知的阳性片作为阳性对照. 以镜下观察肿瘤细胞胞质内及胞膜出现棕黄色颗粒为VEGF表达阳性细胞, 免疫组化评分(immunohi-stochemical scores HIS)参照文献[2], 首先按染色强度评分: 无色为0分, 弱阳性为1分, 中度阳性为2分, 强阳性为3分; 然后按阳性细胞率评分: 肿瘤细胞内无阳性染色者为0分, 阳性细胞率≤10%为1分, 11%-50%为2分, 51%-80%为3分, >80%为4分. 将二者相乘得综合免疫组化评分: 0定为-, 1-4分为+, 5-8分为++, 9-12分为+++.
1.2.4 RT-PCR检测VEGF基因mRNA表达的变化: 按TRIzol试剂说明书提取总RNA, 紫外分光光度计测定其浓度和纯度, 逆转录成cDNA, PCR方法扩增目的基因VEGF及内参GAPDH. PCR反应条件: 94℃预变性3 min; 94℃变性40 s, 退火40 s(GAPDH退火温度为58℃、VEGF的退火温度56℃), 72℃延伸60 s, 34个循环; 72℃延伸7 min. 扩增产物以12 g/L琼脂糖凝胶电泳, 用凝胶成像分析仪进行摄像, 观察mRNA的表达.
统计学处理 数据以mean±SD表示, 用Stata 7.0软件进行秩和检验及t检验, P<0.05有统计学意义.
对照组肿瘤呈圆形, 体积较大时可为分叶状, 白色, 质韧, 无明显包膜, 切面呈鱼肉状, 部分病灶中心有液化性坏死呈奶酪样; 射频治疗后, 消融中心呈现灰白色的凝固性坏死, 周围见充血和出血带, 外围肝组织为暗红色.
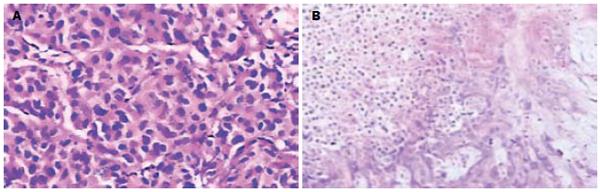
VX2肿瘤呈浸润性生长, 无包膜, 肿瘤细胞巢片状或假腺样分布, 排列紧密,紊乱, 细胞体积大, 形态不规则, 胞质嗜双色性, 核大小不一, 深染, 核染色质粗, 核仁明显. 消融治疗后镜下呈现3个区带, RFA中心区为大片不定形坏死组织; 周边见炎性反应带, 其内较多中性粒细胞、淋巴细胞以及红细胞聚集; 外围为残存的癌组织, 肿瘤细胞与对照组形态类似(图1).
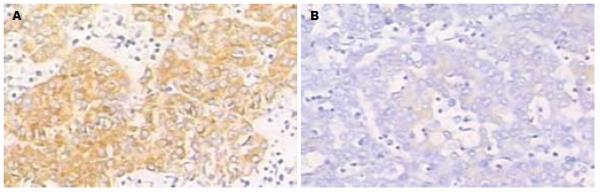
VEGF阳性细胞表现为胞质内及胞膜黄染. 正常组肝组织内VEGF低表达; 对照组肿瘤组织内VEGF呈现高表达, 尤以肿瘤边缘为主; RFA后, 中央坏死区无VEGF表达, 残存肿瘤内VEGF表达较对照组变低(图2, 表1).
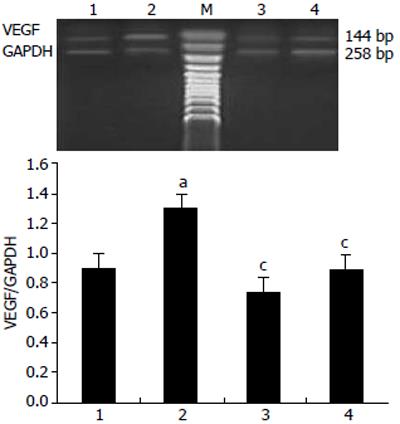
正常组VEGF mRNA较弱表达, 其灰度与GAPDH的比值为0.8993±0.1107; 对照组VEGF mRNA表达上调, 比值为1.3048±0.1936, 明显高于正常组, 差异有统计学意义(P<0.05); 射频术后VEGF mRNA表达均较对照组明显下调, 术后4 h比值为0.7388±0.1503, 术后24 h为0.8935±0.1936, 差异均有统计学意义(P<0.05, P<0.05); RFA术后4 h和24 h两组间VEGF mRNA表达差异无统计学意义(图3).
肿瘤的生长、浸润与转移依赖于肿瘤血管形成, 如果没有新生血管供应营养, 肿瘤在达到1-2 mm的直径后, 就无法进一步生长, 而步入凋亡阶段. 体内外实验已证实, 血管形成的增加继发于血管生成因子表达的增加, 从而促进肿瘤的生长和转移; 而下调血管生成因子表达, 则肿瘤新生血管减少, 继而降低肿瘤在原发灶和转移灶的生长[3]. 在目前所发现的30多种血管生长因子中, VEGF是最重要的血管新生促进因子[4]. VEGF大部分由肿瘤细胞产生并分泌[5], 与相应受体结合, 自身以二硫键形成二聚体后, 激活酪氨酸激酶, 使得受体发生磷酸化并活化其下游配体, 通过一系列信号转导机制发挥生物学效应. VEGF具有增加微血管通透性、促进内皮细胞有丝分裂及迁移, 促进血管生成, 降低癌细胞的同质黏附性, 在乏氧条件下通过上调Bcl-2的表达抑制肿瘤细胞凋亡[6], 介导肿瘤细胞增殖[7]等多种作用, 在多种肿瘤的生长、发展和转移过程中起重要作用[8], 与肿瘤的分级、预后等密切相关[9]. Raskopf et al[10]发现通过靶向VEGF的siRNA能降低肿瘤的微血管密度, 抑制肝癌的生长.
射频治疗肿瘤的根本机制是利用肿瘤的不耐热性, 以高温直接引起肿瘤细胞的凝固性坏死, 但亦可以介导肿瘤细胞凋亡[11], 破坏肿瘤微血管, 抑制血管新生[12-13], 从而破坏术后生长、复发、转移的条件, 但射频对于肿瘤血管生成分子生物学方面的影响目前尚无进一步的研究报道. 我们的实验以VX2肿瘤组织悬液成功制作移植肝癌模型, 此瘤体由肝动脉供血, 血供丰富, 生长迅速, 容易转移, 其生物学活性可以很好模拟原发性和转移性肝癌的情况[14]. 在实验中, 我们通过控制移植肿瘤的大小和RFA的范围, 使边缘的肿瘤组织残留, 继而对残存肿瘤细胞行免疫组化和半定量RT-PCR, 观察VEGF蛋白和mRNA的表达, 发现其表达明显低于对照组: 对照组的基因灰度比VEGF/GAPDH为1.3048±0.1936, 而RFA后4 h下降至0.7388±0.1503, 术后24 h为0.8935±0.1936(P<0.05). 至于残余肿瘤的VEGF蛋白表达明显下调的机制, 有人认为可能是RFA的热效应导致肿瘤细胞失活, 也可能是大量坏死组织诱导的免疫反应抑制了肿瘤VEGF的表达[15]. 我们有理由认为RFA还引起了VEGF基因表达的下调从而使得其蛋白合成相应减少, 继之影响了肿瘤的血管生成.
无论是手术切除还是包括射频在内的各种局部微创治疗, 其治疗效果与术后是否有肿瘤残留及残余肿瘤的血管新生情况密切相关, 大肝癌更是如此[16]. 目前为了彻底消除肿瘤, 临床上多将数种微创手段如TACE和RFA等序贯使用, 也确实收到较好疗效[17-18]. 尽管如此, 残余肿瘤的血管新生情况仍然值得进一步研究. 我们的研究显示: RFA不仅可以直接引起肿瘤组织的凝固性坏死和微血管的破坏, 还能下调坏死周边的残余肿瘤细胞VEGF的基因和蛋白表达, 抑制残余肿瘤的血管形成, 减少其血供, 从而有效的降低了复发和转移率. 但是RFA引起瘤组织破坏的同时, 亦可造成组织缺氧, 而缺氧恰恰能诱导VEGF的大量分泌[19], 因此RFA是否会在术后更长的时间段引起VEGF反馈性的增加, 有待于日后的深入研究.
射频消融作为肝癌治疗的一种新兴疗法, 在临床上应用日益广泛. 但是消融不完全和易复发仍然是临床医师倍感棘手的问题, 其中术后残存肿瘤的血管新生起着重要的作用, 并对射频治疗的预后有着重要的影响.
钱林学, 教授, 首都医科大学附属北京友谊医院内科
目前为了提高RFA治疗肝癌的疗效, 临床上多倾向于将数种微创手段序贯使用或者与化疗结合, 该举措确实收到较好的效果. 有文献报道RFA联合亚砷酸治疗可以减少肿瘤组织的MVD, 并抑制VEGF的表达.
射频术后肿瘤的血管新生情况与预后有着重要的关联. 有文献表明, 射频可以破坏肿瘤微血管, 抑制肿瘤VEGF表达, 减少肿瘤的血液供应, 从而降低术后转移复发的几率; 如与化疗联合应用则效果更佳. 但也有文献认为射频可以促进癌旁组织的VEGF表达, 值得进一步的研究.
本研究发现: 残存肿瘤的VEGF基因表达下调, 这可能是VEGF蛋白表达下降的内在原因. 该研究结果有助于深入了解射频治疗的分子机制, 为RFA治疗肝癌寻求进一步的依据.
本文内容较好, 设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Kim YS, Rhim H, Cho OK, Koh BH, Kim Y. Intrahepatic recurrence after percutaneous radiofrequency ablation of hepatocellular carcinoma: analysis of the pattern and risk factors. Eur J Radiol. 2006;59:432-441. [PubMed] [DOI] |
| 2. | Soslow RA, Dannenberg AJ, Rush D, Woerner BM, Khan KN, Masferrer J, Koki AT. COX-2 is expressed in human pulmonary, colonic, and mammary tumors. Cancer. 2000;89:2637-2645. [PubMed] [DOI] |
| 3. | Lee TK, Poon RT, Yuen AP, Ling MT, Wang XH, Wong YC, Guan XY, Man K, Tang ZY, Fan ST. Regulation of angiogenesis by Id-1 through hypoxia-inducible factor-1alpha-mediated vascular endothelial growth factor up-regulation in hepatocellular carcinoma. Clin Cancer Res. 2006;12:6910-6919. [PubMed] [DOI] |
| 4. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] [DOI] |
| 5. | Barr MP, Bouchier-Hayes DJ, Harmey JJ. Vascular endothelial growth factor is an autocrine survival factor for breast tumour cells under hypoxia. Int J Oncol. 2008;32:41-48. [PubMed] [DOI] |
| 6. | Wang D, Weng Q, Zhang L, He Q, Yang B. VEGF and Bcl-2 Interact Via MAPKs Signaling Pathway in the Response to Hypoxia in Neuroblastoma. Cell Mol Neurobiol. 2008; Dec 2. [Epub ahead of print]. |
| 7. | Liang Y, Brekken RA, Hyder SM. Vascular endothelial growth factor induces proliferation of breast cancer cells and inhibits the anti-proliferative activity of anti-hormones. Endocr Relat Cancer. 2006;13:905-919. [PubMed] [DOI] |
| 8. | Zhao J, Hu J, Cai J, Yang X, Yang Z. Vascular endothelial growth factor expression in serum of patients with hepatocellular carcinoma. Chin Med J (Engl). 2003;116:772-776. [PubMed] |
| 9. | Shariat SF, Anwuri VA, Lamb DJ, Shah NV, Wheeler TM, Slawin KM. Association of preoperative plasma levels of vascular endothelial growth factor and soluble vascular cell adhesion molecule-1 with lymph node status and biochemical progression after radical prostatectomy. J Clin Oncol. 2004;22:1655-1663. [PubMed] [DOI] |
| 10. | Raskopf E, Vogt A, Sauerbruch T, Schmitz V. siRNA targeting VEGF inhibits hepatocellular carcinoma growth and tumor angiogenesis in vivo. J Hepatol. 2008;49:977-984. [PubMed] [DOI] |
| 11. | Netto GJ, Altrabulsi B, Katabi N, Martin P, Burt K, Levy M, Sanchez E, Watkins DL, Jennings L, Klintmalm G. Radio-frequency ablation of hepatocellular carcinoma before liver transplantation: a histologic and 'TUNEL' study. Liver Int. 2006;26:746-751. [PubMed] [DOI] |
| 15. | 张 盟辉, 孔 宪炳, 王 巧玲, 阴 红卫, 轩 诗进. 射频消融联合亚砷酸局部治疗对兔肝VX2肿瘤MVD和VEGF表达的影响. 中国普外基础与临床杂志. 2007;14:19-22. |
| 16. | Murakami T, Ishimaru H, Sakamoto I, Uetani M, Matsuoka Y, Daikoku M, Honda S, Koshiishi T, Fujimoto T. Percutaneous radiofrequency ablation and transcatheter arterial chemoembolization for hypervascular hepatocellular carcinoma: rate and risk factors for local recurrence. Cardiovasc Intervent Radiol. 2007;30:696-704. [PubMed] [DOI] |
| 17. | Cheng BQ, Jia CQ, Liu CT, Fan W, Wang QL, Zhang ZL, Yi CH. Chemoembolization combined with radiofrequency ablation for patients with hepatocellular carcinoma larger than 3 cm: a randomized controlled trial. JAMA. 2008;299:1669-1677. [PubMed] [DOI] |
| 18. | Gao HJ, Liang HH, Chen MS, Peng ZW, Zhang YJ, Li P, Pang XH, Zhang YQ, Li JQ. [Effectiveness of radiofrequency ablation combined with transcatheter arterial chemoembolization for hepatocellular carcinoma]. Zhonghua Yixue Zazhi. 2008;88:2529-2532. [PubMed] |
| 19. | Hendriksen EM, Span PN, Schuuring J, Peters JP, Sweep FC, van der Kogel AJ, Bussink J. Angiogenesis, hypoxia and VEGF expression during tumour growth in a human xenograft tumour model. Microvasc Res. 2009;77:96-103. [PubMed] [DOI] |