修回日期: 2009-02-21
接受日期: 2009-02-23
在线出版日期: 2009-03-18
目的: 观察细胞外信号调节激酶(ERK)在肝纤维化组织中的表达变化及其与Ⅰ、Ⅲ型胶原表达的相关性, 并探讨其在肝纤维化发生中的作用.
方法: 二甲基亚硝胺(DMN)诱导大鼠肝纤维化, 于用药1、2、3 wk分别取肝组织; 收集临床肝手术标本, 包括纤维化肝组织和远癌的纤维化肝组织, 以正常肝组织做对照. 采用免疫组化法检测ERK在肝纤维化组织中表达和定位及其与Ⅰ、Ⅲ型胶原表达的相关性.
结果: 随着大鼠注射DMN时间的延长, ERK、Ⅰ、Ⅲ型胶原的表达逐渐增加, 且在各时间组肝组织中ERK的表达与Ⅰ、Ⅲ型胶原的表达呈正相关(1 wk: r = 0.75, 0.68, P<0.05; 2 wk: r = 0.82, 0.78, P<0.05; 3 wk: r = 0.74, 0.83, P<0.05). 同样, ERK在人肝纤维化组较对照组表达增加(1.068±0.258 vs 0.035±0.011, P<0.05), 且ERK的表达与Ⅰ、Ⅲ型胶原的表达正相关(r = 0.87, 0.88, 均P<0.05).
结论: ERK可能与肝纤维化的发生机制及胶原合成密切相关.
引文著录: 强晖, 徐红娟, 周国雄, 黄介飞, 黄华, 张弘. 细胞外信号调节激酶与胶原在肝纤维化过程中的表达及相关性. 世界华人消化杂志 2009; 17(8): 770-774
Revised: February 21, 2009
Accepted: February 23, 2009
Published online: March 18, 2009
AIM: To investigate the expression of ERK during the development of hepatic fibrosis and the correlation of ERK and I, III collagens.
METHODS: Hepatic fibrosis was induced by subcutaneous injection of DMN. Rats were killed for study at the end of first, second, third weeks and the clinical operative liver samples were collected. The development expression and location of the ERK in the hepatic tissue and the correlation of ERK with collagen I, III were assessed by means of immunohistochemistry.
RESULTS: The expression of ERK was increased and was closely correlated with that of collagen I and III during the development of rat fibrosis at every time point (1 wk: r = 0.75, 0.68, P < 0.05; 2 wk: r = 0.82, 0.78, P < 0.05; 3 wk: r = 0.74, 0.83, P < 0.05). Similarly, the expression of ERK was enhanced in human fibrotic tissues (1.068 ± 0.258 vs 0.035 ± 0.011, P < 0.05), which was correlated with that of collagen I and III (r = 0.87, 0.88, all P < 0.05).
CONCLUSION: The ERK signal pathway may play an important role in the pathogenesis of hepatic fibrosis.
- Citation: Qiang H, Xu HJ, Zhou GX, Huang JF, Huang H, Zhang H. Expression of extracellular signal-regulated kinase in hepatic fibrosis and its correlation with collagen type I and III. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 770-774
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/770.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.770
细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是丝裂原活化的蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路中的重要成员, 主要被生长因子、多肽类激素以及神经递质激活, 控制着细胞增殖、分化、生存和凋亡[1-2]. ERK在人肝纤维化组织中的表达研究国内外尚未见报道. 本实验旨在验证ERK分别在大鼠和人纤维化肝组织中的蛋白水平表达以及其与Ⅰ、Ⅲ型胶原表达的相关性, 探讨ERK信号通路在肝纤维化发生中的作用, 进一步阐明肝纤维化的发生机制, 为研究其他的MAPK信号通路相关基因以及肝纤维化的防治打下基础.
♂Sprague-Dawley(SD)大鼠36只, 体质量200-250 g, 清洁级, 购于中国科学院上海实验动物中心.
1.2.1 造模: 分为二甲基亚硝胺(DMN)造模组(n = 18)、对照组(n = 18), 将造模组皮下注射10 mg/kg体质量的DMN生理盐水溶液, 对照组皮下注射等体积生理盐水, 每周连续3 d, 共3 wk, 分别于DMN注射后的1、2、3 wk末取肝组织(处死大鼠时距末次注射的时间为72 h). 肝组织经100 g/L甲醛溶液固定, 石蜡包埋, 4-5 μm厚度连续切片后, 进一步行HE及VG染色明确病理改变.
1.2.2 组织标本收集: 收集2005-10/2006-10南通大学附属医院手术住院治疗的25例肝组织标本, 其中10例非纤维化肝组织(包括正常肝组织和炎症性肝组织), 15例纤维化肝组织(包括单纯肝纤维化和癌旁肝纤维化组织). 所有的病例均经组织病理证实.
1.2.3 免疫组化检测ERK与Ⅰ、Ⅲ型胶原在纤维化肝组织中的表达: 参照武汉博士德生物工程有限公司SABC试剂盒使用说明书. 一抗工作浓度: 兔抗大鼠ERK1/2抗体及磷酸化RK1/2抗体(美国Cell Signal 公司)1:500, 兔抗大鼠Ⅰ、Ⅲ 型胶原抗体(武汉博士德公司)1:200.
统计学处理 根据阳性染色范围, 将免疫组化切片用图象分析仪进行半定量分析, 每张切片随机扫描10个视野, 取其吸光度平均值. 使用SPSS10.0软件进行统计分析, P<0.05具有统计学意义.
造模组大鼠体质量明显下降, 并有死亡. 造模组1、2 wk末各处死6只, 3 wk末处死5只, 对照组大鼠各周均处死6只. 肝组织HE和VG染色显示模型组大鼠肝组织出现明显的肝细胞气球样变性、坏死及炎性细胞浸润; 随着DMN注射时间的延长, 逐渐出现汇管区扩大, 汇管区胶原纤维沉积, 纤维结缔组织增生明显并自汇管区呈放射状扩展, 向小叶周围延伸; 部分中央静脉区纤维结缔组织沉积增多.
HE染色显示正常肝组织结构规整, 可见肝细胞索围绕中央静脉呈放射状分布形成正常的肝小叶结构; 纤维化肝组织炎性细胞浸润, 汇管区扩大, 汇管区胶原纤维沉积, 并自汇管区呈放射状向小叶周围扩展、延伸.
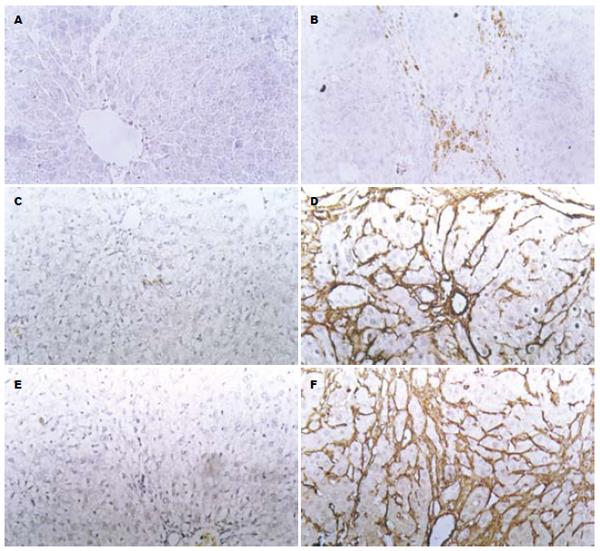
正常大鼠肝脏组织ERK染色弱阳性, 主要分布于肝血窦壁间质细胞中, 胞质和胞核内均有着色(图1A), 注射DMN 2 wk后ERK染色明显增强且以核内明显, 并分布在汇管区及纤维间隔中(图1B). 同样, 正常肝脏Ⅰ、Ⅲ 型胶原主要分布于汇管区(图1C, E), 注射DMN 1 wk时, Ⅰ、Ⅲ 型胶原进一步在肝血窦周围延伸, 阳性反应较前增强, 随着注射时间的延长, 在注射DMN 3 wk时Ⅰ、Ⅲ 型胶原的阳性反应明显增强, 并沿着细胞呈树枝状分布(图1D, F).
将免疫组化结果行半定量分析后发现, 随着DMN注射时间的延长, ERK、Ⅰ型、Ⅲ型胶原的表达逐渐增加, 且在各时间组ERK1与Ⅰ型、Ⅲ型胶原的相关均有显著性(P<0.05), 在第1周时与Ⅰ型、Ⅲ型胶原的相关系数分别为0.75、0.68; 第2周时与Ⅰ型、Ⅲ型胶原的相关系数分别为0.82、0.78; 第3周时与Ⅰ型、Ⅲ型胶原的相关系数分别为0.74、0.83(表1).
同样, 在人纤维化肝组织中, ERK的表达明显增加, Ⅰ、Ⅲ型胶原的表达也相应增加, 纤维化肝组织中ERK与Ⅰ、Ⅲ型胶原的相关系数分别为0.865、0.884, (P<0.05), 具有统计学意义(表2).
肝纤维化是各种致病因子反复损伤肝脏, 引起慢性肝病后共同的转归途径, 最终导致肝硬化, 成为严重威胁人类健康的常见病、多发病. 肝纤维化形成的基础是ECM(包括胶原、糖蛋白、多聚糖胺等)合成和降解的失衡[3-4]. 目前对肝硬化尚缺乏有效的治疗手段, 因此对肝纤维化的研究成了近20年世界医学攻关的一个热点. 但迄今为止肝纤维化发生的确切机制尚未明确, 阐明肝纤维化发生机制并寻求有效的治疗方法具有重要临床意义.
MAPK信号传导通路是经典的有丝分裂通路, 是真核细胞对许多不同刺激翻译和反应的信号介导和信号网络的枢纽, 控制着细胞增殖、分化、生存和凋亡, 是信号从细胞表面传导到细胞核内部的重要传递者, 他们介导胞质到胞核的信号传导[5-6]. 近期的研究表明, MAPK信号通路与人体多种脏器纤维化的发生密切相关[7-9]. 在哺乳动物细胞, MAPK家族的ERK亚族已得到比较详细的研究. ERK是有丝分裂信号通路的重要成员, 主要被生长因子等有丝分裂原激活, 并与细胞增生、分化有关. 细胞周期蛋白D1的转录需要ERK的长期激活和核滞留. ERK1/2为脯氨酸导向的丝氨酸/苏氨酸激酶. 他正常定位于胞质, 当激活后转位至胞核, 调节转录因子活性, 产生细胞效应. ERK1和ERK2有85%同源性, 其蛋白分子质量分别为43 kDa和41 kDa. ERK1和ERK2在各种组织中普遍表达, 可被一对蛋白激酶MEK1和MEK2磷酸化而活化, ERK的活化是几种Ras诱导的细胞反应中关键的一步, ERK1/2通过磷酸化转化为pERK1/2而发挥信号传导的生物学功能, 活化的ERK能转移入核, 磷酸化转录因子, 从而调节他们的活性[10-11].
目前认为, HSC的激活是肝纤维化发生的中心环节[12-13]. TGF-β、PDGF是激活HSC并促进其增殖的最重要细胞因子[14-15]. 在正常状态下, HSC主要储存和代谢维生素A, 合成与分泌少量的ECM及有一定产生胶原酶的能力. 在慢性肝损伤时, HSC活化后转化为成纤维样细胞, 并大量合成以胶原为主的细胞外基质积聚肝内[16-17]. Reimann et al[18]发现在大鼠原代培养的HSC中, TGF-β1可诱导Ras、Raf-1、MEK和ERK的活性, 并且ERK的活性依赖于MEK的活性. Davis et al[19]用原代培养的大鼠HSC阐明了Ras-Raf-1-MAPK级链在胶原基因表达中的作用, 阻断MAPK活性则胶原基因表达减少. IGF-1在炎性和纤维化的组织中表达增加, 并刺激成纤维细胞、平滑肌细胞和大鼠HSC增殖, 诱导 胶原合成. Svegliati-Baroni et al[20]发现IGF-1促进人HSC增殖及Ⅰ型胶原聚积时依赖于磷脂酰肌醇3激酶(PI3-K)和ERK. 最近, Jaster et al[21]研究认为ERK在胰腺星状细胞(类似HSC)激活中起核心作用, 抑制ERK信号传导可能成为防止胰腺星状细胞激活的重要途径. 然而ERK在肝纤维化中的确切功能仍未阐明, 他在人肝纤维化组织中的表达研究国内外尚未见报道.
本实验采用免疫组化法检测大鼠肝纤维化发展过程中ERK与Ⅰ、Ⅲ型胶原表达的动态变化, 并进一步临床研究15例人纤维化肝组织和10例非纤维化肝组织中ERK及Ⅰ、Ⅲ型胶原的表达, 结果提示纤维化肝组织中ERK及Ⅰ、Ⅲ型胶原的表达明显增加, 随着纤维化程度的加深, ERK表达量增加, 且与纤维化程度呈正相关. 我们的结果表明: ERK在正常和纤维化的肝组织中均有表达, 肝纤维化时, ERK的表达范围增大, 胞质和胞核内的表达增加且以核内为主, 提示肝纤维化时ERK不仅表达增多, 而且被激活并向核内转移. 由此可以推测, ERK及其介导的信号通路是通过促进HSC的活化与增殖进而参与肝纤维化的发生发展过程. MAPK信号通路与肝纤维化的发生有着密切的关系, 随着对MAPK信号通路理解的不断深入, 其在肝纤维化发生的分子机制中的作用会越来越多地引起人们的关注.
肝纤维化是慢性肝病共有的、重要的病理特征, 也是进一步向肝硬化发展的主要中间环节, 属可逆性病变. 目前对肝硬化无有效的治疗手段, 因此阐明肝纤维化发生机制具有重要的临床意义.
陈红松, 研究员, 北京大学人民医院肝病研究所; 高润平, 教授, 吉林大学第一医院肝病科
ERK可能参与肝纤维化发病机制, 但其在肝纤维化过程中的确切机制仍未明了.
MAPK信号传导通路是经典的有丝分裂通路, 有研究表明, ERK在胰腺星状细胞(类似HSC)激活中起核心作用, 抑制ERK信号传导可能成为防止胰腺星状细胞激活的重要途径. 还有报道IGF-1促进人HSC增殖及Ⅰ型胶原聚积时依赖于磷脂酰肌醇3激酶(PI3-K)和ERK, 因此ERK可能参与肝纤维化发病机制.
ERK是有丝分裂信号通路的重要成员, 主要被生长因子等有丝分裂原激活, 并与细胞增生、分化有关. 本研究首次应用免疫组化技术研究ERK在人肝纤维化组织中表达, 为进一步研究MAPK信号传导通路相关基因在肝纤维化中的作用打下基础.
本研究有助于进一步阐明肝纤维化发病机制和MAPK通路相关基因的初步功能, 为预防、诊断和治疗肝纤维化提供新的有效靶点.
本文新颖性强, 设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Li C, Scott DA, Hatch E, Tian X, Mansour SL. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 2007;134:167-176. [PubMed] [DOI] |
| 2. | Yuantai W, Tiancai W, Qiu Z. PD98059 inhibits expression of pERK1 protein and collagen alpha1(I) mRNA in rat pancreatic stellate cells activated by platelet-derived growth factor. Indian J Gastroenterol. 2005;24:100-103. [PubMed] |
| 3. | Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis. 2007;27:413-426. [PubMed] [DOI] |
| 4. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 5. | Hirosawa M, Nakahara M, Otosaka R, Imoto A, Okazaki T, Takahashi S. The p38 pathway inhibitor SB202190 activates MEK/MAPK to stimulate the growth of leukemia cells. Leuk Res. 2009;33:693-699. [PubMed] |
| 6. | Brown MD, Sacks DB. Protein scaffolds in MAP kinase signalling. Cell Signal. 2009;21:462-469. [PubMed] [DOI] |
| 7. | Chopra P, Kanoje V, Semwal A, Ray A. Therapeutic potential of inhaled p38 mitogen-activated protein kinase inhibitors for inflammatory pulmonary diseases. Expert Opin Investig Drugs. 2008;17:1411-1425. [PubMed] [DOI] |
| 8. | Schwer CI, Guerrero AM, Humar M, Roesslein M, Goebel U, Stoll P, Geiger KK, Pannen BH, Hoetzel A, Schmidt R. Heme oxygenase-1 inhibits the proliferation of pancreatic stellate cells by repression of the extracellular signal-regulated kinase1/2 pathway. J Pharmacol Exp Ther. 2008;327:863-871. [PubMed] [DOI] |
| 9. | Qiang H, Lin Y, Zhang X, Zeng X, Shi J, Chen YX, Yang MF, Han ZG, Xie WF. Differential expression genes analyzed by cDNA array in the regulation of rat hepatic fibrogenesis. Liver Int. 2006;26:1126-1137. [PubMed] [DOI] |
| 10. | Shatos MA, Gu J, Hodges RR, Lashkari K, Dartt DA. ERK/p44p42 mitogen-activated protein kinase mediates EGF-stimulated proliferation of conjunctival goblet cells in culture. Invest Ophthalmol Vis Sci. 2008;49:3351-3359. [PubMed] [DOI] |
| 11. | Kohda Y, Matsunaga Y, Shiota R, Satoh T, Kishi Y, Kawai Y, Gemba M. Involvement of Raf-1/MEK/ERK1/2 signaling pathway in zinc-induced injury in rat renal cortical slices. J Toxicol Sci. 2006;31:207-217. [PubMed] [DOI] |
| 12. | Sarem M, Znaidak R, Macías M, Rey R. [Hepatic stellate cells: it's role in normal and pathological conditions]. Gastroenterol Hepatol. 2006;29:93-101. [PubMed] [DOI] |
| 13. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 14. | Shi YF, Zhang Q, Cheung PY, Shi L, Fong CC, Zhang Y, Tzang CH, Chan BP, Fong WF, Chun J. Effects of rhDecorin on TGF-beta1 induced human hepatic stellate cells LX-2 activation. Biochim Biophys Acta. 2006;1760:1587-1595. [PubMed] [DOI] |
| 15. | Gonzalo T, Beljaars L, van de Bovenkamp M, Temming K, van Loenen AM, Reker-Smit C, Meijer DK, Lacombe M, Opdam F, Kéri G. Local inhibition of liver fibrosis by specific delivery of a platelet-derived growth factor kinase inhibitor to hepatic stellate cells. J Pharmacol Exp Ther. 2007;321:856-865. [PubMed] [DOI] |
| 16. | Priya S, Sudhakaran PR. Cell survival, activation and apoptosis of hepatic stellate cells: modulation by extracellular matrix proteins. Hepatol Res. 2008;38:1221-1232. [PubMed] [DOI] |
| 17. | Yuhua Z, Wanhua R, Chenggang S, Jun S, Yanjun W, Chunqing Z. Disruption of connective tissue growth factor by short hairpin RNA inhibits collagen synthesis and extracellular matrix secretion in hepatic stellate cells. Liver Int. 2008;28:632-639. [PubMed] [DOI] |
| 18. | Reimann T, Hempel U, Krautwald S, Axmann A, Scheibe R, Seidel D, Wenzel KW. Transforming growth factor-beta1 induces activation of Ras, Raf-1, MEK and MAPK in rat hepatic stellate cells. FEBS Lett. 1997;403:57-60. [PubMed] [DOI] |
| 19. | Davis BH, Chen A, Beno DW. Raf and mitogen-activated protein kinase regulate stellate cell collagen gene expression. J Biol Chem. 1996;271:11039-11042. [PubMed] [DOI] |
| 20. | Svegliati-Baroni G, Ridolfi F, Di Sario A, Saccomanno S, Bendia E, Benedetti A, Greenwel P. Intracellular signaling pathways involved in acetaldehyde-induced collagen and fibronectin gene expression in human hepatic stellate cells. Hepatology. 2001;33:1130-1140. [PubMed] [DOI] |