修回日期: 2009-02-12
接受日期: 2009-02-16
在线出版日期: 2009-03-08
目的: 探讨PPARγ激动剂吡咯列酮对重症急性胰腺炎大鼠肺组织ICAM-1表达的影响及其意义.
方法: 将54只健康雄性SD大鼠随机分为假手术组(A组)、SAP组(B组)、吡格列酮治疗组(C组), n = 18, 制作SAP模型, 通过免疫组织化学方法动态观察3组大鼠肺组织中ICAM-1的表达, 同时观察肺组织病理及髓过氧化物酶(MPO)的改变.
结果: A组大鼠肺组织出现明显的充血水肿和中性粒细胞增多, 而T组肺部炎症反应明显减轻. T组肺组织MPO明显低于A组(6 h: 5.12±0.71 vs 6.03±0.63, P<0.05; 12 h: 5.20±0.66 vs 8.05±0.62, P<0.01). 从造模3 h起, A组大鼠肺部ICAM-1即持续上调, 呈时间依赖性, 3, 6, 12 h表达分别为0.82±0.23, 1.03±0.31, 1.40±0.58, 12 h与3 h比较差异有统计学意义(P<0.05); T组ICAM-1在3, 6, 12 h表达分别为0.62±0.18, 0.75±0.27, 0.78±0.31, 12 h明显低于A组(P<0.05); C组呈弱阳性表达, 并随时间推移而消失.
结论: SAP合并肺损伤时, 肺组织中ICAM-1过度表达, 中性粒细胞大量浸润, 吡格列酮对其的表达有抑制作用.
引文著录: 谢俊锋, 刘志坚, 白爱平, 姜景平, 范海青, 陈江, 谢勇, 徐萍. 吡咯列酮对重症急性胰腺炎大鼠肺组织中ICAM-1表达的影响. 世界华人消化杂志 2009; 17(7): 667-671
Revised: February 12, 2009
Accepted: February 16, 2009
Published online: March 8, 2009
AIM: To investigate the expression changes of pulmonary intercellular adhesion molecule-1 (ICAM-1) after pioglitazone treatment in rats with severe acute pancreatitis (SAP).
METHODS: A total of 54 Sprague Dawley rats were randomly and divided into 3 groups, named group A, C and T (n = 18). Group A and C served as SAP model group and sham operation group, respectively. Rats in group T were treated with pioglitazone, an agonist of peroxisome proliferator activated receptor. The modified Li Qing-hua's method was used to reproduce SAP models. Histopathological changes of pulmonary tissues were examined by microscopy. The activity of myeloperoxidase (MPO) in pulmonary tissues was measured. The expression of pulmonary ICAM-1 was determined by immunohistochemical staining (ABC).
RESULTS: The histological examination revealed intensive inflammatory response in pulmonary tissues after SAP model was induced, but inflammatory response was significantly alleviated in group T. The activity of MPO (6 h: 5.12 ± 0.71 vs 6.03 ± 0.63, P < 0.05; 12 h: 5.20 ± 0.66 vs 8.05 ± 0.62, P < 0.01) in the lung tissues were significantly decreased. After modeling, the expression of ICAM-1 was persistently increased from the 3rd hour on. In group A, the expression of ICAM-1 was 0.82 ± 0.23, 1.03 ± 0.31 and 1.40 ± 0.58 at the 3rd, 6th, and 12th hour, respectively, and there was significant difference between those at the 12th and 3rd hour (P < 0.05). In group T, ICAM-1 expression was 0.62 ± 0.18, 0.75 ± 0.27 and 0.78 ± 0.31 at the 3rd, 6th, and 12th hour, respectively, and there was marked difference at the 12th hour between group A and group T (P < 0.05). ICAM-1 expression was weakly positive in group C, and faded away as time went by.
CONCLUSION: The severity of pancreatitis and degree of lung injury could be predicted by detection of ICAM-1 expression and pioglitazone inhibits the expression of ICAM-1 in SAP.
- Citation: Xie JF, Liu ZJ, Bai AP, Jiang JP, Fan HQ, Chen J, Xie Y, Xu P. Effect of pioglitazone on expression of intercellular adhesion molecule-1 in pulmonary tissues of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 667-671
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/667.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.667
重症急性胰腺炎相关性肺损伤(acute pancreatitis-associated lung injury, APALI)是重症急性胰腺炎(severe acute pancreatitis, SAP)早期最常见、最严重的并发症, 临床症状从较轻的低氧血症到成人呼吸窘迫综合征(adult respiratory distress syndrome, ARDS)均可出现. 1 wk内死亡的AP患者大约60%伴有肺损伤或ARDS. 目前治疗尚无良策. 我们的前期实验证实, 吡格列酮对重症急性胰腺炎具有防治作用, 本实验旨在探讨AP早期肺损伤的发生机制, 并观察吡格列酮对其的影响.
健康♂SD大鼠(由南昌大学医学院动科部提供)54只, 体质量160-200 g, 盐酸吡格列酮(成都宇洋高科技发展公司), 牛磺胆酸钠购自Sigma公司, 细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)由北京中杉金桥生物技术有限公司提供, MPO试剂盒购自南京建成生物研究所.
1.2.1 SAP模型建立和分组: 应用编号法随机分成SAP组(A组)、假手术组(C组)和吡格列酮治疗组(T组), 每组18只. 采用李清华的方法制作SAP模型[1]: 实验前大鼠禁食12 h、自由饮水, 术前2 h腹腔注射无菌处理的10% DMSO溶液(1 mL/100 g), A组采用盐酸氯胺酮腹腔注射麻醉开腹, 逆行胰胆管内加压注射5%牛磺胆酸钠溶液(1 mL/kg). C组手术方式同A组, 但开腹后不注射5%牛磺胆酸钠溶液, 仅翻动胰腺并以钝器轻划胰腺3次. T组制模方法同A组, 但以DMSO-吡格列酮(50 mg/kg)代替10% DMSO于术后立即腹腔内注射.
1.2.2 取材与检测: 各组大鼠于术后3、6、12 h分批麻醉后腹主动脉放血法处死, 分别取各时段肺组织标本. 取左下肺组织以中性甲醛固定, 部分肺组织用-80℃液氮冻存. 肺组织经固定、包埋、常规HE染色制片, 依据雷文章 et al[2]标准进行评分. 肺组织ICAM-1表达检测如下: 切片常规脱蜡至水, 微波修复抗原, 过氧化氢阻断内源性过氧化物酶, PBS冲洗, 加兔抗ICAM-1(1∶50), 湿盒内4℃冰箱过夜, 加非生物素化的二抗, 37℃孵育20 min, PBS冲洗, DAB显色, 苏木素复染、中性树胶封片. PBS代替一抗为阴性对照. 胞膜或胞质呈棕黄色为阳性. 阳性积分计算方法[3]: 随机观察3个高倍视野, 分别计算阳性细胞数N1、总细胞数N; 同时进行阳性细胞着色强度(F)判断: 浅黄色为1分, 黄色为2分, 棕黄色为3分, 最终的阳性积分 = N1/N×F. MPO参照说明书进行.
统计学处理 数据采用mean±SD表示, 采用SPSS13.0软件包进行统计学分析, 各组间比较采用单因素方差分析, 不同指标间的相关性用两个变量相关分析, 以P<0.05为差异有统计学意义.
假手术组大鼠肺组织中肺间质有轻度水肿, 可能与应激有关, 随时间延长, 肺损伤逐渐减轻. A组大鼠肺组织损伤严重, 术后3 h肺组织损伤主要表现为肺泡间隔水肿、增宽, 少量炎症细胞浸润, 随时间延长, 肺组织损害更加明显, 可出现肺泡腔内有渗出物及肺泡腔塌陷等病理改变, 综合评分以12 h改变最明显. T组镜下表现与A组大体相似, 亦呈现出不同程度的肺损伤, 但与A组同时间段相比病变程度轻, 并随时间的延长而逐渐减轻. T组病理评分与A组同时段比较, 术后3 h差异无统计学意义(P>0.05), 术后6 h差异有统计学意义(P<0.05), 术后12 h差异有显著性(P<0.01). C组与A、T组同时段相比差异均有显著性(P<0.01, 表1).
A组肺组织MPO 12 h与3 h、6 h比较差异均有显著性(P<0.01); T组肺组织MPO 6、12与3 h比较差异均有显著性(P<0.01); 与C组相比, A组术后3 h差异有统计学意义(P<0.05), 术后6 h、12 h差异均有显著性(P<0.01); 与C组相比, T组术后6、12 h差异均有显著性(P<0.01); T组与A组相比, 6 h差异有统计学意义(P<0.05), 12 h差异有显著性(P<0.01, 表1).
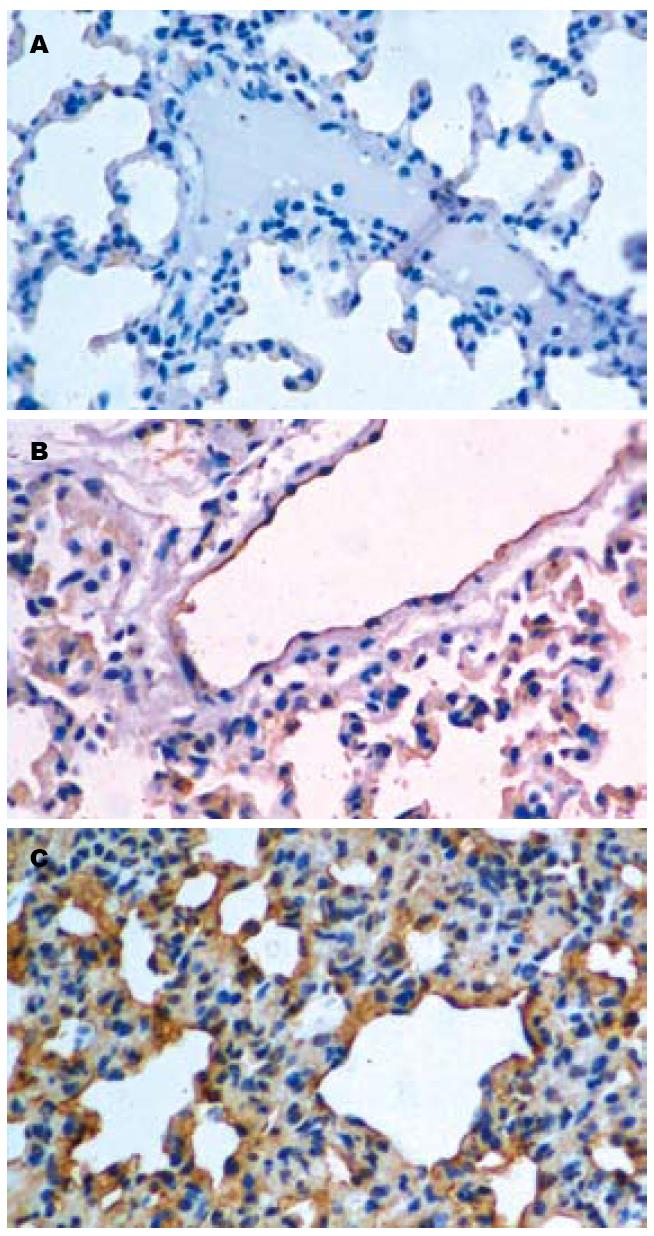
阳性染色定位于肺组织血管内皮细胞、细支气管及肺泡上皮细胞的胞膜、胞质(图1). C组仅有少量弱阳性表达位于肺组织血管和细支气管上皮细胞. 随时间延长阳性染色消失; 术后3 h, A组ICAM-1在血管内皮细胞、肺泡上皮细胞和细支气管上皮细胞的胞膜及胞质有较强表达, 此后表达持续增强, 12 h与3 h比较差异有统计学意义(P<0.05); T组各时段均见阳性染色, 但较同时段A组弱, 不同时段之间差异无统计学意义(P>0.05); A组与C组同时段相比差异均有显著性(P<0.01); T组与C组同时段相比, 在3 h、6 h组差异有显著性(P<0.01), 12 h差异有统计学意义(P<0.05); A组与T组比较, 术后12 h差异有统计学意义(P<0.05, 表2).
T组和A组肺组织ICAM-1及MPO与肺组织病理学评分均明显正相关(P<0.01).
噻唑烷二酮类化合物是PPARγ合成激动剂, 包括吡格列酮、环格列酮、曲格列酮、罗格列酮等, 临床上主要用于2型糖尿病的治疗. 近年来的研究显示, 此类药物具有广泛的抗炎特性. 但迄今为止尚未发现炎症因子基因的顺式作用元件中具有PPARγ结合区域, 由此看来PPARγ对炎症因子的转录抑制可能是间接效应. PPARγ配体的抗炎机制仍有待进一步研究.
在我们的前期研究中发现[4], 吡格列酮可以通过PPARγ、NF-κB等两条途径, 调节炎症因子的表达, 如促炎因子IL-6、TNF-α表达受抑, 而抗炎因子IL-10表达增强. 另外, Wan et al[5]在胰腺炎的体外研究中发现, 吡格列酮可通过抑制IKK活性, 减少Iκβα的磷酸化及降解, 进而减少P65的表达, 同时, 胰腺内PPARγ表达上升, 而PPARγ拮抗剂GW9662几乎可以完全阻断吡格列酮的这种作用, 从而认为, 吡格列酮是通过PPARγ受体依赖途径来减轻胰腺炎的炎症反应.
APALI是重症急性胰腺炎早期严重并发症之一. PPARγ激动剂在肺损伤中亦起抗炎作用, 但相关研究主要集中在缺血-再灌注或内毒素引起的肺损伤. Ito et al[6]在缺血-再灌注大鼠模型研究结果表明, 吡格列酮可通过抑制TNF-α、CINC-1等炎症因子的产生, 减少中性粒细胞在肺内聚集及脂质过氧化作用, 从而达到保护作用. 然而PPARγ激动剂对急性胰腺炎引起的肺损伤研究甚少. 本实验首次研究了用吡格列酮对APALI的影响.
研究表明[7], 中性粒细胞在APALI的发展过程中起着关键作用. 在胰腺炎发展中, 中性粒细胞过度被激活, 通过血液循环到达肺脏后, 再由血管内游入肺组织, 产生一系列炎症介质(如: 活化氧、弹力蛋白酶等), 直接或间接导致肺脏损伤. MPO存在于中性粒细胞的嗜天青颗粒中, 约占细胞干质量的5%, MPO活性的高低可以反映组织中的中性粒细胞聚集程度. 本研究结果显示, 造模3 h后, A组肺组织中MPO即显著升高, 而T组能明显抑制MPO活性, 减少中性粒细胞在肺部的聚集, 从而减轻肺损伤的严重程度.
在中性粒细胞发挥炎症效应时, 中性粒细胞与血管内皮细胞之间的黏附是中性粒细胞到达肺组织的重要条件. 细胞间黏附是一个复杂的过程, 需要多种细胞表面黏附分子的参与, 而PMN表面的整合素CD11b/CD18β2复合体与血管内皮细胞表面的ICAM-1以受体-配体的形式相结合是细胞黏附过程中的关键环节. 研究表明, AP鼠的胰腺、肺脏有大量PMN浸润, 而敲除ICAM-1基因或应用抗ICAM-1抗体后, AP鼠胰腺、肺脏中PMN积聚数目明显减少, 微血管通透性降低, 组织损伤也明显减轻[8-11]. 本实验结果表明, C组肺组织中ICAM-1少量表达于血管内皮细胞胞膜上; A组肺组织中ICAM-1呈高表达, 并随时间推移而表达增强; 与A组同时间段相比, T组ICAM-1表达明显下降. 此结果表明, 吡格列酮可降低ICAM-1的表达, 进而减轻APALI的严重程度.
APALI发生、发展的许多中间环节尚未完全阐明, 尤其是炎症从胰腺局部到远端脏器的扩散机制, 值得我们进一步研究和探索. 我们的研究表明, 在APALI的发病过程中, 中性粒细胞被过度激活, 在肺部聚集. 而吡格列酮可以降低血管内皮细胞ICAM-1的表达, 抑制中性粒细胞的游出及肺内聚集, 从而达到减轻肺脏损伤程度. 表明PPARγ激动剂有可能成为一种治疗SAP肺损伤的有效手段.
SAP患者常并发全身多器官功能衰竭, 成为SAP的主要死亡原因, 其中, 尤以APALI最为突出. SAP时大量中性粒细胞(PMN)聚集于肺组织是APALI早期的基本病理改变, 也是导致APALI的重要因素. ICAM-1促使白细胞的游走、聚集. PPARγ途径在动物模型及体外实验中均具有抑制单核/巨噬细胞系统活化, 减少炎症细胞积聚和炎症因子的释放, 从而发挥抗炎症作用.
李国威, 教授, 西安交通大学医学院第二医院普通外科
PPARγ与多种细胞因子、黏附分子基因的转录和表达关系密切, 并借此影响急、慢性炎症的发生、发展.
Ito et al在缺血-再灌注大鼠模型研究结果表明, 吡格列酮可通过抑制TNF-α、CINC-1等炎症因子的产生, 减少中性粒细胞在肺内聚集及脂质过氧化作用, 从而达到保护作用.
噻唑烷二酮类化合物具有广泛的抗炎特性. 目前, 国内外对PPARγ激动剂与肺损伤的研究主要集中在缺血-再灌注或内毒素引起的肺损伤. PPARγ激动剂对急性胰腺炎引起的肺损伤研究甚少. 本实验首次研究了吡格列酮对APALI的影响.
ICAM-1(细胞间黏附分子-1): 又称CD54, 是一条单链跨膜糖蛋白, 是最早发现的免疫球蛋白超家族黏附分子之一.
本课题具有新颖性, 对防止急性胰腺炎的肺损伤及导致的多脏器衰竭具有重要的理论参考价值, 是一篇优秀的论文.
编辑: 李军亮 电编:吴鹏朕
| 3. | Sasaki H, Nio M, Iwami D, Funaki N, Sano N, Ohi R, Sasano H. E-cadherin, alpha-catenin and beta-catenin in biliary atresia: correlation with apoptosis and cell cycle. Pathol Int. 2001;51:923-932. [PubMed] [DOI] |
| 4. | Xu P, Zhou XJ, Chen LQ, Chen J, Xie Y, Lv LH, Hou XH. Pioglitazone attenuates the severity of sodium taurocholate- induced severe acute pancreatitis. World J Gastroenterol. 2007;13:1983-1988. [PubMed] |
| 5. | Wan H, Yuan Y, Qian A, Sun Y, Qiao M. Pioglitazone, a PPARgamma ligand, suppresses NFkappaB activation through inhibition of IkappaB kinase activation in cerulein-treated AR42J cells. Biomed Pharmacother. 2008;62:466-472. [PubMed] [DOI] |
| 6. | Ito K, Shimada J, Kato D, Toda S, Takagi T, Naito Y, Yoshikawa T, Kitamura N. Protective effects of preischemic treatment with pioglitazone, a peroxisome proliferator-activated receptor-gamma ligand, on lung ischemia-reperfusion injury in rats. Eur J Cardiothorac Surg. 2004;25:530-536. [PubMed] [DOI] |
| 7. | de Campos T, Deree J, Martins JO, Loomis WH, Shenvi E, Putnam JG, Coimbra R. Pentoxifylline attenuates pulmonary inflammation and neutrophil activation in experimental acute pancreatitis. Pancreas. 2008;37:42-49. [PubMed] [DOI] |
| 8. | Frossard JL, Saluja A, Bhagat L, Lee HS, Bhatia M, Hofbauer B, Steer ML. The role of intercellular adhesion molecule 1 and neutrophils in acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 1999;116:694-701. [PubMed] [DOI] |
| 9. | Lundberg AH, Fukatsu K, Gaber L, Callicutt S, Kotb M, Wilcox H, Kudsk K, Gaber AO. Blocking pulmonary ICAM-1 expression ameliorates lung injury in established diet-induced pancreatitis. Ann Surg. 2001;233:213-220. [PubMed] [DOI] |
| 10. | Zaninovic V, Gukovskaya AS, Gukovsky I, Mouria M, Pandol SJ. Cerulein upregulates ICAM-1 in pancreatic acinar cells, which mediates neutrophil adhesion to these cells. Am J Physiol Gastrointest Liver Physiol. 2000;279:G666-G676. [PubMed] |