修回日期: 2009-01-14
接受日期: 2009-02-09
在线出版日期: 2009-03-08
目的: 探讨梗阻性黄疸(obstructive jaundice, OJ)时NF-κB的变化及其对免疫应答的影响.
方法: 60只Wistar♂大鼠随机分成3组: 假手术组(SHAM组)、梗阻性黄疸组(CBDL组)和梗阻性黄疸+NF-κB抑制剂脯氨酸二硫化氨基甲酸酯(PDTC)组(PDTC组). 每组术后7、14 d分批(n = 10)检测光镜下肝脏病理组织学, 血清总胆红素(TB), 谷丙转氨酶(ALT), 内毒素(LPS)水平, 肝组织促炎因子IL-1β、IL-6, 抑炎因子IL-10以及NF-κB蛋白表达.
结果: CBDL组7、14 d大鼠均出现肝组织病理损伤, CBDL组较SHAM组血清TB、ALT、LPS增高(7 d: 140.14±10.17 vs 7.309±1.04, 134.479±10.20 vs 35.79±3.76, 189.33±11.05 vs 2.816±0.58; 14 d: 194.608±12.73 vs 36.142±3.51, 217.797±12.37 vs 7.321±1.03, 292.816±14.53 vs 2.664±0.53, 均P<0.01), 肝组织IL-1β, IL-6, IL-10和NF-κB表达增强(均P<0.01), 且14 d较7 d变化更为显著. PDTC组大鼠血清TB、ALT和肝组织IL-1β、IL-6、NF-κB表达在7 d时相点时比CBDL组显著下降(P<0.01), 而到14 d时相点时比较CBDL组无明显变化; LPS和IL-10表达与CBDL组各时相点相比无明显差异.
结论: 梗阻性黄疸大鼠早期(7 d)通过PDTC抑制NF-κB活化表达, 可下调促炎因子的表达, 减轻肝损. 后期(14 d)作用不明显, 其机制可能是通过LPS、IL-10等其他途径所致.
引文著录: 成小林, 时开网, 徐锦, 李伟. 梗阻性黄疸大鼠NF-κB的变化及其对免疫应答的影响. 世界华人消化杂志 2009; 17(7): 662-666
Revised: January 14, 2009
Accepted: February 9, 2009
Published online: March 8, 2009
AIM: To investigate the variation of NF-κB and its effect on immune response in rats with obstructive jaundice (OJ).
METHODS: Sixty male Wistar rats were randomized into 3 groups, that is, sham operation group, common bile duct ligation (CBDL) group, and CBDL+PDCT group. Liver histopathology, levels of serum TB, ALT and LPS, liver IL-1β, IL-6, IL-10 and NF-κB were detected at 7 d and 14 d after operation respectively in each group (n = 10).
RESULTS: In CBDL group, all rats were injured with the liver histological damage, in which the level of serum TB, ALT, LPS were all increased as compared with those in SHAM group 7 d and 14 d post-operation (7 d: 140.14 ± 10.17 vs 7.309 ± 1.04, 134.479 ± 10.20 vs 35.79 ± 3.76, 189.33 ± 11.05 vs 2.816 ± 0.58; 14 d: 194.608 ± 12.73 vs 36.142 ± 3.51, 217.797 ± 12.37 vs 7.321 ± 1.03, 292.816 ± 14.53 vs 2.664 ± 0.53, all P < 0.01), besides, expressions of IL-1β, IL-6, IL-10 and NF-κB in liver were increased at day 7 (P < 0.01) and even more significant at day 14 (P < 0.01). After PDTC administration, compared with those in CBDL group, the level of serum TB, ALT as well as the expressions of IL-1β, IL-6 and NF-κB in liver were all significantly decreased at 7 d (P < 0.01), while at 14 d there was no significant difference. However, after PDTC administration, compared with those in CBDL group, there was no significant difference for the level of LPS and IL-10 at both 7 d or 14 d.
CONCLUSION: In the early days (7 d), PDTC does play a protective role in OJ by down-regulating the activation of NF-κB and down-regulating IL-1β and IL-6, so as to alleviate the injuries of liver tissues. While in the late days (14 d), PDTC has no significant effect, which may be caused by LPS, IL-10 and other functional channels.
- Citation: Cheng XL, Shi KW, Xu J, Li W. Variation of NF-κB and its effect on immune response in rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 662-666
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/662.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.662
梗阻性黄疸(obstructive jaundice, OJ)是外科常见的临床表现, 围手术期发生的感染、肝衰竭、多器官功能不全综合征(multiple organ dyfunction syndrome, MODS)等并发症和高死亡率与术前机体的免疫功能受抑有密切关系[1]. NF-κB是一种广泛存在于体内细胞的核转录因子, 通过对多种免疫相关因子的调节, 调控机体正常免疫功能, 可导致梗阻性黄疸时肝脏炎性损伤以及继发的机体免疫功能改变[2]. 本实验检测OJ时肝脏病理组织学, 血清总胆红素(total bilirubin, TB)、谷丙转氨酶(ALT)和内毒素(lipopolysaccharides, LPS)的水平, 肝组织促炎细胞因子IL-1β、IL-6, 抗炎细胞因子IL-10和NF-κB蛋白的表达, 同时应用PDTC抑制NF-κB的活化后, 再次检测上述指标的变化, 来探讨NF-κB在OJ大鼠不同时期对机体免疫应答、肝损伤的影响机制, 为进一步研究干预治疗早期梗阻性黄疸时机体的免疫力降低、肝损伤提供新的理论依据和实践经验.
健康清洁级,♂, Wistar大鼠60只, 体质量220-230 g, 购于中科院上海实验动物中心. 吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate, PDTC)购于Sigma公司. IL-1β, IL-6, IL-10细胞因子ELISA试剂盒购于美国R&B公司. 蛋白抽提试剂盒购于Active Motiff公司, BCA蛋白定量试剂盒和EMSA(电泳迁移率变迁检测)试剂盒购于Pierce公司. Olympus AU7200全自动生化仪, 北京金山川公司MB-80内毒素定量测定系统.
1.2.1 分组及造模: 大鼠随机分成3组, 假手术组(SHAM组), 梗阻性黄疸组(CBDL组), 梗阻性黄疸+PDTC组(PDTC组), 每组10只大鼠. 氯胺酮(50 mg/kg)麻醉, SHAM组取上腹正中切口约2-3 mm, 解剖肝蒂, 仅游离胆总管, 不予结扎. CBDL、PDTC组在距肝门5 mm处用4-0丝线双道结扎胆总管, 逐层关腹, 操作严格无菌. PDTC组在术前24 h ip 100 g/L PDTC (75 mg/kg, Sigma), 术后每天给予100 g/L PDTC ip(50 mg/kg), 直至处死. SHAM组和CBDL组则同期ip等量生理盐水. 各组分别于术后7、14 d分批(n = 10)下腔静脉采血, 制备血清, 取出肝组织, 部分置于40 g/L多聚甲醛溶液固定, 部分置液氮保存, 最后将大鼠处死.
1.2.2 肝脏组织病理学检查: 取40 g/L多聚甲醛液固定的肝组织, 常规脱水, 石蜡包埋, 切片. 切片HE染色, 观察肝组织病理变化.
1.2.3 血清生化指标测定: TB和ALT用Olympus AU7200全自动生化仪检测; LPS由北京金山川公司MB-80微生物快速动态检测系统检测, 取下腔静脉血6 mL, 3000 r/min离心15 min后, 取血浆进行测定(鲎试剂偶氮基质显色法).
1.2.4 肝组织匀浆的制备及其IL-1β, IL-6, IL-10细胞因子含量测定: 取100 mg肝组织, 内切式匀浆机冰上匀浆后, 以3000 r/min离心30 s, 取上清液冰上继续裂解20 min, 加入50 µL 10% Nonidet P(NP)-40, 震荡30 s, 4℃ 3000 r/min离心10 min, 取上清液, -80℃冰箱冻存备用. 通过大鼠IL-1β, IL-6, IL-10定量ELISA试剂盒测定, 严格参照试剂盒操作说明进行.
1.2.5 EMSA法检测NF-κB活化表达: 新鲜肝脏取材组织称质量匀浆后抽提核蛋白, 步骤按试剂盒说明书. 以BCA法测定抽得的蛋白蛋白浓度. 步骤按试剂盒说明书. 本实验中NF-κB探针序列如下: 5'-AGT TGA GGG GAC TTT CCC AGG C-3', 采用3'末端生物素标记[3]. 制备60 g/L聚丙烯酰胺凝胶. 按照EMSA试剂盒, 每孔取抽提的核蛋白6 µg, 与缓冲液及探针混匀, 室温孵育20 min后, 上样电泳, 100 V, 60 min, 半干电转移(280 mA 40 min)将蛋白转至带阳性电荷的尼龙膜. 紫外灯交联后化学发光显色. 显影后采用图像分析系统对条带灰度进行分析.
统计学处理 结果数据以mean±SD表示, 用SPSS14.0软件进行统计学分析. 组内前后不同时点间两两比较采用成组t检验; 组间比较采用单因素方差分析, P<0.05认为具有统计学意义.
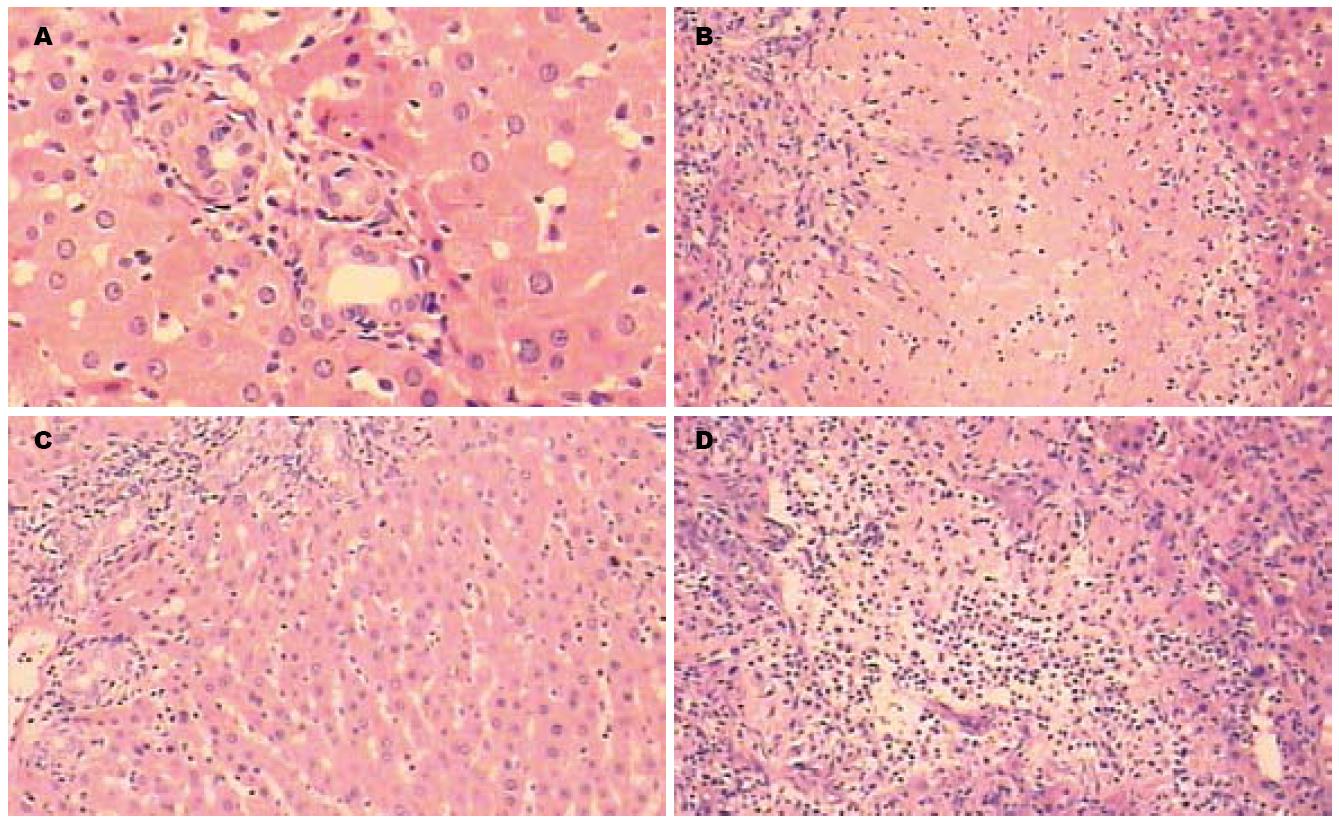
光镜下假手术组肝组织结构正常, CBDL组7 d可见肝内胆管扩张, 肝细胞肿胀、水样变性, 空泡变性、有少量点状或灶状坏死; 汇管区有明显的小胆管、毛细血管以及结缔组织增生(图1A). 结扎14 d可见大范围的汇管区周围肝细胞变性、坏死; 胆管细胞大量增生, 并伸入肝实质内; 纤维结缔组织增生向肝小叶内扩展, 肝小叶有形态改变(图1B). PDTC组在胆总管结扎7 d时肝病理改变较之CBDL组明显减轻(图1C), 可见少量纤维组织、新生胆管增生, 但仍可见肝细胞肿胀以及少量灶性坏死; 结扎14 d时与CBDL组相比肝病理改变差别不显著(图1D).
血清ALT、TB、LPS水平在CBDL组各时相均明显高于假手术组(P<0.01), 且在术后14 d较7 d增高更明显(P<0.01); PDTC组在术后7 d其血清ALT, TB水平明显低于同时相的CBDL组(P<0.01), 术后14 d与CBDL组无明显差异. PDTC组各时相的LPS值与CBDL组无明显差异(P<0.01, 表1).
CBDL组肝组织IL-1β, IL-6, IL-10各时相点较SHAM组明显增高, 有统计学意义(P<0.01), 且14 d时相点较7 d增高明显(P<0.01); PTDC组7 d时相点肝组织IL-1β, IL-6较CBDL组降低(P<0.01), 而14 d时相点无明显差异(P<0.01); CBDL组和PDTC组肝组织IL-10相应时相点对比均无明显差异(P<0.01, 表2).
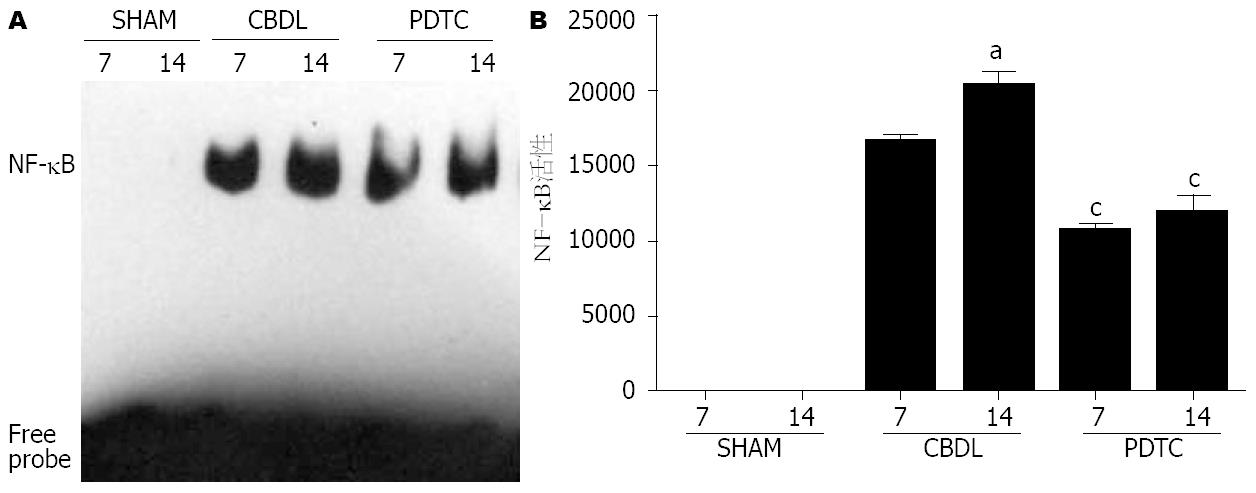
SHAM组无特异性阻滞条带; CBDL组可见活化蛋白与探针结合产生的明显阻滞条带, 14 d时相点阻滞条带的面积与灰度较7 d强(P<0.05); PDTC组有较少量蛋白活化, 阻滞条带的面积与灰度各时相点均弱于对应的CBDL组(P<0.05, 图2).
梗阻性黄疸患者术后较多并发症和高死亡率与术前机体的免疫功能受抑有密切关系. 细胞因子是免疫细胞调节细胞生长、分化、发挥免疫功能的关键信使. 梗阻性黄疽可以启动机体内细胞因子的分泌, 在梗阻性黄疸的发生、发展过程中参与其对多器官功能障碍的启动. 而内毒素是细胞因子产生的主要诱导剂, 诱导细胞分泌多种炎性因子, 并借助这些炎性因子发挥免疫调节作用. NF-κB是NF-κB/Rel家族中的最主要成员之一[4], 是细胞因子释放的开关[5]. 正常情况下NF-κB以无活性状态存在于细胞质中, 由多肽链P50与P65两亚基构成的二聚体, 与其抑制蛋白IκB结合形成非活性的三聚体, 处于不表达状态. 细胞外的许多刺激物如内毒素、炎症细胞因子、生长因子、病毒蛋白等均可激活NF-κB, 首先引起NF-κB诱导激酶的活化, 继而活化IκB激酶, IκB激酶磷酸化, IκB从NF-κB复合体上脱落, 活化的NF-κB移向细胞核内, 结合到靶基因的启动子或增强子的κB结构域, 引起许多因子的转录, 包括促炎因子IL-1β, IL-6等[6-7]. NF-κB蛋白激活引起的多种基因表达的改变将会导致炎症性疾病和肿瘤的发生. 在阻塞性黄疸中NF-κB作为一种重要的炎症转录调控子, 对肝组织的炎性反应、氧化应激以及肝细胞凋亡和再生发挥着重要作用[8]. 本实验发现梗阻性黄疸发生后肝组织NF-κB蛋白表达逐渐增多. 与此同时, 血清中反映肝损伤的指标ALT、TB也明显上升, 血清LPS也逐渐升高. 肝脏组织的促炎细胞因子表达逐渐增多, 而抗炎因子IL-10也随时间OJ延长表达增多. 肝脏组织病理损伤随时间加重.
PDTC是一种抗氧化剂, 可通过直接清除活性氧中间产物(reactive oxygen intermediates, ROIs)减少局部自由基产生从而抑制NF-κB激活, 使致炎细胞因子基因表达受到抑制, 进而减少致炎细胞因子的释放[9-12]. PDTC干预OJ大鼠后, 早期(7 d)较CBDL组NF-κB蛋白表达减少, 肝脏促炎细胞因子IL-1β, IL-6表达不同程度降低, 肝组织损伤减轻, 血清ALT、TB降低. 这表明早期抑制NF-κB的激活对减轻阻塞性黄疸病程早期的肝脏炎性损伤有积极的作用, IL-1β, IL-6则可能是NF-κB抑制剂PDTC减轻阻塞性黄疸时肝脏损伤的机制之一. 后期(14 d)较CBDL组NF-κB蛋白表达亦降低, 而细胞因子IL-1β, IL-6则无明显降低, 肝组织损伤, 血清ALT、TB; PDTC组的LPS和抗炎细胞因子IL-10较CBDL组早晚期均无明显变化. 梗阻性黄疸内毒素血症是机体免疫功能受损的结果, 内毒素血症刺激炎症细胞产生的细胞因子及炎症介质可能是抑制细胞免疫的主要因素[13]. 在体外试验中, Tabary et al[14]研究发现IL-10可以通过抑制IκB激酶复合体来抑制NF-κB的活性, 进而抑制NF-κB对炎症因子的调控作用. IL-10主要由T淋巴细胞产生, 可抑制LPS等诱导的单核巨噬系统的活化及炎性细胞因子的合成, 抑制创伤、感染等炎症介质介导的炎症反应, 对抑制早期炎症反应、保护器官功能方面有重要意义, 但后期介导的细胞免疫抑制是感染性休克和免疫功能下降的重要原因. OJ后期, LPS和IL-10在PDTC组同CBDL组均明显升高, 所以本实验推测, OJ后期通过LPS和IL-10等其他因素对促炎因子的表达起较主要的作用, 从而提高了机体感染和多器官功能损伤的风险, 而NF-κB对促进炎症因子表达的作用相对不明显. 另外其他细胞因子、细胞凋亡也有可能影响NF-κB的表达作用, NF-κB的具体机制有待进一步的研究, 使其对保护机体器官功能产生积极的临床意义.
总之, 梗阻性黄疸时NF-κB的活化上调了细胞因子的表达,导致肝损伤, 早期通过PDTC可抑制NF-κB活化而减轻肝损伤, 后期PDTC作用不明显, 由此推出阻黄机体免疫功能改变是多种因素调节的结果, LPS和IL-10可能是重要的影响因素, 我们应尽早改善机体的免疫功能.
梗阻性黄疸(OJ)是外科常见的临床表现, 围手术期发生的感染、肝衰竭、多器官功能不全综合征(MODS)等并发症和高死亡率与术前机体的免疫功能受抑有密切关系. NF-κB是一种广泛存在于体内细胞的核转录因子, 通过对多种免疫相关因子的调节, 调控机体正常免疫功能, 可导致梗阻性黄疸时肝脏炎性损伤以及继发的机体免疫功能改变.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科
梗阻性黄疸内毒素血症是机体免疫功能受损的结果, 内毒素血症刺激炎症细胞产生的细胞因子及炎症介质可能是抑制细胞免疫的主要因素.
在体外试验中, Tabary et al研究发现IL-10可以通过抑制IκB激酶复合体来抑制NF-κB的活性, 进而抑制NF-κB对炎症因子的调控作用.
PDTC是一种抗氧化剂, 可通过直接清除活性氧中间产物(ROIs)减少局部自由基产生从而抑制NF-κB激活, 使致炎细胞因子基因表达受到抑制, 进而减少致炎细胞因子的释放.
本文探讨梗阻性黄疸时NF-κB的变化及其对免疫应答的影响, 选题较好, 对以后指导临床有较大意义.
编辑: 李军亮 电编:何基才
| 1. | Jiang WG, Puntis MC. Immune dysfunction in patients with obstructive jaundice, mediators and implications for treatments. HPB Surg. 1997;10:129-142. [PubMed] [DOI] |
| 2. | Hiscott J, Kwon H, Génin P. Hostile takeovers: viral appropriation of the NF-kappaB pathway. J Clin Invest. 2001;107:143-151. [PubMed] [DOI] |
| 3. | Nai YJ, Jiang ZW, Wang ZM, Li N, Li JS. Prevention of cancer cachexia by pyrrolidine dithiocarbamate (PDTC) in colon 26 tumor-bearing mice. JPEN J Parenter Enteral Nutr. 2007;31:18-25. [PubMed] [DOI] |
| 4. | Liu HS, Pan CE, Liu QG, Yang W, Liu XM. Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis. World J Gastroenterol. 2003;9:2513-2518. [PubMed] |
| 5. | Steinle AU, Weidenbach H, Wagner M, Adler G, Schmid RM. NF-kappaB/Rel activation in cerulein pancreatitis. Gastroenterology. 1999;116:420-430. [PubMed] [DOI] |
| 6. | Henkel T, Machleidt T, Alkalay I, Krönke M, Ben-Neriah Y, Baeuerle PA. Rapid proteolysis of I kappa B-alpha is necessary for activation of transcription factor NF-kappa B. Nature. 1993;365:182-185. [PubMed] [DOI] |
| 7. | Siebenlist U, Franzoso G, Brown K. Structure, regulation and function of NF-kappa B. Annu Rev Cell Biol. 1994;10:405-455. [PubMed] [DOI] |
| 8. | Panés J, Granger DN. Leukocyte-endothelial cell interactions: molecular mechanisms and implications in gastrointestinal disease. Gastroenterology. 1998;114:1066-1090. [PubMed] [DOI] |
| 9. | Bowie A, O'Neill LA. Oxidative stress and nuclear factor-kappaB activation: a reassessment of the evidence in the light of recent discoveries. Biochem Pharmacol. 2000;59:13-23. [PubMed] [DOI] |
| 10. | Liu SF, Ye X, Malik AB. Inhibition of NF-kappaB activation by pyrrolidine dithiocarbamate prevents In vivo expression of proinflammatory genes. Circulation. 1999;100:1330-1337. [PubMed] |
| 11. | Si X, McManus BM, Zhang J, Yuan J, Cheung C, Esfandiarei M, Suarez A, Morgan A, Luo H. Pyrrolidine dithiocarbamate reduces coxsackievirus B3 replication through inhibition of the ubiquitin-proteasome pathway. J Virol. 2005;79:8014-8023. [PubMed] [DOI] |
| 12. | Ha T, Li Y, Gao X, McMullen JR, Shioi T, Izumo S, Kelley JL, Zhao A, Haddad GE, Williams DL. Attenuation of cardiac hypertrophy by inhibiting both mTOR and NFkappaB activation in vivo. Free Radic Biol Med. 2005;39:1570-1580. [PubMed] [DOI] |
| 14. | Tabary O, Muselet C, Escotte S, Antonicelli F, Hubert D, Dusser D, Jacquot J. Interleukin-10 inhibits elevated chemokine interleukin-8 and regulated on activation normal T cell expressed and secreted production in cystic fibrosis bronchial epithelial cells by targeting the I(k)B kinase alpha/beta complex. Am J Pathol. 2003;162:293-302. [PubMed] |