修回日期: 2008-11-19
接受日期: 2008-11-24
在线出版日期: 2009-03-08
目的: 探讨抑癌基因Pdcd4的表达对羟基喜树碱细胞毒活性的影响及其机制.
方法: 采用脂质体转染法将带有全长Pdcd4 cDNA的质粒转入BGC-823细胞, MTT法测定羟基喜树碱对Pdcd4cDNA转染BGC-823细胞的生长抑制作用, 流式细胞术检测羟基喜树碱作用前后细胞周期和凋亡率的变化, Western blot蛋白印迹法检测Pdcd4蛋白表达.
结果: 建立了稳定转染Pdcd4cDNA的BGC- 823细胞系; 羟基喜树碱作用转染细胞24, 72 h后, 药物对Pdcd4cDNA转染组细胞的半数抑制浓度均低于两对照组(pCDNA3.1与pCDNA-Pdcd4-D418A)(74.48 μmol/L vs 87.67, 102.30 μmol/L; 14.30 μmol/L vs 40.59, 29.54 μmol/L, 均P<0.05); 流式细胞仪测定结果表明, 80 μmol/L羟基喜树碱作用转染细胞24 h, 处于细胞周期G0/G1期的细胞比例下降, S期细胞比例升高, 出现细胞周期S期阻滞, 72 h, 细胞凋亡率显著升高(pCDNA3.1: 45.40% vs 5.65%; pCDNA-Pdcd4-D418A: 36.21% vs 3.07%; pCDNA-Pdcd4: 46.17% vs 4.25%, P<0.05); Western blot结果表明80 μmol/L羟基喜树碱作用转染细胞72 h, Pdcd4蛋白表达水平升高.
结论: 提高人胃腺癌细胞BGC-823中Pdcd4蛋白的表达能增强其对羟基喜树碱的敏感性; 羟基喜树碱能引起BGC-823细胞S期阻滞, 并能诱导细胞凋亡; 羟基喜树碱本身也可上调BGC-823中Pdcd4的表达.
引文著录: 王汉卿, 孙震晓. 抑癌基因Pdcd4的表达对羟基喜树碱细胞毒活性的影响. 世界华人消化杂志 2009; 17(7): 647-651
Revised: November 19, 2008
Accepted: November 24, 2008
Published online: March 8, 2009
AIM: To investigate the effect of Pdcd4 tumor suppressor gene expression on the cytotoxic activity of hydroxycamptothecine (HCPT) to the human gastric cancer cell line BGC-823 and its mechanism.
METHODS: Lipid-mediated transfection was used to obtain Pdcd4 high-expressed BGC-823 cell line and the control cell lines. MTT method was used to determine the growth inhibition of HCPT to the transfected BGC-823 cells. Flow cytometry was used to analyze the effects of HCPT to the cell cycle and apoptosis rate of the transfected BGC-823 cells. Western blot was used to analyze the transfection results and the expression of Pdcd4 protein in the transfected BGC-823 cells treated with HCPT.
RESULTS: A stable Pdcd4 high-expressed BGC-823 cell line was established. MTT results showed that after the transfection treated with HCPT for 24 and 72 hours, the IC50 of the Pdcd4 high-expressed group was lower than that of the control groups (pCDNA3.1 and pCDNA-Pdcd4-D418A) (74.48 μmol/L vs 87.67, 102.30 μmol/L; 14.30 μmol/L vs 40.59, 29.54 μmol/L, all P < 0.05). After the transfected BGC-823 cells were treated with 80 μmol/L HCPT for 72 hours, the cell proportion in G0/G1 phase declined, while the cell proportion in S phase increased and the apoptosis cell rate increased significantly (pCDNA3.1: 45.40% vs 5.65%; pCDNA-Pdcd4-D418A: 36.21% vs 3.07%; pCDNA-Pdcd4: 46.17% vs 4.25%, all P < 0.05). Western blot results showed that after transfected BGC-823 cells were treated with 80 μmol/L HCPT for 72 hours, the expression of Pdcd4 protein was increased.
CONCLUSION: High expression of Pdcd4 increases the sensitivity of BGC-823 cells to HCPT. HCPT induces BGC-823 cells S-stage arrest and apoptosis. HCPT up-regulates the expression of Pdcd4 protein in BGC-823 cells.
- Citation: Wang HQ, Sun ZX. Effect of Pdcd4 tumor suppressor gene expression on cytotoxicity of hydroxycamptothecine. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 647-651
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.647
程序性细胞死亡因子4(programmed cell death 4, Pdcd4)是近年来新发现的一个抑癌基因, 他在人肺癌、肠癌等多种人癌组织中表达下调或缺失[1-2]. 羟基喜树碱(hydroxycamptothecine, HCPT)是一种具有选择性抑制DNA拓扑异构酶Ⅰ(TopoⅠ)的植物抗癌药, 具有广谱抗癌作用, 临床上用于治疗原发性肝癌、胃癌等. 对抗癌药物减毒增效的研究一直是一个重要而困难的课题. 有报道指出, 细胞中Pdcd4的表达水平可能影响某些抗癌药物的抗癌活性[3]. 本实验拟通过建立Pdcd4 cDNA稳定转染BGC-823细胞系, 测定羟基喜树碱对转染细胞的增殖抑制作用、细胞周期和凋亡率的变化及Pdcd4的表达情况, 以考察抗癌药物羟基喜树碱对人胃腺癌细胞BGC-823的细胞毒活性与BGC-823细胞中抑癌基因Pdcd4的表达的相关性.
RPMI 1640培养基为Gibco公司产品, 胎牛血清购于中国医学科学院生物工程研究所-灏阳生物, G418为Inalco公司产品, 10-羟基喜树碱购于Sigma公司, 原药以DMSO溶解并配成80 mmol/L贮存液, 分装后-20℃贮存; DH5α工程菌为Biodee公司产品, 转染试剂Lipofectamine为Invitrogen公司产品; 噻唑蓝(MTT)为Ameresco公司产品; 兔抗人Pdcd4抗体为美国肯塔基大学医学院杨新盛博士(Dr. Hsin-Sheng Yang)惠赠, 兔抗actin、辣根过氧化物酶标记羊抗兔IgG和ECL试剂购于北京中杉金桥生物技术有限公司, Santa Cruz Biotech公司产品. 蛋白酶抑制剂Protease Inhibitor Cocktail Set Ⅲ为Calbiochem公司产品.
1.2.1 细胞培养: 人胃腺癌细胞BGC-823购自协和基础所细胞库. 采用含100 mL/L小牛血清, 100 kU/L青霉素和100 mg/L: 链霉素的RPMI 1640培养液, 37℃, 50 mL/L CO2饱和湿度培养箱中培养, 2-3 d换液传代1次. 取对数生长期细胞为实验对象. 转染细胞采用含100 mL/L小牛血清, 300 mg/L G418的RPMI 1640培养液, 37℃, 50 mL/L CO2的饱和湿度培养箱中培养, 2-3 d换液传代1次. 取对数生长期细胞为实验对象.
1.2.2 脂质体转染建立稳定表达Pdcd4 cDNA的人胃腺癌BGC-823细胞系: 转染质粒分别为pcDNA3.1(空质粒)、pcDNA3.1-Pdcd4(Pdcd4 cDNA表达质粒)及pcDNA3.1-Pdcd4D418 A(Pdcd4 cDNA突变质粒), 以上质粒均为美国肯塔基大学医学院杨新盛博士惠赠.
1.2.3 MTT法测定羟基喜树碱对BGC-823细胞的增殖抑制作用: 取对数生长期细胞, 重悬于含体积分数为100 mL/L FBS的RPMI 1640培养液中, 以1×103个细胞/孔的终浓度接种于96孔培养板, 24 h后加入0、40、80、160 µmol/L的HCPT, 每个浓度重复3个孔, 培养不同时间后, 加MTT, 置37℃, 50 mL/L CO2培养箱中孵育6 h, 小心吸去上清, 加入DMSO后震摇, 使蓝紫色沉淀充分溶解. 在酶标仪555 nm波长处读取吸光度值, 测定细胞增殖抑制率, 并绘制抑制率曲线, 计算不同时间药物对癌细胞的半数抑制浓度(IC50). 实验重复3次.
1.2.4 流式细胞术测定细胞周期变动和凋亡: 收集80 µmol/L HCPT作用不同时间的BGC-823细胞, 用PBS(pH7.2)洗涤2次, 700 mL/L冰乙醇固定, 4℃保存过夜. 1000 r/min离心5 min弃去固定液. 1 mL PBS重悬, 1000 r/min离心5 min弃上清. 加入30 mg/L的RNaseA 200 µL, 37℃, 40 min. 1000 r/min离心5 min弃上清. 加入50 mg/L的PI染液200 µL, 4℃避光60 min. 上机前常规进行光路流路校准, 流式细胞仪检测结果经CELLQuest Software分析.
1.2.5 Western blot检测Pdcd4表达: 80 µmol/L HCPT作用BGC-823细胞72 h后, 加含蛋白酶抑制剂的细胞裂解液裂解细胞, 离心取上清液, 测定蛋白浓度, SDS-PAGE电泳, 然后样品带电转移至硝酸纤维素膜, 50 g/L脱脂牛奶封闭, 一抗(兔抗人Pdcd4, 1∶1000稀释)过夜, 辣根过氧化物酶标记二抗(羊抗兔, 1∶5000稀释)室温作用1 h, ECL试剂显影.
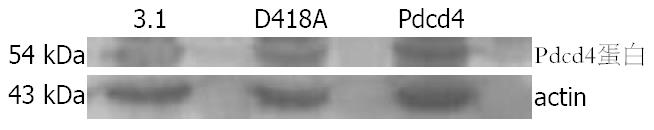
采用脂质体转染法, 分别将pcDNA3.1(3.1组)、pcDNA3.1-Pdcd4(Pdcd4组)、pcDNA3.1-Pdcd4D418A(D418A组)转染BGC-823细胞, 300 mg/L G418筛选2-4 wk, 通过Western blot法分析, 结果Pdcd4组(表达有功能的Pdcd4蛋白)和D418A组(表达突变的功能部分丧失的Pdcd4蛋白)的Pdcd4蛋白表达明显强于3.1组, 确认三种质粒已稳定转染(图1).
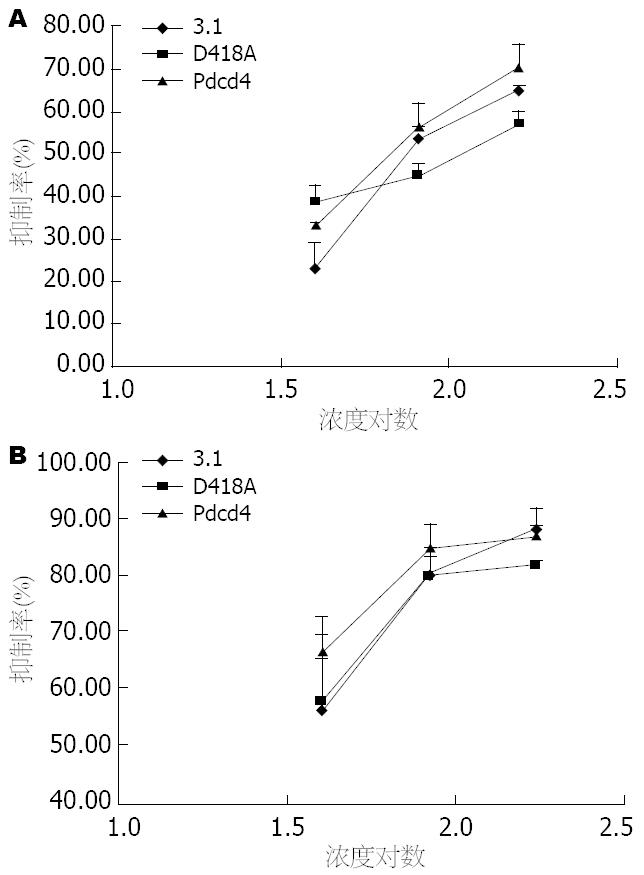
分别用0、40、80、160 μmol/L HCPT作用3种BGC-823转染细胞24、72 h后, MTT法测定细胞增殖抑制率, 并绘制抑制率曲线(图2), 计算IC50. 结果表明, 羟基喜树碱对三组转染细胞均有显著增殖抑制作用, 比较HCPT作用三种转染细胞24、72 h的半数抑制浓度, 结果HCPT对Pdcd4 cDNA转染组(pCDNA-Pdcd4)细胞的半数抑制浓度(24 h: 74.48 μmol/L; 72 h: 14.30 μmol/L)均低于两对照组(24 h: pCDNA3.1: 87.67、pCDNA-Pdcd4-D418A: 102.30 μmol/L; 72 h: pCDNA3.1: 40.59 μmol/L; pCDNA-Pdcd4-D418A: 29.54 μmol/L). 低浓度(40、80 μmol/L)HCPT作用3种转染细胞72 h, 高浓度(160 μmol/L)HCPT作用三种转染细胞24 h后, Pdcd4组抑制率均高于其他两转染组(图3). 以上结果说明Pdcd4增强了人胃腺癌细胞BGC-823对HCPT的敏感性.
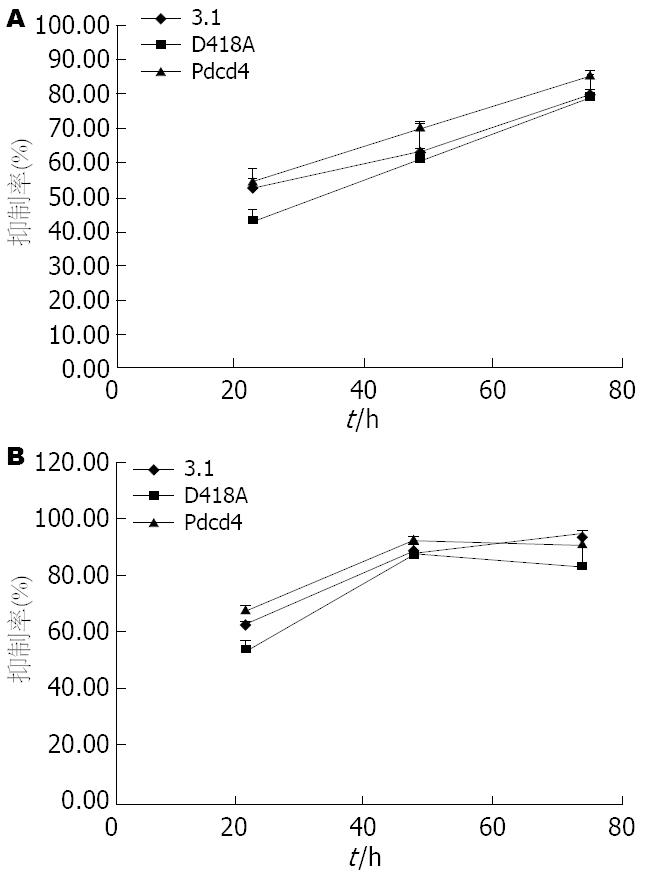
采用80 μmol/L HCPT作用三种BGC-823转染细胞24、72 h后, 流式细胞术检测细胞周期和凋亡率的变化, 结果发现各转染组加入HCPT24后, 与溶剂对照组(3.1c, D418Ac, Pdcd4c)相比, 加药组(3.1t, D418At, Pdcd4t)细胞G0/G1期细胞比例显著下降, S期细胞比例显著升高, 但是3组转染细胞间无明显差别, 72 h后, 各加药组细胞凋亡率显著升高(表1). 说明HCPT能引起BGC-823细胞S期阻滞, 进而能诱导肿瘤细胞凋亡, HCPT对3转染组的细胞周期影响相近, 没有显著差别.
| 24 h | 72 h | |||||||
| G0/G1 | S | G2/M | Apo | G0/G1 | S | G2/M | Apo | |
| 3.1c | 65.13 | 13.33 | 21.54 | 1.09 | 55.08 | 31.71 | 13.20 | 5.65 |
| 3.1t | 12.42 | 64.63 | 22.95 | 1.71 | 32.11 | 56.84 | 11.05 | 45.40 |
| D418Ac | 61.96 | 15.35 | 22.69 | 0.67 | 66.46 | 23.52 | 10.02 | 3.07 |
| D418At | 11.97 | 67.11 | 20.92 | 1.17 | 21.89 | 66.42 | 9.69 | 36.21 |
| Pdcd4c | 70.01 | 11.89 | 17.10 | 1.05 | 51.75 | 37.40 | 10.85 | 4.25 |
| Pdcd4t | 16.64 | 66.68 | 16.68 | 1.68 | 22.73 | 66.56 | 10.71 | 46.17 |
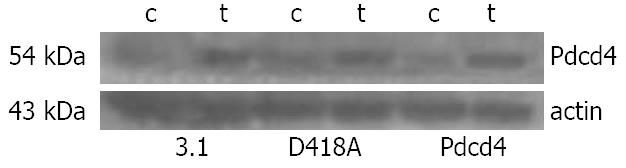
采用80 μmol/L HCPT作用3种BGC-823转染细胞72 h后, Western blot法检测Pdcd4蛋白的表达情况, 结果发现3种转染细胞中Pdcd4蛋白表达量均升高(图4), 说明HCPT能显著上调Pdcd4蛋白表达.
喜树碱(camptothecine, CPT)是从珙桐科植物喜树中分离提取的五环生物碱, 是有选择性抑制DNA TopoⅠ作用的植物抗癌药. 由于喜树碱的水溶性和脂溶性都比较差, 其钠盐的抗癌活性较低, 临床应用受到严格限制. 10-羟基喜树碱其化学结构与喜树碱相似, 仅第10位碳原子上的氢为羟基所取代. 与喜树碱相比, 羟基喜树碱毒性小、抗肿瘤作用更强, 使喜树碱类药物在肿瘤防治中起到了重大作用. 尤其在抗癌药紫杉醇生产用原料严重枯竭的形势下, 羟基喜树碱的发展前景更加看好[4]. 已有的体外研究表明羟基喜树碱对多种癌细胞均有抑制或杀伤作用, 本实验同样发现羟基喜树碱能抑制人胃腺癌细胞BGC-823增殖, 引起BGC-823细胞S期阻滞, 继而诱导肿瘤细胞凋亡率升高, 结果与涂水平 et al[5]的报道一致, 而Zhang et al[6]研究发现羟基喜树碱诱导人肝癌细胞G2/M期阻滞, 说明HCPT对不同来源不同类型的肿瘤细胞周期变化的影响有所不同.
Pdcd4最初发现是小鼠上皮JB6细胞恶性转化的抑制物, Pdcd4可与真核细胞翻译起始复合物中的eIF4A起始因子等直接作用, 进而影响与细胞增殖有关的转录因子蛋白质合成[7]. Jansen et al通过Western blot方法分析美国癌症研究所(NCI)60种癌细胞中Pdcd4蛋白表达情况, 发现在大多数的肾源、肺源和神经胶质源的肿瘤细胞中, Pdcd4蛋白的表达水平下降[3]. 提高Pdcd4的表达可作为抗癌研究新的靶点[8].
Jansen et al[3]实验还证明, 在肾癌UO-31细胞中表达Pdcd4 cDNA, 增强了其对geldanamycin的敏感性, 并伴随着细胞周期阻滞和凋亡的增加. 本研究发现, 人胃腺癌BGC-823细胞转染Pdcd4 cDNA后, 与对照组相比, HCPT对Pdcd4转染组细胞增殖抑制率增加, 药物对癌细胞的半数抑制浓度降低, 说明提高BGC-823细胞中Pdcd4的表达水平增加了癌细胞对羟基喜树碱的敏感性.
为了弄清Pdcd4引起羟基喜树碱细胞毒活性增加是药物抗癌活性与Pdcd4抑癌基因作用的简单叠加还是Pdcd4通过某种作用途径诱导了药物的抗癌活性的提高, 我们测定了不加药情况下3种转染细胞的生长曲线、细胞周期和细胞凋亡情况, 结果发现各转染细胞的生长情况和细胞周期分布无明显差别, 说明Pdcd4 cDNA转染本身并没有明显影响BGC-823细胞的增殖和凋亡, 转染Pdcd4 cDNA组引起羟基喜树碱细胞毒活性增加不是药物抗癌活性与Pdcd4抑癌基因作用的简单叠加. 本研究还发现羟基喜树碱本身可增加BGC-823细胞中Pdcd4蛋白表达, 其机制尚不清楚. 提高Pdcd4在细胞中的表达能增加癌细胞对羟基喜树碱的敏感性, 而羟基喜树碱能使Pdcd4上调表达, 二者协同作用可能大大增加了羟基喜树碱对癌细胞的细胞毒作用, 提示Pdcd4可能参与了羟基喜树碱对癌细胞的杀伤作用, 其分子机制有待进一步研究.
Pdcd4是一个新发现的抑癌基因, 在多种癌症中表达下调或缺失. 前人研究发现, 在肾癌细胞中表达Pdcd4 cDNA, 可以增强其对抗肿瘤抗生素苯醌安莎霉素(geldanamycin)的敏感性.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
Pdcd4基因表达下调或其产物泛素化途径的激活可能是部分癌症发生发展的原因之一. Pdcd4可能是抗癌药物研究的新靶点. Pdcd4的表达对抗癌药物细胞毒作用的影响以及抗癌药物对Pdcd4表达的影响还缺乏广泛深入的研究.
国外有报道在具有抗癌活性药物geldanamycin和tamoxifen的作用下, Pdcd4蛋白的表达水平高于平均值. 稳定表达Pdcd4反义核酸能显著降低乳腺癌MCF-7细胞对geldanamycin和tamoxifen的敏感性. 在肾癌UO-31细胞中表达Pdcd4 cDNA后, 增强了其对geldanamycin的敏感性.
本文通过脂质体转染技术把含有Pdcd4 cDNA的质粒导入人胃腺癌BGC-823细胞中实现了稳定转染, 并利用转染细胞株研究Pdcd4的表达对10-羟基喜树碱细胞毒活性的影响, 同时考察了10-羟基喜树碱对Pdcd4蛋白表达的影响.
Pdcd4基因可增强胃腺癌BGC-823细胞对10-羟基喜树碱的敏感性, 为进一步提高羟基喜树碱临床疗效提供了新思路.
本研究方法比较先进, 思路清晰, 论述合理, 创新性较强, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Chen Y, Knösel T, Kristiansen G, Pietas A, Garber ME, Matsuhashi S, Ozaki I, Petersen I. Loss of PDCD4 expression inhuman lung cancer correlates with tumour progression and prognosis. J Pathol. 2003;200:640-646. [PubMed] [DOI] |
| 2. | Wang Q, Sun Z, Yang HS. Downregulation of tumor suppressor Pdcd4 promotes invasion and activates both beta-catenin/Tcf and AP-1-dependent transcription in colon carcinoma cells. Oncogene. 2008;27:1527-1535. [PubMed] [DOI] |
| 3. | Jansen AP, Camalier CE, Stark C, Colburn NH. Characterization of programmed cell death 4 in multiple human cancers reveals a novel enhancer of drug sensitivity. Mol Cancer Ther. 2004;3:103-110. [PubMed] |
| 5. | 涂 水平, 江 石湖, 谭 继宏, 钟 捷, 乔 敏敏, 蒋 晓华, 章 永平, 袁 耀宗, 吴 云林, 吴 裕炘. 羟基喜树碱诱导胃癌细胞凋亡的作用机制初步研究. 中华消化杂志. 2001;21:274-277. |
| 6. | Zhang XW, Jiang JF, Xu B. Differentiation-inducing action of 10-hydroxycamptothecin on human hepatoma Hep G2 cells. Acta Pharmacol Sin. 2000;21:364-368. [PubMed] |
| 7. | Yang HS, Jansen AP, Komar AA, Zheng X, Merrick WC, Costes S, Lockett SJ, Sonenberg N, Colburn NH. The transformation suppressor Pdcd4 is a novel eukaryotic translation initiation factor 4A binding protein that inhibitstranslation. Mol Cell Biol. 2003;23:26-37. [PubMed] [DOI] |
| 8. | Stålberg P, Lopez-Egido JR, Wang S, Gobl A, Oberg K, Skogseid B. Differentially expressed cDNAs in PLCbeta3-induced tumor suppression in a human endocrine pancreatic tumor cell line: activation of the human mismatch repair protein 3 gene. Biochem Biophys Res Commun. 2001;281:227-231. [PubMed] [DOI] |