修回日期: 2009-02-01
接受日期: 2009-02-09
在线出版日期: 2009-02-28
目的: 探讨Raf-1在肝细胞肝癌组织中表达的临床意义、相关性及对预后的影响.
方法: 应用免疫组织化学方法检测50例肝细胞肝癌组织、17例癌旁硬化肝组织及14例正常肝组织Raf-1的表达. 分析其与临床特征的关系.
结果: Raf-1在肝细胞肝癌组织中的表达显著高于癌旁硬化肝组织和正常肝组织(Z = -5.079, Z = -5.082, 均P = 0.000). Raf-1表达与临床分期、病理分级、年龄、肿瘤大小、癌栓明显相关(r = -0.452, -0.547, 0.301, -0.357, -0.464, 均P<0.05). Raf-1表达(-)-(+)者平均生存时间较短, 生存率较低, 预后较差; Raf-1表达(++)-(+++)者平均生存时间较长, 生存率较高, 预后较好.
结论: Raf-1在肝细胞肝癌组织中的表达显著升高. 对伴有癌栓、肿瘤较大且分化较差、属临床分期较晚的青壮年肝癌患者, Raf-1阳性表达较弱, 生存期较短, 预后较差.
引文著录: 殷飞, 赵雅娟, 姚树坤. Raf-1在肝细胞肝癌组织的表达. 世界华人消化杂志 2009; 17(6): 618-622
Revised: February 1, 2009
Accepted: February 9, 2009
Published online: February 28, 2009
AIM: To study the relationship between Raf-1 levels predicts and clinical outcome of hepatocellular carcinoma (HCC).
METHODS: Immunohistochemistry method was used to stain slide of 50 HCC tissue, 17 corresponding non-cancerous tissue and 14 normal hepatic tissue for Raf-1 protein, and analysis the relationship between expression of Raf-1 and clinical outcome.
RESULTS: Raf-1 expressional frequency in HCC was significantly higher than that in adjacent non-cancerous hepatic tissue and in normal hepatic tissue (Z = -5.079, Z = -5.082, both P = 0.000). The expression of Raf-1 was relation with clinical stage, pathology classification, age, tumor size and cancer bolt (r = -0.452, -0.547, 0.301, -0.357, -0.464, all P < 0.05). As for tumor tissues, Raf-1 was less stained in the tissue with later clinical stage and shorter survival, moderately and strongly stained in the tissue with earlier clinical stage and longer survival.
CONCLUSION: Raf-1 expressional levels were higher in tumor tissues, while positively correlated with survival rate and clinical stage.
- Citation: Yin F, Zhao YJ, Yao SK. Expression of Raf-1 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 618-622
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/618.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.618
肝细胞肝癌(hepatocellular carcinoma, HCC)是常见的恶性肿瘤之一, 尽管人们采用了一些新的治疗手段, 但其死亡率仍居高不下. 细胞内各种信号转导途径互相作用, 形成复杂的信号途径网络, 精密调节各种生理过程. 因此, 细胞信号转导通路中任何组分的改变都会导致细胞增殖、凋亡的失控, 发生癌变. 丝裂原活化蛋白激酶(mitogen-associated protein kinase, MAPK)信号转导通路与肝细胞增殖的关系非常密切. 其中Raf/MEK/ERK通路是MAPK众多通路中的一个, 为近年来细胞信号转导方面最活跃的研究领域. Raf-1为一种MAPK激酶激酶, 他的激活可以引起MAPK信号转导通路的活化, 促使细胞增殖周期失调, 形成肿瘤. 本文通过免疫组织化学方法比较Raf-1在50例肝细胞肝癌组织、17例癌旁硬化肝组织及14例正常肝组织的表达, 探讨Raf-1在肝细胞肝癌组织中表达的临床意义、相关性及对预后的影响.
收集河北医科大学第四医院肝胆外科2001-11/2006-05手术切除、病理诊断明确的标本50例肝细胞肝癌组织、17例癌旁硬化肝组织及14例肝血管瘤周边正常肝组织(作为对照), 标本取出后, 立即投入中性甲醛溶液中固定, 梯度乙醇脱水, 二甲苯透明, 常规石蜡包埋, 连续切片4 μm厚, 以备染色. 免疫组化试剂盒购于北京中杉金桥生物技术有限公司, Raf-1鼠抗人mAb购于Santa Cruz公司.
本试验50例肝细胞肝癌患者临床资料如下: (1)男44例, 女6例; (2)年龄≥50岁者30例, 年龄<50岁者20例; (3)肿瘤<5 cm者9例, 肿瘤≥5 cm者41例; (4)单个癌灶者37例, 癌灶≥2个者13例; (5)伴门脉瘤栓者13例, 不伴门脉瘤栓者37例; (6)AFP<400 μg/L者25例, AFP≥400 μg/L者25例; (7)HBsAg阴性者4例, HBsAg阳性者46例; HBeAb阴性者30例, HBeAb阳性者20例; (8)包膜完整者43例, 包膜不完整者7例; (9)Edmondson病理分级高分化者6例, 中分化者29例, 低分化者15例; (10)根据2001-09中国抗癌协会肝癌专业委员会制定的"原发性肝癌临床诊断与分期标准"[1], Ⅰa期者4例、Ⅰb期者7例、Ⅱa期者12例、Ⅱb期者17例、Ⅲa期者10例, 无Ⅲb期者; (11)至2007-07随访患者术后生存情况: 50例中失访18例, 生存期0.5年32例, 1年28例, 1.5年21例, 2年15例, 超过2年者12例, 随访时间最短1 mo、最长41 mo; (12)临床分期较早者(Ⅰ+Ⅱa期)共有23例, 失访4例, 生存期0.5年19例, 1年17例, 1.5年15例, 2年12例, 超过2年者11例, 随访时间最短4 mo、最长41 mo; 临床分期较晚者(Ⅱb+Ⅲ期)共有27例, 失访14例, 生存期0.5年13例, 1年11例, 1.5年6例, 2年3例, 超过2年者1例, 随访时间最短1 mo、最长40 mo.
1.2.1 免疫组织化学法步骤: Raf-1: 采用SP法. 石蜡切片常规脱蜡, 30 mL/L H2O2甲醇溶液室温孵育15 min, PBS洗涤5 min×2遍后, 用0.01 mol/L的柠檬酸缓冲液(pH6.0)加热至沸腾后高压修复抗原2 min, 冷却后依次滴加封闭用正常山羊血清工作液封闭40 min, 而后Raf-1抗体4℃孵育过夜; 次日取出切片以PBS冲洗后, 再依次滴加生物素化二抗、链霉卵白素; 最后DAB显色, 苏木素复染, 常规乙醇脱水、二甲苯透明、中性树胶封片保存. 光镜下观察并分析Raf-1表达情况. Raf-1抗体稀释度1∶400.
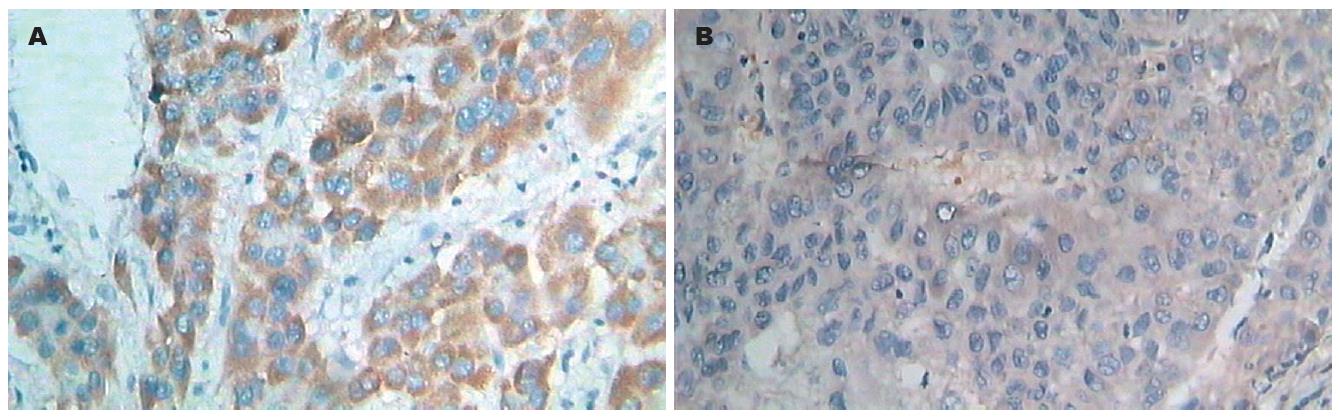
1.2.2 判断标准: Raf-1免疫组化阳性定位于细胞质中及细胞膜上.结果采用记分法进行半定量分析, (1)阳性细胞百分计分: 0: 0分, <25%: 1分, 26%-50%: 2分, 51%-75%: 3分, >75%: 4分; (2)着色强度(颜色)计分: 无: 0分, 弱(淡黄): 1分, 中(棕黄): 2分, 强(棕褐): 3分.以(1)、(2)两分相加, 0分阴性(-), 2-3分弱阳性(+), 4-5分中度阳性(++), 6-7分强阳性(+++).
统计学处理 应用SPSS13.0软件包分析, 各组表达情况的比较用非参数检验法, 相关性用Spearman相关分析. 随访患者生存情况, 生存率用Kaplan-Meier生存曲线及单变量Log rank检验分析. P<0.05为有显著性差异.
Raf-1在各组中均有表达, 呈团簇状分布在细胞质及细胞膜上. Raf-1在50例肝细胞肝癌组织中弱阳性表达17例, 中度阳性表达20例, 强阳性表达9例; 在17例癌旁肝硬化组织中有5例有弱阳性表达; 14例正常肝组织中有2例有弱阳性表达. 其在肝细胞肝癌组织中的表达显著高于癌旁硬化肝组织和正常肝组织(Z = -5.079和Z = -5.082, P = 0.000), 癌旁硬化肝组织表达和正常组织表达无统计学差异(表1, 图1).
| 分组 | n | Raf-1表达 | Z | |||
| - | + | ++ | +++ | |||
| 肝癌组 | 50 | 4 | 17 | 20 | 9 | |
| 癌旁硬化组 | 17 | 12 | 5 | 0 | 0 | -5.079 |
| 正常对照组 | 14 | 12 | 2 | 0 | 0 | -5.082 |
Raf-1表达与性别、癌灶数目、AFP、HBeAb、HBsAg及包膜是否完整无关. Raf-1在临床分期较早癌组织中的表达强于分期较晚者(χ2 = 13.496, P<0.05; r = -0.452, P<0.05), 在病理分级高分化癌组织中的表达强于低分化者(χ2 = 14.904, P<0.05; r = -0.547, P<0.05), 在年龄≥50岁患者癌组织中的表达强于<50岁者(Z = -2.109, P<0.05; r = 0.301, P<0.05), 在肿瘤<5 cm患者癌组织中的表达强于≥5 cm者(Z = -2.502, P<0.05; r = -0.357, P<0.05), 在不伴癌栓患者癌组织中的表达强于伴癌栓者(Z = -3.246, P<0.05; r = -0.464, P<0.05)(表2).
| Raf-1表达 | n | χ2 | P值 | r值 | P值 | ||||
| - | + | ++ | +++ | ||||||
| 性别 | |||||||||
| 男 | 4 | 14 | 17 | 9 | 44 | -0.617 | 0.537 | -0.088 | 0.543 |
| 女 | 0 | 3 | 3 | 0 | 6 | ||||
| 年龄(岁) | |||||||||
| ≥50 | 1 | 9 | 12 | 8 | 30 | -2.109 | 0.035 | 0.301 | 0.034 |
| <50 | 3 | 8 | 8 | 1 | 20 | ||||
| 肿瘤大小(cm) | |||||||||
| <5 | 0 | 1 | 4 | 4 | 9 | -2.502 | 0.012 | -0.357 | 0.011 |
| ≥5 | 4 | 16 | 16 | 5 | 41 | ||||
| 癌灶数目 | |||||||||
| 1 | 4 | 10 | 16 | 7 | 37 | -0.527 | 0.598 | 0.075 | 0.603 |
| ≥2 | 0 | 7 | 4 | 2 | 13 | ||||
| 门脉瘤栓 | |||||||||
| 无 | 1 | 10 | 17 | 9 | 37 | -3.246 | 0.001 | -0.464 | 0.001 |
| 有 | 3 | 7 | 3 | 0 | 13 | ||||
| AFP(μg/L) | |||||||||
| <400 | 1 | 7 | 11 | 6 | 25 | -1.614 | 0.107 | -0.231 | 0.107 |
| ≥400 | 3 | 10 | 9 | 3 | 25 | ||||
| HBsAg | |||||||||
| - | 1 | 0 | 2 | 1 | 4 | -0.360 | 0.719 | 0.051 | 0.723 |
| + | 3 | 17 | 18 | 8 | 46 | ||||
| HBeAb | |||||||||
| - | 4 | 10 | 11 | 5 | 30 | -1.018 | 0.309 | -0.145 | 0.314 |
| + | 0 | 7 | 9 | 4 | 20 | ||||
| 包膜 | |||||||||
| 不完整 | 0 | 2 | 4 | 1 | 7 | -0.578 | 0.563 | -0.083 | 0.569 |
| 完整 | 4 | 15 | 16 | 8 | 43 | ||||
| 临床分期 | |||||||||
| Ⅰa | 0 | 1 | 1 | 2 | 4 | 13.496 | 0.009 | -0.452 | 0.001 |
| Ⅰb | 0 | 0 | 4 | 3 | 7 | ||||
| Ⅱa | 1 | 4 | 6 | 1 | 12 | ||||
| Ⅱb | 1 | 6 | 7 | 3 | 17 | ||||
| Ⅲa | 2 | 6 | 2 | 0 | 10 | ||||
| 病理分级 | |||||||||
| 高分化 | 0 | 0 | 4 | 2 | 6 | 14.904 | 0.001 | -0.547 | 0.000 |
| 中分化 | 1 | 8 | 13 | 7 | 29 | ||||
| 低分化 | 3 | 9 | 3 | 0 | 15 | ||||
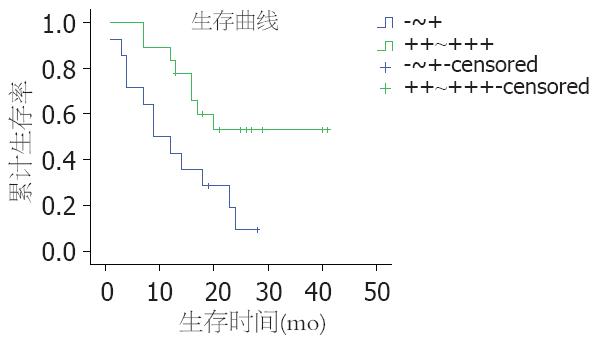
Raf-1表达(-)-(+)者0.5年生存率71.4%, 1年生存率42.9%, 1.5年生存率28.6%, 2年生存率14.3%, 中位生存时间9 mo, 平均生存时间为12.93 mo; Raf-1表达(++)-(+++)者1年生存率83.3%, 1.5年生存率61.1%, 2年生存率54.3%, 平均生存时间为28.23 mo. 单变量Log rank检验, χ2 = 6.793, P<0.05. Raf-1表达对肝细胞肝癌患者的预后的影响有统计学差异. 可见Raf-1表达越强, 生存率越高, 平均生存时间越长, 预后越好(图2).
MAPK是细胞内一类丝氨酸/苏氨酸蛋白激酶, 存在于真核生物的大多数细胞内. Raf/MEK/ERK通路是MAPK众多信号转导通路中的一个, 该通路能将多种细胞外信号通过磷酸化的活化方式逐级传递至细胞核, 激活多种转录因子, 在细胞增殖、细胞的生长抑制及分化、细胞凋亡等过程中起着重要的调控作用. 此外, 该信号转导通路激活后, 亦可通过促进细胞周期蛋白Cyclin D1与细胞周期蛋白依赖性激酶4和(或)6[Cyclin dependent kinase 4 and/or 6, CDK4和(或)CDK6]的结合而激活CDK, 促进细胞周期由G1期进入S期, 致使细胞增殖周期失调, 形成肿瘤. 因此Raf/MEK/ERK通路是一种重要的肿瘤生物学进程[2]. 有资料表明在肿瘤组织中MAPK通路相关蛋白及Cyclin D1均有高表达, 提示MAPK通路介导的信号转导在肝细胞癌发病机制中有重要作用, 并与Cyclin D1在肝细胞癌发病机制中可能起到协同作用, 促进细胞分裂增殖, 形成肿瘤[3-4].
Raf为一种MAPK激酶激酶, 多位于细胞质, 有三种同工酶: A-Raf, B-Raf和Raf-1(又叫C-Raf或c-Raf-1). Raf-1是分子质量为70-74 kDa的丝/苏氨酸蛋白激酶, 可以通过Ras、14-3-3蛋白、HSP90等的协助而被激活[5], 其作用是磷酸化并激活下游底物MAPK激酶(MAPKK)如MEK; MAPKK具有磷酸化苏氨酸/酪氨酸残基的双特异功能而磷酸化并激活下游底物MAPK如ERK, ERK可由胞质移位至细胞核, 磷酸化一系列转录因子(c-Jun及c-fos等), 将胞质内的活化信号传递入胞核内, 形成转录复合物, 调控基因表达, 促进增殖. 因此, Raf-1介导的MAPK信号转导通路在细胞代谢、周期调控、凋亡、分化、增殖和神经调控等过程中起关键作用[6-7].
本试验发现: (1)Raf-1在肝细胞肝癌组织中的表达显著高于癌旁硬化肝组织和正常肝组织, 而在癌旁硬化肝组织和正常肝组织的表达无统计学差异. Raf-1是MAPK信号通路中的重要组成成分, 因此, Raf-1的表达水平的升高在肝癌的发生、发展中起重要作用. (2)对伴有癌栓、肿瘤较大且分化较差、属临床分期较晚的青壮年肝癌患者, Raf-1阳性表达较弱, 生存期较短, 预后较差. 在以往的研究中发现Raf-1的高表达与肝癌细胞增殖、肿瘤的形成有关, 并未具体涉及到蛋白表达强弱与哪些临床病理资料有关、及临床分期对其表达的影响. Leicht et al[8]研究显示Raf-1已经在多种人类肿瘤早期存在过表达, 如肺癌、肝癌、前列腺癌等. 本试验结果同Leicht et al研究相似, 提示在肿瘤早期Raf-1即存在高表达, Raf-1的持续表达致使肿瘤早期MAPK信号通路持续激活, 进而激活其下游底物促使细胞异常增殖, 加速了肿瘤的形成. 杜成友 et al[9]研究发现在肝癌患者中, 年龄越小, 肿瘤恶性程度越高, 预后越差. 本试验结果提示Raf-1表达较弱者以伴有癌栓、肿瘤较大且分化较差、属临床分期较晚的青壮年肝癌患者居多, 预后较差. 在病理学角度, 晚期肿瘤表现为异型性大, 胞核大而胞质少, Raf-1为胞质表达, 因此愈近晚期者Raf-1表达愈弱. 此外, 肿瘤进展过程中Raf-1持续过表达亦可刺激抑制性因子P21 cip 1(cdk interacting protein 1)表达, 使后者与CDK2或CDK4结合增多而阻滞细胞周期, 抑制细胞增殖, 亦可导致晚期者Raf-1表达减弱[10]. 因此, 结合Chambard et al的研究[11], Raf-1的高表达是肝癌形成的早期事件, 监测Raf-1在肝组织中的表达对肝癌早期诊断及评价肝癌患者的预后提供很大帮助.
Raf/MEK/ERK通路是丝裂原活化蛋白激酶(MAPK)信号转导众多通路中的一个, 为近年来细胞信号转导方面最活跃的研究领域. Raf-1为一种MAPK激酶激酶, 他的激活可以引起MAPK信号转导通路的活化, 促使细胞增殖周期失调, 形成肿瘤. 有关Raf-1在肿瘤组织中的表达研究报道很多, 因此, Raf-1被认为是肿瘤形成过程重要成分.
姜春萌, 教授, 大连医科大学附属第二医院消化科
Leicht et al研究显示Raf-1已经在多种人类肿瘤早期存在过表达, 如肺癌、肝癌、前列腺癌等. 李宗海 et al研究显示肿瘤进展过程中Raf-1持续过表达亦可刺激抑制性因子P21 cip 1表达, 使后者与CDK2或CDK4结合增多而阻滞细胞周期, 抑制细胞增殖, 亦可导致晚期者Raf-1表达减弱. 提示Raf-1可作为肝癌早期诊断的一个指标.
以往研究发现Raf-1的高表达与肝癌细胞增殖、肿瘤的形成有关, 并未具体涉及到其表达强弱与哪些临床病理资料有关、及临床分期对其表达的影响. 本课题组用免疫组化技术对其进行分析, 为肝癌的早期诊断及评价预后提供一个新的研究点.
本文研究发现, Raf-1的表达水平的升高在肝癌的发生、发展中起重要作用, 且Raf-1的高表达是肝癌形成的早期事件. 因此, 监测Raf-1在肝组织中的表达对肝癌早期诊断及评价肝癌患者的预后提供很大帮助.
本文具有一定新意, 设计严谨, 结果可靠, 为相关研究奠定了基础.
编辑: 史景红 电编:吴鹏朕
| 2. | Molina JR, Adjei AA. The Ras/Raf/MAPK pathway. J Thorac Oncol. 2006;1:7-9. [PubMed] [DOI] |
| 5. | Galmiche A, Fueller J. RAF kinases and mitochondria. Biochim Biophys Acta. 2007;1773:1256-1262. [PubMed] |
| 6. | Brummer T, Shaw PE, Reth M, Misawa Y. Inducible gene deletion reveals different roles for B-Raf and Raf-1 in B-cell antigen receptor signalling. EMBO J. 2002;21:5611-5622. [PubMed] [DOI] |
| 7. | Klysik J, Theroux SJ, Sedivy JM, Moffit JS, Boekelheide K. Signaling crossroads: the function of Raf kinase inhibitory protein in cancer, the central nervous system and reproduction. Cell Signal. 2008;20:1-9. [PubMed] [DOI] |
| 8. | Leicht DT, Balan V, Kaplun A, Singh-Gupta V, Kaplun L, Dobson M, Tzivion G. Raf kinases: function, regulation and role in human cancer. Biochim Biophys Acta. 2007;1773:1196-1212. [PubMed] |
| 10. | 李 宗海, 陈 主初. Ras/Raf/MEK/Erk通路调控细胞功能的机制. 国外医学•生理、病理科学与临床分册. 2000;20:12-14. |
| 11. | Chambard JC, Lefloch R, Pouysségur J, Lenormand P. ERK implication in cell cycle regulation. Biochim Biophys Acta. 2007;1773:1299-1310. [PubMed] |