修回日期: 2009-01-16
接受日期: 2009-01-19
在线出版日期: 2009-02-28
目的: 拟探讨RegⅣ基因在胃癌细胞中的表达及干扰该基因对胃癌细胞增殖和凋亡的影响.
方法: 应用实时定量PCR方法检测九株胃癌细胞株中RegⅣ基因的mRNA表达. 针对RegⅣ基因设计三条小干扰RNA片段(siRNA1、siRNA2、siRNA3), 瞬时转染高表达胃癌细胞株, 实时定量PCR方法检测转染后RegⅣ基因的mRNA的表达水平, CCK-8法检测细胞增殖能力, 流式细胞仪检测细胞凋亡.
结果: 以永生化正常胃黏膜细胞株GES-1作为参照, 除MKN-45和SNU-1胃癌细胞株外, 其余胃癌细胞株中RegⅣ表达水平均升高5倍以上, 尤以SNU-16细胞株明显, 其RegⅣ的表达水平高出GES-1细胞数千倍, 遂选用SNU-16细胞进行RNA干扰. 合成的三对siRNA对RegⅣ基因表达均有明显抑制作用, 抑制率分别为79.3%、77.4%和60.4%. 选用siRNA1干扰SNU-16细胞株后96 h和120 h, 其细胞增殖率受到明显抑制(P = 0.0057, 0.0173). 流式细胞仪检测显示72 h细胞凋亡率明显增加(P = 0.0231).
结论: 干扰RegⅣ基因具有抑制胃癌细胞增殖, 促进凋亡的作用, RegⅣ基因可能成为胃癌基因靶向治疗的分子靶点.
引文著录: 刘兵, 项明, 于颖彦, 杨秋蒙, 蔡劬, 陈雪华, 李建芳, 刘炳亚, 朱正纲. 体外RNA干扰抑制RegⅣ基因表达对胃癌细胞增殖及凋亡的影响. 世界华人消化杂志 2009; 17(6): 549-553
Revised: January 16, 2009
Accepted: January 19, 2009
Published online: February 28, 2009
AIM: To investigate RegⅣ expression level in human gastric cancer cell lines and the effect of RNA interfering of RegⅣ on proliferation and apoptosis of gastric cancer cells.
METHODS: The expression levels of RegⅣ in nine gastric cancer cell lines were examined by real time PCR, and 3 small interfering RNA (siRNA1, siRNA2, siRNA3) targeting RegⅣ were designed and transfected into gastric cancer cell lines. The changes of RegⅣ mRNA expression level after siRNA interfering were detected by real time PCR. The proliferation was assayed by CCK-8 method. Flow cytometry was used to detect apoptosis of gastric cancer cells.
RESULTS: Compared with gastric mucosa cell line GES-1, the expression level of RegⅣ in gastric cancer cells was 5-fold or higher except MKN-45 and SNU-1. The expression level of RegⅣ in SNU-16 was the highest and was several thousand-fold higher than that in GES-1. SNU-16 was used for siRNA experiment. Three siRNAs showed notably down-regulated expression of RegⅣ mRNA levels with inhibitory rate of 79.3%, 77.4% and 60.4%, respectively in comparison with that in control group. So siRNA1 was used to do cell proliferation assay. After 96 hours' and 120 hours' transfection of siRNA1, the proliferation of SNU-16 cell significantly decreased compared with the control group (P = 0.0057, 0.0173, respectively). The results of flow cytometry revealed that 72 h after transfection with siRNA1, the apoptosis rate of SNU-16 significantly increased.
CONCLUSION: Interfering and down-regulating RegⅣ gene can inhibit proliferation and promote apoptosis of gastric cancer cells, indicating that RegⅣ gene is probably a target for gastric cancer gene therapy.
- Citation: Liu B, Xiang M, Yu YY, Yang QM, Cai Q, Chen XH, Li JF, Liu BY, Zhu ZG. Influence of down-regulation of RegⅣ expression by small interfering RNA on proliferation and apoptosis of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 549-553
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/549.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.549
胃癌是最常见的恶性肿瘤之一, 在我国的发病率与死亡率多年居高不下, 其总体平均5年生存率仍未超过40%. 为寻找与胃癌治疗相关靶基因, 众多研究者进行了一系列探索, 筛选出若干候选基因, 其中RegⅣ(regenerating islet-derived family, member 4)便是在胃癌研究领域受到关注的靶基因之一[1]. RegⅣ基因是2001年在人类的一个炎症性肠病基因文库中筛选获得[2], 他是Reg家族的最新成员. 有实验通过SAGE(serial analysis of gene expression)技术发现RegⅣ在胃癌表达明显上调[3]. 有关其在胃癌发生发展中的详细作用机制目前尚不清楚. 本实验通过RNA干扰技术体外下调胃癌细胞株中RegⅣ的表达, 并检测干扰前后胃癌细胞的增殖能力以及凋亡的变化, 探讨RegⅣ基因对胃癌细胞增殖和凋亡的影响, 为寻找胃癌基因靶向治疗新靶点提供实验依据.
人胃癌细胞系(SGC-7901、AGS、MKN-45、MKN-28、BGC-823、NCI-N87、KATOⅢ、SNU-16、SNU-1)及永生化胃黏膜上皮细胞株GES-1由上海消化外科研究所传代保存. TRIzol试剂(Invitrogen, 美国)、分光光度计(Beckman, 美国)、逆转录试剂盒(Promega, 美国)、Lipofectamine2000TM(Invitrogen, 美国). 新生牛血清的RPMI 1640由杭州吉诺生物有限公司产品.
1.2.1 细胞培养: 用含100 mL/L新生牛血清的RPMI 1640进行常规培养, 待细胞融合度达80%, 消化收集细胞.
1.2.2 细胞总RNA抽提及RegⅣ mRNA检测: 使用TRIzol试剂抽提细胞总RNA. RNA经电泳鉴定完整性, 分光光度计测定RNA浓度. 使用逆转录试剂盒以1 μg总RNA逆转成cDNA. 引物序列: RegⅣ: 上游引物5'-AACAAGCACTGTGCTGAGATGAG-3', 下游引物5'-TGTTGGCGCTTGTTGCAT-3'; GAPDH内参引物: 上游引物5'-GGACCTGACCTGCCGTCTAG-3', 下游引物5'-GTAGCCCAGGATGCCCTTGA-3'. 使用试剂盒miScript SYBR Green PCR Kit(Qiagen, 美国)以1 μL cDNA在Opticon MonitorTM system荧光定量PCR仪中进行反应. 反应条件如下: 95℃预变性15 min, 94℃ 15 s, 55℃ 30 s, 70℃ 30 s, 40个循环. 计算检测结果: 实时定量PCR结果以Ct值表示, ΔCt为同一样本中内参与目的基因Ct之差, 某一样本中RegⅣ的表达水平用2ΔCt来表示. 若胃癌细胞中RegⅣ的表达水平是GES-1的1.5倍或以上则认为RegⅣ的表达升高.
1.2.3 小干扰RNA(siRNA)筛选: 委托上海吉马制药技术有限公司设计并合成3对针对RegⅣ基因的小干扰RNA(表1). 转染前1 d将SNU-16细胞以4×105/孔接种于6孔培养板, 细胞丰度达到80%左右时用Lipofectamine2000TM将siRNA转染入细胞. siRNA的终浓度为100 nmol/L, 参照Lipofectamine2000TM说明书进行转染操作. 在转染后24 h提取细胞总RNA, 用实时定量PCR(real time PCR)筛选一对最为有效的siRNA.
| siRNA编号 | 碱基序列 |
| siRNA1 | |
| 正义 | 5'-GAGUGUCAGUCUUACGGAATT-3' |
| 反义 | 5'-UUCCGUAAGACUGACACUCGA-3' |
| siRNA2 | |
| 正义 | 5'-GCACCAUAGCAGAGUACAUTT-3' |
| 反义 | 5'-AUGUACUCUGCUAUGGUGCTG-3' |
| siRNA3 | |
| 正义 | 5'-AGAUGAGCUCCAAUAACAATT-3' |
| 反义 | 5'-UUGUUAUUGGAGCUCAUCUCA-3' |
| 阴性对照 | |
| 正义 | 5'-UUCUCCGAACGUGUCACGUTT-3' |
| 反义 | 5'-ACGUGACACGUUCGGAGAATT-3' |
1.2.4 CCK-8(cell counting kit-8)检测细胞增殖: 取状态良好的SNU-16细胞铺于96孔板, 接种密度为3000个/孔, 实验设3组: 干扰组、阴性对照组、正常对照组, 每组4复孔. 作用24、48、72、96、120 h后于实验各孔分别加CCK-8试剂(Dojindo, Japan)10 μL, 37℃继续孵育3 h, 酶联免疫检测仪测定各孔的吸光度值(测定波长450 nm, 参比波长650 nm). 以时间为横坐标, 细胞A值为纵坐标绘制细胞生长曲线.
1.2.5 流式细胞仪检测细胞凋亡: 取状态良好的SNU-16细胞铺于6孔板, 接种密度为4×105个/孔. 实验设3组: 干扰组、阴性对照组、正常对照组, 每组2复孔. 72 h后应用Annexin V凋亡检测试剂盒(ADL, 美国)在流式细胞仪上检测细胞凋亡, 参照Annexin V凋亡检测试剂盒说明书进行操作.
统计学处理 采用SAS 6.0软件包, 各组间均数比较采用方差分析, 以P<0.05作为差异有显著意义.
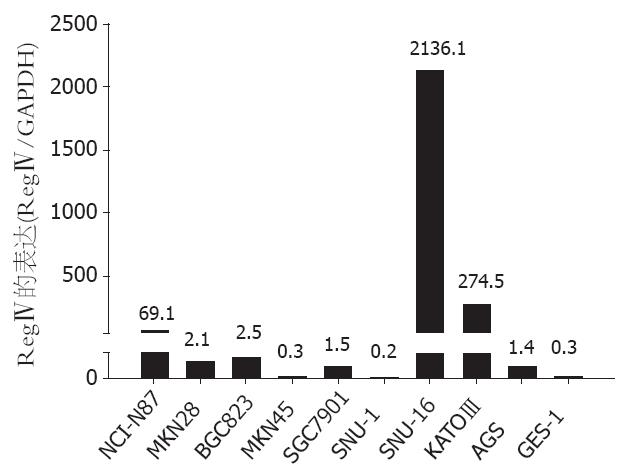
用实时定量PCR方法检测目的基因的mRNA表达水平. 经与永生化胃黏膜细胞株GES-1比较发现, 除了MKN-45和SNU-1以外, 其余胃癌细胞株中RegⅣ的表达水平均升高5倍左右或以上, 其中SNU-16细胞的RegⅣ表达水平比GES-1升高7120.333倍, 遂选用SNU-16细胞株做RNA干扰以及体外增殖及凋亡实验(图1).
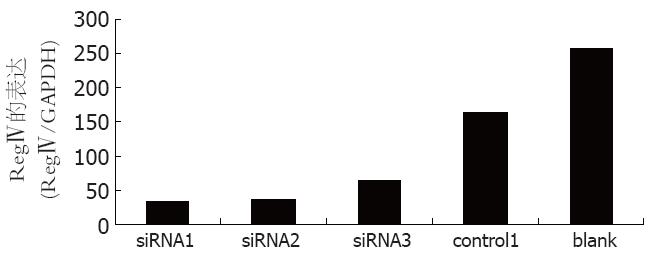
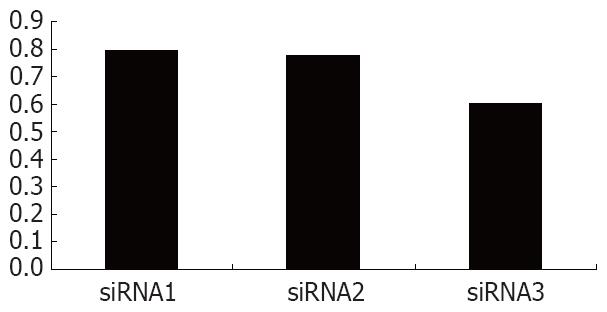
通过实时定量PCR发现, SNU-16细胞转染24 h后, 三对siRNA对RegⅣ基因的表达均有明显的抑制作用(图2). siRNA1、siRNA2、siRNA3三对小干扰RNA对RegⅣ的抑制效率分别为79.3%、77.4%和60.4%(图3). 因此选用siRNA1做后续的功能实验.
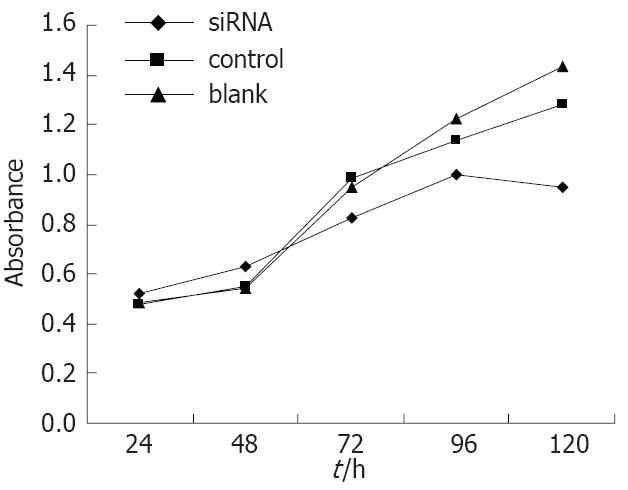
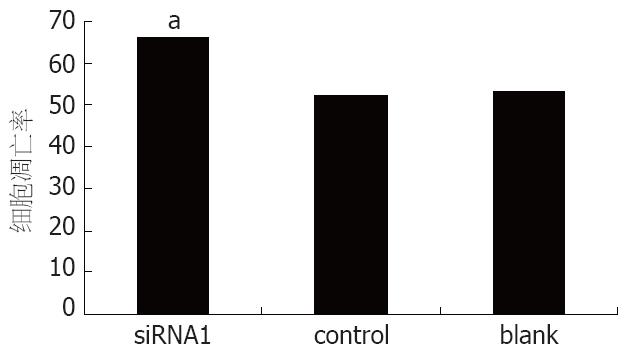
连续5 d测定siRNA转染组、阴性对照组、空白对照组细胞吸光度值, 绘制细胞生长曲线, 并对数值进行统计学分析. 在siRNA转染96 h和120 h后, siRNA干扰组较阴性对照组以及空白对照组相比, 细胞增殖明显受到抑制(P = 0.0057, 0.0173, 图4).
胃癌细胞转染siRNA 72 h后, 应用流式细胞仪检测siRNA转染组、阴性对照组、空白对照组细胞的凋亡水平发现, siRNA干扰组较阴性对照组以及空白对照组的细胞凋亡明显增加(P = 0.0231, 图5).
RegⅣ基因是2001年在人类的一个炎症性肠病基因文库中筛选得到的Reg家族最新成员. 该基因是位于1号染色体的单拷贝基因, 全长17 557 bp, 由6个外显子、5个内含子组成. RegⅣ cDNA由1518 bp组成, 其中编码区474 bp, 编码158个氨基酸, 分子质量18.229 kDa, 是Reg家族最小的成员[2-4]. 正常情况下RegⅣ主要在胃肠道表达, 如胃、小肠、结肠、胰腺等, 当组织损伤时其表达显著升高. Crohn's病以及溃疡性结肠炎所致的黏膜损伤时, RegⅣ的表达上调[2]. Oue et al[5]研究显示, 大约一半的胃癌组织过表达RegⅣ基因. 此外, Violette et al通过原位杂交等方法在结直肠癌和腺瘤中也发现RegⅣ过表达[6-8]. 本实验通过定量PCR检测9株胃癌细胞株中的RegⅣ的表达水平, 结果显示: 与永生化胃黏膜来源细胞株GES-1相比, 除MKN-45, SNU-1外, 其余7株胃癌细胞株中RegⅣ的表达均升高5倍以上, 提示RegⅣ基因在大多数胃癌细胞中高表达, 结果与Oue et al[5]的临床研究结果一致. 其中SNU-16细胞株中RegⅣ的表达异常高, 较GES-1升高了7120.333倍. SNU-16细胞株是来源于胃癌腹膜转移的细胞株, 本研究结果提示, RegⅣ基因过度表达可能参与胃癌的侵袭性生长和腹膜转移等生物学行为, 这与Miyagawa et al[9]报道的胃癌恶性腹水癌细胞中RegⅣ表达上调的结果一致.
目前对RegⅣ的病理生理功能研究甚少. Sentani et al[10]发现RegⅣ的免疫组化染色有助于胃肠印戒细胞癌的诊断. Oue et al[11]报道称RegⅣ的过表达与结直肠癌肝转移有关. 另外RegⅣ的表达可能与胃癌的小肠分化以及神经内分泌分化有关[12]. RNA干扰是近年来发展起来的一项用于基因功能、调控机制研究的新技术, 他通过合成的siRNA特异性的抑制某靶基因, 研究下调目的基因对细胞生物学行为的影响[13]. 本研究选用RegⅣ异常高表达SNU-16胃癌细胞株, 运用特异性siRNA进行干扰后通过细胞增殖实验发现, 转染siRNA 96 h和120 h后, RegⅣ干扰组较阴性对照组以及空白组相比, 细胞增殖活性明显受到抑制. 应用流式细胞仪检测siRNA干扰对凋亡的影响发现, 干扰RegⅣ基因72 h后, 干扰组较无关序列对照组以及空白组细胞凋亡率明显增加. 以上结果提示RegⅣ基因具有促进胃癌细胞增殖与抑制胃癌细胞凋亡的作用, 该发现与Mitani et al[14]研究结果类似, 他们的研究还发现, RegⅣ蛋白可以作为胃癌的一种血清学标志物并且有助于预测5-FU化疗的敏感性. 此外, Bishnupuri et al[15]在肠癌细胞株的研究中亦发现同样现象, 他们将重组人RegⅣ(rhR4)蛋白加入肠癌细胞株培养基中, 发现癌细胞增殖明显且与加入的重组人RegⅣ(rhR4)蛋白呈剂量依赖型增长. 另外有研究发现RegⅣ在溃疡性结肠炎的病理生理中起了促增殖和抗凋亡的作用[16].
总之, RegⅣ基因具有促胃癌细胞生长, 抑制胃癌细胞凋亡的作用, 并可能参与胃癌细胞的腹膜转移, 干扰RegⅣ基因表达具有抑制胃癌细胞增殖, 促进胃癌细胞凋亡作用, 这为RegⅣ基因成为胃癌靶向治疗新靶点提供了实验依据.
RegⅣ基因是2001年在人类的炎症性肠病基因文库中筛选得到的, 他是Reg家族最新成员. 正常情况下, RegⅣ主要在近端消化系有微弱的表达. 近年来有研究发现RegⅣ基因与胃癌的关系密切, 血中RegⅣ蛋白的水平可以作为胃癌患者对5-FU化疗敏感性的指标, 而且有实验发现大约有一半的胃癌中RegⅣ高表达.
熊斌, 教授, 武汉大学中南医院肿瘤科
目前关于RegⅣ生理病理方面的功能研究很少, 其在胃癌中的具体作用尚不清楚, 其可能是胃癌的一个新的治疗靶点, 所以RegⅣ的功能研究是非常有意义的.
Mitani et al的研究发现RegⅣ蛋白可以作为胃癌的一种血清学标志物并且有助于预测5-FU化疗的敏感性. RegⅣ蛋白的检测有助于胃癌化疗药物的选择, 对提高胃癌患者的生存期有重要意义.
本文检测了胃癌细胞株中RegⅣ的表达, 再运用RNA干扰技术研究RegⅣ在胃癌细胞增殖和凋亡中的作用, 为RegⅣ成为胃癌治疗的靶标提供了有力的证据.
本研究方法先进, 实验设计合理可靠, 实验证据充足, 结论明确, 有一定的理论意义和科学价值.
编辑: 李军亮 电编:何基才
| 1. | Lee S, Baek M, Yang H, Bang YJ, Kim WH, Ha JH, Kim DK, Jeoung DI. Identification of genes differentially expressed between gastric cancers and normal gastric mucosa with cDNA microarrays. Cancer Lett. 2002;184:197-206. [PubMed] [DOI] |
| 2. | Hartupee JC, Zhang H, Bonaldo MF, Soares MB, Dieckgraefe BK. Isolation and characterization of a cDNA encoding a novel member of the human regenerating protein family: Reg IV. Biochim Biophys Acta. 2001;1518:287-293. [PubMed] |
| 3. | Kämäräinen M, Heiskala K, Knuutila S, Heiskala M, Winqvist O, Andersson LC. RELP, a novel human REG-like protein with up-regulated expression in inflammatory and metaplastic gastrointestinal mucosa. Am J Pathol. 2003;163:11-20. [PubMed] |
| 4. | Li A, Crimmins DL, Luo Q, Hartupee J, Landt Y, Ladenson JH, Wilson D, Anant S, Dieckgraefe BK. Expression of a novel regenerating gene product, Reg IV, by high density fermentation in Pichia pastoris: production, purification, and characterization. Protein Expr Purif. 2003;31:197-206. [PubMed] [DOI] |
| 5. | Oue N, Hamai Y, Mitani Y, Matsumura S, Oshimo Y, Aung PP, Kuraoka K, Nakayama H, Yasui W. Gene expression profile of gastric carcinoma: identification of genes and tags potentially involved in invasion, metastasis, and carcinogenesis by serial analysis of gene expression. Cancer Res. 2004;64:2397-2405. [PubMed] [DOI] |
| 6. | Zhang Y, Lai M, Gu X, Luo M, Shao L. Reg IV, a differentially expressed gene in colorectal adenoma. Chin Med J (Engl). 2003;116:918-922. [PubMed] |
| 7. | Violette S, Festor E, Pandrea-Vasile I, Mitchell V, Adida C, Dussaulx E, Lacorte JM, Chambaz J, Lacasa M, Lesuffleur T. Reg IV, a new member of the regenerating gene family, is overexpressed in colorectal carcinomas. Int J Cancer. 2003;103:185-193. [PubMed] [DOI] |
| 8. | Zhang Y, Lai M, Lv B, Gu X, Wang H, Zhu Y, Zhu Y, Shao L, Wang G. Overexpression of Reg IV in colorectal adenoma. Cancer Lett. 2003;200:69-76. [PubMed] [DOI] |
| 9. | Miyagawa K, Sakakura C, Nakashima S, Yoshikawa T, Fukuda K, Kin S, Nakase Y, Shimomura K, Oue N, Yasui W. Overexpression of RegIV in peritoneal dissemination of gastric cancer and its potential as A novel marker for the detection of peritoneal micrometastasis. Anticancer Res. 2008;28:1169-1179. [PubMed] |
| 10. | Sentani K, Oue N, Tashiro T, Sakamoto N, Nishisaka T, Fukuhara T, Taniyama K, Matsuura H, Arihiro K, Ochiai A. Immunohistochemical staining of Reg IV and claudin-18 is useful in the diagnosis of gastrointestinal signet ring cell carcinoma. Am J Surg Pathol. 2008;32:1182-1189. [PubMed] [DOI] |
| 11. | Oue N, Kuniyasu H, Noguchi T, Sentani K, Ito M, Tanaka S, Setoyama T, Sakakura C, Natsugoe S, Yasui W. Serum concentration of Reg IV in patients with colorectal cancer: overexpression and high serum levels of Reg IV are associated with liver metastasis. Oncology. 2007;72:371-380. [PubMed] [DOI] |
| 12. | Oue N, Mitani Y, Aung PP, Sakakura C, Takeshima Y, Kaneko M, Noguchi T, Nakayama H, Yasui W. Expression and localization of Reg IV in human neoplastic and non-neoplastic tissues: Reg IV expression is associated with intestinal and neuroendocrine differentiation in gastric adenocarcinoma. J Pathol. 2005;207:185-198. [PubMed] [DOI] |
| 14. | Mitani Y, Oue N, Matsumura S, Yoshida K, Noguchi T, Ito M, Tanaka S, Kuniyasu H, Kamata N, Yasui W. Reg IV is a serum biomarker for gastric cancer patients and predicts response to 5-fluorouracil-based chemotherapy. Oncogene. 2007;26:4383-4393. [PubMed] [DOI] |
| 15. | Bishnupuri KS, Luo Q, Murmu N, Houchen CW, Anant S, Dieckgraefe BK. Reg IV activates the epidermal growth factor receptor/Akt/AP-1 signaling pathway in colon adenocarcinomas. Gastroenterology. 2006;130:137-149. [PubMed] [DOI] |
| 16. | Nanakin A, Fukui H, Fujii S, Sekikawa A, Kanda N, Hisatsune H, Seno H, Konda Y, Fujimori T, Chiba T. Expression of the REG IV gene in ulcerative colitis. Lab Invest. 2007;87:304-314. [PubMed] [DOI] |