修回日期: 2009-01-16
接受日期: 2009-01-19
在线出版日期: 2009-02-18
目的: 观察白介素-1受体相关激酶-M(IRAK-M)基因沉寂后RAW264.7细胞内毒素耐受性的改变, 进而探讨IRAK-M在内毒素耐受形成中的作用.
方法: 构建表达IRAK-M短发夹RNA(shRNA)的阳性重组质粒(pshIRAK-M-A)和阴性重组质粒(pshIRAK-M-B), 转染RAW264.7(小鼠单核巨噬细胞系)细胞; 各组细胞经10 μg/L脂多糖(LPS)预处理24 h后(或直接)用100 μg/L LPS刺激; 3 h后, 酶联免疫吸附法(ELISA)检测培养液中TNF-α水平, 逆转录聚合酶链反应(RT-PCR)检测细胞中的TNF-α mRNA表达水平, 蛋白印迹法(Western blotting)检测细胞中IRAK-M蛋白的表达, 凝胶电迁移率分析法(EMSA)检测细胞中NF-κB的活性.
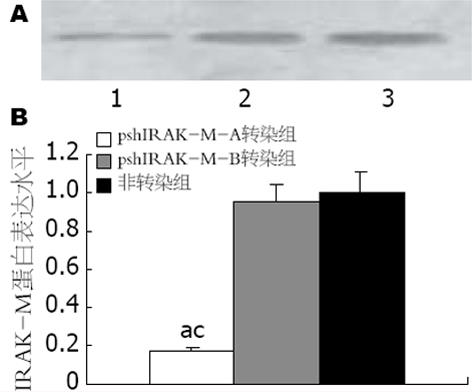
结果: pshIRAK-M-A对IRAK-M蛋白表达抑制率为83%左右, pshIRAK-M-B对IRAK-M蛋白表达无明显抑制作用; 两种转染细胞在用100 μg/L LPS直接刺激后, 其培养液中TNF-α水平、细胞内TNF-α mRNA表达及NF-κB活性无显著性差异; 两种转染细胞对LPS的再次应答均明显弱于初次应答细胞(P<0.05), 但pshIRAK-M-A转染组细胞对LPS的再次应答明显强于pshIRAK-M-B转染组细胞(P<0.05).
结论: IRAK-M表达受抑导致细胞内毒素耐受性减弱, IRAK-M在内毒素耐受形成中起重要作用.
引文著录: 李旭宏, 陈先锋, 游海波, 刘海忠, 刘作金, 龚建平. IRAK-M短发夹RNA对RAW264.7细胞内毒素耐受性的抑制作用. 世界华人消化杂志 2009; 17(5): 444-448
Revised: January 16, 2009
Accepted: January 19, 2009
Published online: February 18, 2009
AIM: To explore the role of IRAK-M in the development of endotoxin tolerance by silencing the gene of interleukin-1 receptor associated kinase-M (IRAK-M) in RAW264.7 cells by the specific short hairpin RNA (shRNA).
METHODS: The recombinant plasmids expressing effective shRNA (pshIRAK-M-A) or invalidated shRNA (pshIRAK-M-B) targeting IRAK-M gene were constructed and were transfected into RAW264.7 cells. Cells were stimulated by 100 μg/L LPS with or without 10 μg/L LPS pretreatment. At 3 h after LPS stimulation, the TNF-α level in culture medium was measured using ELISA, the expression of TNF-α mRNA was detected using RT-PCR, the expression of IRAK-M protein was detected by Western blotting and the activation of NF-κB was detected by electrophoretic mobility shift assay (EMSA).
RESULTS: The gene expression of IRAK-M in RAW264.7 cells was reduced about 83% by pshIRAK-M-A transfection. pshIRAK-M-B transfection hardly inhibited IRAK-M gene expression. At 3 h after 100 μg/L LPS stimulation, the TNF-α level in culture medium, the TNF-α mRNA expression and the NF-κB activity in cells had no significant difference between two kinds of transfected cells without LPS pretreatment. Two kinds of transfected cells both showed obviously attenuated response to 100 μg/L LPS stimulation after LPS pretreatment (P < 0.05), but this response was more intense in cells transfected by pshIRAK-M-A than in cells transfected by pshIRAK-M-B (P < 0.05).
CONCLUSION: The inhibition of IRAK-M gene expression results in the attenuation of endotoxin tolerance in RAW264.7 cells, and IRAK-M plays an important role in the development of endotoxin tolerance.
- Citation: Li XH, Chen XF, You HB, Liu HZ, Liu ZJ, Gong JP. Inhibitory effect of short hairpin RNA targeting IRAK-M gene for endotoxin tolerance in RAW264.7 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(5): 444-448
- URL: https://www.wjgnet.com/1009-3079/full/v17/i5/444.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i5.444
内毒素是G-细菌细胞壁上的脂多糖(lipopolysa-ccharide, LPS)成分, 能激活单核-巨噬细胞系统(mononuclear phagocytic system, MPS), 引起TNF-α等大量炎症介质释放, 导致全身过度炎症反应[1-3]. 针对内毒素性损害, 生物在长期进化过程中形成了一种内源性保护机制, 即内毒素耐受(endotoxin tolerance). 所谓内毒素耐受是指: 机体或单核-巨噬细胞受LPS初次刺激后, 对LPS的再次刺激呈低反应性[4-5]. 尽管该现象已被发现多年, 其形成机制仍有待明确. 近来有研究表明[6-8], 白介素-1受体相关激酶-M(interleukin-1 receptor associated kinase-M, RAK-M)可能参与内毒素耐受的形成, 但还需进一步证实. 本研究通过构建表达IRAK-M短发夹RNA(short hairpin RNA, shRNA)的重组质粒, 并转染RAW264.7细胞, 观察细胞内毒素耐受性的改变, 从而阐明IRAK-M在内毒素耐受形成中的作用.
RAW264.7细胞株购自中国科学院上海细胞生物研究所; JM109菌株及表达载体质粒pGenesil-1由重庆医科大学肝病研究所唐琳博士惠赠; 脂多糖(E.coli. O111:B4)购自美国Sigma公司; DMEM培养基及特级胎牛血清购自美国Hyclone公司; 兔抗IRAK-M多克隆抗体购自美国AnaSpec公司; 小鼠TNF-α ELISA试剂盒及Western blot检测试剂盒购自武汉博士德生物技术有限公司; 质粒抽提试剂盒WizardR PureFection Plasmid DNA Purification System购自美国Promega公司; 转染试剂盒Lipofectamine 2000为美国invitrogen公司产品; T4 DNA连接酶、限制性内切酶BamHⅠ、HindⅢ、XalⅠ及RT-PCR试剂盒为TaKaRa公司产品; NF-κB双链寡脱氧核苷酸探针由上海生工合成; 短发夹RNA所需寡核苷酸序列合成及测序由上海鼎安生物科技有限公司完成.
1.2.1 重组表达载体的构建: (1)shRNA的设计及合成: 获取GenBank中小鼠IRAK-M基因cDNA序列(AJ440757), 经Dharmacon公司siRNA设计软件设计出RNAi靶序列, 并通过BLAST检索其特异性; 根据载体pGenesil-1的酶切位点, 合成针对IRAK-M编码区285-303 bp的DNA片段; 阳性序列(A)正义链为: 5'-TCA ACG AGC TAT CCA CTT A-3', 反义链为: 5'-TAA GTG GAT AGC TCG TTG A-3'; 阴性序列(B)正义链为: 5'-TCA ACG AGC TAT CCA CTA T-3', 反义链为: 5'-ATA GTG GAT AGC TCG TTG A-3'; 茎环结构为9个与IRAK-M不互补的非同源碱基(TTCAAGACG), 末端终止子为TTTTTT, 在合成DNA片段末端设计BamHⅠ和Hind Ⅲ酶切位点, 合成IRAK-M的DNA片段如下: BamHⅠ+Sense+Loop+Antisense+终止信号+ Hind Ⅲ. 将合成的DNA片段及其带有相同酶切位点的互补序列分别溶于灭菌水中, 浓度为100 μmol/L, 每对互补链各取1 μL, 加入退火缓冲液, 95℃加热 5 min后, 冷却至室温, 使之形成双链DNA片段. (2)质粒重组: pGenesil-1以BamHⅠ和Hind Ⅲ双酶切, 经琼脂糖凝胶电泳证实酶切完全并回收, 用T4 DNA连接酶将双链DNA片段与回收的线性化载体进行连接, 即得重组表达载体. (3)重组表达载体的扩增及鉴定: 将重组质粒转化JM109感受态细菌后, 接种于含卡那霉素的LB琼脂糖平板, 挑取单菌落放入含卡那霉素的LB液体培养基中振荡扩增; 用Promega公司质粒抽提试剂盒WizardR PureFection Plasmid DNA Purification System提取重组质粒; 重组质粒通过BamHⅠ、Hind Ⅲ及XalⅠ酶切鉴定后选出阳性克隆, 经测序进一步证实重组表达载体构建成功.
1.2.2 细胞转染及实验分组: (1)细胞转染: 将RAW264.7细胞以108/L的密度接种至24孔培养板中; 48 h后, 细胞融合达80%-90%, 换用不含抗菌素的DMEM培养基培养过夜; 按说明书分别进行pshIRAK-M-A和pshIRAK-M-B转染; 24 h后, 在荧光显微镜下观察见胞质内有大量绿色荧光蛋白(EGFP)表达, 转染率达85%左右, 符合实验需要. (2)实验分组及处理: 转染细胞分组前处理: 分别用pshIRAK-M-A和pshIRAK-M-B转染RAW264.7细胞, 转染48 h后用1.25 g/L胰酶和0.1 mol/L EDTA消化细胞, 调整细胞浓度为108/L, 接种至24孔培养板, 每孔1 mL, 常规培育12 h. IRAK-M蛋白表达检测: 实验分为pshIRAK-M-A转染组, pshIRAK-M-B转染组及非转染组; 各组细胞先经10 μg/L LPS预处理24 h后, 再用100 μg/L LPS刺激3 h. 其他指标检测: 两种转染细胞各自分为非耐受组和耐受组; 非耐受组细胞常规培养24 h后, 用100 μg/L LPS刺激3 h; 耐受组细胞先经10 μg/L LPS预处理24 h后, 再用100 μg/L LPS刺激3 h.
1.2.3 指标检测: (1)培养液中TNF-α含量: 各组分别在相应时间收集培养上清液, 于-70℃保存备用; 采用武汉博士德生物技术有限公司的小鼠TNF-α ELISA试剂盒检测, 具体方法参见试剂盒说明书. (2)细胞中TNF-α的mRNA表达: 采用美国Life Technologies公司的TRIzol试剂盒提取Kupffer细胞总RNA; 用TaKaRa公司两步法逆转录聚合酶链反应(RT-PCR)试剂盒检测细胞中的mRNA表达; PCR引物由上海鼎安生物科技有限公司设计并合成. TNF-α引物: 上游5'-TCT ACT GAA CTT CGG GGT GA-3', 下游5'-AGT AGA CCT GCC CGG ACT C-3', 扩增产物大小为542 bp; 内参照β-actin引物: 上游5'-CAT TGT GAT GGA CTC CGG AG-3', 下游5'-ATA GTG ATG ACC TGG CCG TC-3', 扩增产物大小为300 bp. PCR条件为: 94℃ 45 s, 55℃ 1 min, 72℃ 1 min, 30个循环, 72℃延伸5 min. 扩增产物经15 g/L琼脂糖凝胶电泳后, 采用Gel Doc 2000凝胶成像系统成像进行结果分析, 结果以相对吸光度值 (RA)×面积(mm2)表示. mRNA相对含量 = (目的基因条带RA×mm2) /(β-actin条带RA×mm2). (3) EMSA检测细胞中NF-κB活性: 提取细胞核蛋白; 用[γ-32P]ATP标记NF-κB双链寡脱氧核苷酸探针(P1: 5'-AGT TGA GGG GAC TTT CCC AGG C-3'; P2: 5'-GCC TGG GAA AGT CCC CTC AAC T-3', 上海生工合成); 标记探针与核蛋白进行结合反应; 结合反应产物经70 g/L非解离聚丙烯酰胺凝胶电泳; 凝胶经固定及真空干燥后, 于-70℃放射自显影48 h; 采用Gel Doc 2000凝胶成像系统成像进行结果分析, NF-κB活性以相对吸光度值(RA)×面积(mm2)表示. (4)Western blot检测细胞中IRAK-M蛋白表达: 提取胞质蛋白并定量; 将蛋白经100 g/L SDS-聚丙烯酰胺凝胶电泳进行分离并电转印至硝酸纤维素(NC)膜; 将NC膜用含50 g/L脱脂奶粉的PBS-Tween液室温封闭1 h; 洗涤后, 与兔抗IRAK-M多克隆抗体溶液在37℃孵育2 h; 洗涤后, 再与辣根过氧化酶标记的羊抗兔IgG在37℃孵育1 h; 洗涤后, NC膜用二氨基联苯胺显色. 用Gel Doc 2000凝胶成像系统进行结果分析, 蛋白含量以相对吸光度值(RA)×面积(mm2) 表示.
统计学处理 实验数据以mean±SD表示, 组间比较采用SPSS10.0软件进行方差分析, P<0.05表示差异有显著性.
Western blot及其半定量分析显示, pshIRAK-M-A对IRAK-M蛋白表达的抑制率为83%左右, 而pshIRAK-M-B则对IRAK-M蛋白表达无明显抑制作用, 两者间有显著性差异(P<0.05, 图1).
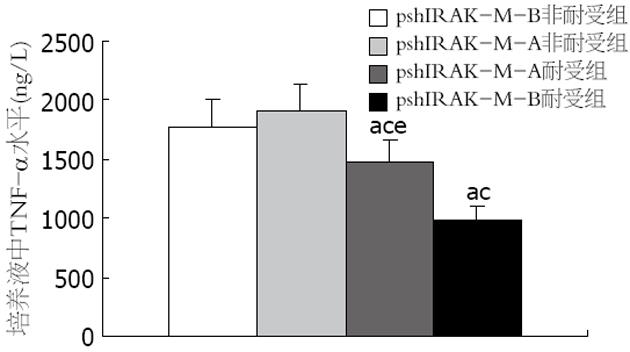
两组非耐受细胞在LPS刺激3 h后, 其培养液中的TNF-α水平无显著性差异(P>0.05). 两组耐受细胞在LPS刺激3 h后, 其培养液中的TNF-α水平均明显低于非耐受组细胞(P<0.05); 其中, pshIRAK-M-B组的TNF-α水平又明显低于pshIRAK-M-A组(P<0.05, 图2).
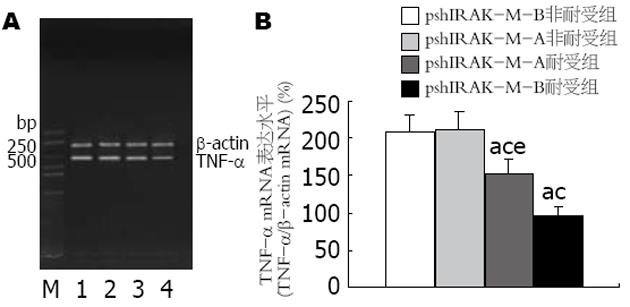
pshIRAK-M-A和pshIRAK-M-B两组非耐受细胞在LPS刺激3 h后, 细胞中TNF-α mRNA的表达水平相近(P>0.05). 两组耐受细胞在LPS刺激相同时间后, 细胞中的TNF-α mRNA表达水平分别为其非耐受细胞的72%和46%(P<0.05), pshIRAK-M-B组的表达水平明显低于pshIRAK-M-A组(P<0.05, 图3).
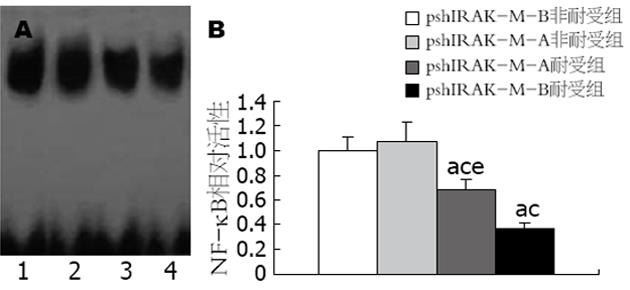
pshIRAK-M-A和pshIRAK-M-B两组非耐受细胞在LPS刺激3 h后, 细胞中的NF-κB活性无显著性差异(P>0.05). 两组耐受细胞在LPS刺激相同时间后, 细胞中的NF-κB活性分别为其非耐受组细胞的63%和37%(P<0.05), pshIRAK-M-B组的NF-κB活性显著低于pshIRAK-M-A组(P<0.05, 图4).
内毒素是G-细菌细胞壁上的LPS成分, 也是G-细菌最主要的致病物质. 通过激活单核-巨噬细胞系统, LPS能诱导大量炎症介质释放, 引起全身过度炎症反应, 从而造成机体损害[1-3]. 然而, 生物在长期进化过程中形成了内毒素耐受这种保护机制, 能抑制机体或细胞对LPS刺激产生持续过度的炎症应答, 从而对机体具有保护作用. 所谓内毒素耐受是指: 机体或单核-巨噬细胞经LPS初次刺激后, 对LPS的再次刺激呈低反应性[4-5]. 尽管内毒素耐受这一现象已被发现多年, 但对其发生机制至今仍未完全明确. 最近有研究表明, RAK-M主要在单核-巨噬细胞中表达, 对LPS信号通路起负性调节作用, 可能与内毒素耐受的形成有关[6-8]. 但也有研究发现, 通过转基因手段使IRAK缺陷型细胞表达IRAK-M后, 能在一定程度上恢复细胞对LPS的应答[9-10]. 因此, IRAK-M与内毒素耐受的关系还有待进一步阐明. RNA干扰(RNAi)机制主要是通过细胞内的Dicer酶将外源性dsRNA切割成21-23 nt的小干扰性RNA(short interfering RNA, siRNA), 后者介导与之同源的靶mRNA发生特异性降解, 从而阻断目的基因的表达[11-13]. 本研究利用转录载体pGenesil-1构建了能在哺乳动物细胞中产生针对IRAK-M的短发夹RNA(shRNA)的阳性重组质粒(pshIRAK-M-A)及阴性重组质粒(pshIRAK-M-B), 并得到限制性内切酶筛选和测序证实, 且能有效转染小鼠来源的巨噬细胞株RAW264.7细胞. pshIRAK-M-A对RAW264.7细胞IRAK-M基因表达的抑制强度为83%左右, 而pshIRAK-M-B对RAW264.7细胞的IRAK-M基因表达无抑制作用. 在此基础上, 本实验用pshIRAK-M-A沉寂RAW264.7细胞的IRAK-M基因, 观察细胞内毒素耐受性的改变, pshIRAK-M-B转染则作为阴性对照.
我们的研究发现, 经两种质粒转染的非耐受细胞受100 μg/L LPS刺激3 h后, 细胞中NF-κB活化、TNF-α mRNA表达以及培养液中的TNF-α水平均无显著性差异, 表明抑制IRAK-M基因表达对LPS初次刺激诱导的细胞炎症应答无明显影响, 其原因可能与细胞在对LPS初次应答时IRAK-M表达水平过低有关. 尽管如此, RNAi对RAW264.7细胞内毒素耐受性的影响却显而易见. 经pshIRAK-M-A转染的耐受细胞受100 μg/L LPS刺激3 h后, 细胞中NF-κB活性、TNF-α mRNA表达以及培养液中的TNF-α水平明显高于pshIRAK-M-B转染组, 表明抑制IRAK-M基因表达可减弱细胞的内毒素耐受性, 从而证实IRAK-M对内毒素耐受形成起重要作用. 值得注意的是, 经pshIRAK-M-A转染的耐受细胞对LPS的应答仍明显低于非耐受细胞, 表明RNAi并未完全消除LPS诱导的内毒素耐受现象. 对此, 我们考虑有以下两个原因: (1)RNAi并未能完全抑制IRAK-M的基因表达; (2)除IRAK-M之外, 内毒素耐受还有其它机制参与. 总之, 我们认为IRAK-M在内毒素耐受的形成中起重要作用, 其具体作用机制还有待深入研究.
内毒素又名脂多糖, 是G-细菌最重要的致病物质, 能激活单核-巨噬细胞系统并引起大量炎症介质释放, 导致全身过度炎症反应及器官损害. 内毒素耐受是生物在长期进化过程中形成的一种保守的负反馈调节机制, 能避免机体对脂多糖刺激的持续过度反应.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科
近来的研究表明, 白介素1受体相关激酶-M(IRAK-M)对脂多糖信号通路起负性调节作用, 可能参与内毒素耐受的形成机制.
本研究利用IRAK-M短发夹RNA抑制小鼠单核巨噬细胞系RAW264.7细胞的IRAK-M基因表达, 深入研究了IRAK-M与内毒素耐受的关系.
本研究证实IRAK-M对内毒素耐受的形成起重要作用, 为内毒素血症的临床治疗提供了潜在的干预靶点.
内毒素耐受: 指机体或单核-巨噬细胞受脂多糖初次刺激后, 对脂多糖的再次刺激呈低反应性.
本文做了大量的实验研究工作, 试图从基因层面探讨细胞内毒素的耐受性, 立题比较新颖, 实验设计思路清晰严谨, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Li L, Pan J, Yu Y. Development of sorbent therapy for multiple organ dysfunction syndrome (MODS). Biomed Mater. 2007;2:R12-R16. [PubMed] [DOI] |
| 2. | Chiao CW, Lee SS, Wu CC, Su MJ. Thaliporphine increases survival rate and attenuates multiple organ injury in LPS-induced endotoxaemia. Naunyn Schmied ebergs Arch Pharmacol. 2005;371:34-43. [PubMed] [DOI] |
| 3. | Martins JO, Ferracini M, Ravanelli N, Landgraf RG, Jancar S. Insulin inhibits LPS-induced signaling pathways in alveolar macrophages. Cell Physiol Biochem. 2008;21:297-304. [PubMed] [DOI] |
| 4. | West MA, Koons A. Endotoxin tolerance in sepsis: concentration-dependent augmentation or inhibition of LPS-stimulated macrophage TNF secretion by LPS pretreatment. J Trauma. 2008;65:893-898; discussion 898-900. [PubMed] [DOI] |
| 5. | Fan H, Cook JA. Molecular mechanisms of endotoxin tolerance. J Endotoxin Res. 2004;10:71-84. [PubMed] [DOI] |
| 6. | Tazi KA, Quioc JJ, Saada V, Bezeaud A, Lebrec D, Moreau R. Upregulation of TNF-alpha production signaling pathways in monocytes from patients with advanced cirrhosis: possible role of Akt and IRAK-M. J Hepatol. 2006;45:280-289. [PubMed] [DOI] |
| 7. | del Fresno C, Soler-Rangel L, Soares-Schanoski A, Gómez-Piña V, González-León MC, Gómez-García L, Mendoza-Barberá E, Rodríguez-Rojas A, García F, Fuentes-Prior P. Inflammatory responses associated with acute coronary syndrome up-regulate IRAK-M and induce endotoxin tolerance in circulating monocytes. J Endotoxin Res. 2007;13:39-52. [PubMed] [DOI] |
| 8. | Liu ZJ, Yan LN, Li XH, Xu FL, Chen XF, You HB, Gong JP. Up-regulation of IRAK-M is essential for endotoxin tolerance induced by a low dose of lipopolysaccharide in Kupffer cells. J Surg Res. 2008;150:34-39. [PubMed] [DOI] |
| 9. | Rosati O, Martin MU. Identification and characterization of murine IRAK-M. Biochem Biophys Res Commun. 2002;293:1472-1477. [PubMed] [DOI] |
| 10. | Wesche H, Gao X, Li X, Kirschning CJ, Stark GR, Cao Z. IRAK-M is a novel member of the Pelle/interleukin-1 receptor-associated kinase (IRAK) family. J Biol Chem. 1999;274:19403-19410. [PubMed] [DOI] |
| 11. | Parker GS, Maity TS, Bass BL. dsRNA binding properties of RDE-4 and TRBP reflect their distinct roles in RNAi. J Mol Biol. 2008;384:967-979. [PubMed] [DOI] |
| 12. | Collingwood MA, Rose SD, Huang L, Hillier C, Amarzguioui M, Wiiger MT, Soifer HS, Rossi JJ, Behlke MA. Chemical modification patterns compatible with high potency dicer-substrate small interfering RNAs. Oligonucleotides. 2008;18:187-200. [PubMed] [DOI] |
| 13. | Du Z, Lee JK, Tjhen R, Stroud RM, James TL. Structural and biochemical insights into the dicing mechanism of mouse Dicer: a conserved lysine is critical for dsRNA cleavage. Proc Natl Acad Sci U S A. 2008;105:2391-2396. [PubMed] [DOI] |