修回日期: 2009-01-06
接受日期: 2009-01-12
在线出版日期: 2009-02-08
目的: 检测CXCR4在胃肠道肿瘤中的表达状态, 探讨CXCR4在胃肠道肿瘤发病中的作用.
方法: 采用即时定量PCR(Real-time PCR)检测胃肠道肿瘤标本中CXCR4的表达. 采用逆转录PCR(RT-PCR)和Western blot检测CXCR4在胃肠道肿瘤细胞系中的表达.
结果: CXCR4 mRNA在24例结直肠癌组织标本的表达水平显著高于其配对的癌旁正常组织(P<0.001). CXCR4 mRNA在30例胃癌组织标本中的表达水平亦显著高于其配对的癌旁正常组织(P<0.001). CXCR4 mRNA和蛋白质在结肠癌细胞系HT-29和SW-480及胃癌细胞系SGC-7901和AGS中均存在明显表达. CXCR4表达与胃癌患者分期及淋巴结转移状态具有相关性(P = 0.01, 0.02).
结论: CXCR4在胃肠道肿瘤中存在过度表达, 其参与了胃肠道肿瘤的发病过程.
引文著录: 王佐周, 郭玉坤. 趋化因子受体CXCR4在胃肠道肿瘤组织及细胞系中的异常表达. 世界华人消化杂志 2009; 17(4): 421-424
Revised: January 6, 2009
Accepted: January 12, 2009
Published online: February 8, 2009
AIM: To determine the expression status of chemokine receptor CXCR4 in gastrointestinal cancer and to explore its role in gastrointestinal carcinogenesis.
METHODS: Real-time PCR was used to detect mRNA expression of CXCR4 in gastrointestinal cancer samples. Reverse-transcription PCR (RT-PCR) and Western blot were used to determine the expression of CXCR4 in gastrointestinal cancer cell lines.
RESULTS: Level of CXCR4 mRNA was significantly higher in 24 colorectal cancer samples than in matched normal tissues (P < 0.001). Level of CXCR4 mRNA was also significantly higher in 30 gastric cancer samples than in matched normal tissues (P < 0.001). Both CXCR4 mRNA and CXCR4 protein were expressed strongly in colon cell lines HT-29 and SW-480, and gastric cell lines SGC-7901 and AGS. CXCR4 expression was correlated significantly with staging and lymph node metastasis in gastric cancers (P = 0.01 and P = 0.02, respectively).
CONCLUSION: CXCR4 is over-expressed in gastrointestinal cancers, and plays a role in gastrointestinal carcinogenesis.
- Citation: Wang ZZ, Guo YK. Aberrant expression of chemokine receptor CXCR4 in gastrointestinal cancer tissues and cancer cell lines. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 421-424
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.421
胃肠道肿瘤是人类常见的肿瘤之一, 一直具有较高的发病率和致死率, 而较早出现转移则是导致胃肠道肿瘤不良预后的重要原因. 研究显示趋化因子及趋化因子受体在胃肠道肿瘤的发生发展过程中具有重要作用. 趋化因子受体是七次跨膜受体, 其家族根据氨基酸序列可分为四种类型, 即CR, CCR, CXCR和CX3CR. 由于白细胞表面能够表达趋化因子受体, 因此在趋化因子的作用下, 白细胞可发生定向的趋化运动, 参与炎症的发展过程.
近些年研究发现, 肿瘤细胞表面亦可表达趋化因子受体. 这些肿瘤细胞在趋化物质的作用下, 亦可出现定向的趋化运动, 并导致肿瘤出现转移. 目前研究显示趋化因子受体CXCR4[1-5]和CCR7[6-10]在多种肿瘤中存在过度表达, 表明这些趋化因子受体参与了肿瘤的发生发展过程. 本文将对胃肠道肿瘤中CXCR4的表达情况进行检测, 以探讨CXCR4在胃肠道肿瘤发生发展中的作用.
结直肠癌及相应的癌旁正常组织标本各24例, 胃癌及相应的癌旁正常组织标本各30例, 均来自于中国医科大学附属盛京医院. 标本获取后即冷冻于液氮之中, 并保存在-80℃条件下备用. 采用HE染色确定肿瘤标本主要由肿瘤组织构成, 癌旁正常组织没有肿瘤细胞浸润. 人类结肠癌细胞系HT-29和SW-480, 胃癌细胞系SGC-7901和AGS购自于南京凯基(KeyGen)生物科技发展公司.
1.2.1 细胞培养: 细胞系HT-29、SW-480、SGC-7901和AGS培养于RPMI 1640培养基中, 其中含有100 mL/L肽牛血清, 青霉素(100 IU/mL)及链霉素(100 mg/L), 于37℃下置于含有50 mL/L CO2的培养箱中.
1.2.2 RNA提取和逆转录PCR反应: 采用TRIzol试剂(TaKaRa公司)进行RNA提取, 具体步骤参照其说明书进行. 采用随机9引物和AMV逆转录酶进行逆转录反应. 反应体系共10 μL, 逆转录反应条件: 30℃, 10 min; 42℃, 25 min; 99℃, 5 min; 5℃, 5 min, 共1个循环. PCR总反应体系40 μL, 反应条件为: 94℃, 2 min, 1个循环. 94℃, 30 s; 59℃, 30 s; 72℃, 2 min, 共30个循环. CXCR4基因引物序列参见文献[5]. 内参基因GADPH的引物序列为正义: 5'-GGGAAACTGTGGCGTGAT-3'; 反义: 5'-AAAGGTGGAGGAGTGGGT-3'.
1.2.3 即时定量逆转录-RCR反应: 采用Light Cycler system及LightCycler DNA Master SYBR GreenⅠ试剂盒(Roche Diagnostics)进行即时定量逆转录PCR反应. 反应总体系为20 μL, 包括25 mmol/L MgCl2, 10 μmol/L forward引物, 10 μmol/L reverse引物, 2 μL LightCycler DNA Master SYBR GreenⅠ和2 μL cDNA. 采用比较CT值方法来定量基因表达, 即通过比较靶基因的CT值与内参基因GAPDH的CT值计算相对表达量. CXCR4与GAPDH引物序列同上.
1.2.4 Western blot: 使用裂解液裂解细胞, 收集样品蛋白. 取蛋白20 μg, 加入适量浓缩的SDS-PAGE蛋白上样缓冲液, 沸水浴加热3-5 min, 以充分变性蛋白. 冷却到室温后, 把蛋白样品直接上样到SDS-PAGE胶加样孔内, 进行凝胶电泳. 常规转膜. 将膜洗涤后, 用真空泵吸净洗涤液. 加入封闭液, 4℃过夜. 按1∶1000稀释CXCR4多克隆抗体(武汉博士得公司). 用真空泵吸净封闭液, 加入一抗. 4℃孵育过夜. 按1∶1000稀释加辣根过氧化物酶标记兔抗羊Ⅱ抗(武汉博士得公司). 吸净洗涤液以后, 加入二抗, 4℃孵育1 h.
统计学处理 统计分析采用SPSS13.0进行. 肿瘤组织与癌旁正常组织之间比较采用Mann-Whitney U-test. 采用Fisher's exact检验分析CXCR4表达与胃癌患者临床病理特征之间的相关性. P<0.05为有统计学意义.
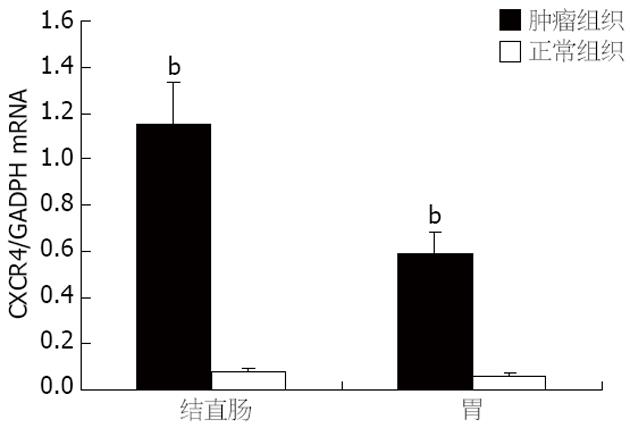
采用Real-time PCR对CXCR4 mRNA在胃肠道肿瘤组织及癌旁正常组织中的表达状态进行检测. 结果显示CXCR4 mRNA在结直肠癌组织中表达显著高于癌旁正常组织, 两者相差14.4倍(P<0.001). CXCR4 mRNA在胃癌组织中表达亦显著高于癌旁正常组织, 两者相差9.8倍(P<0.001, 图1).
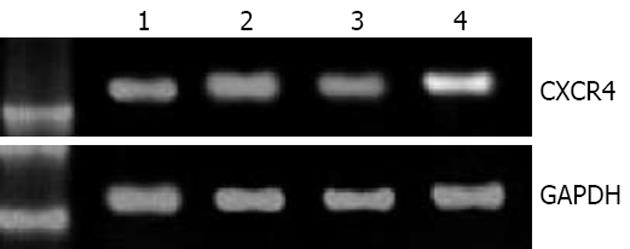
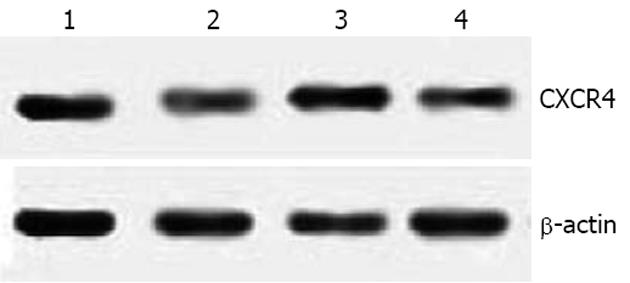
采用RT-PCR技术对CXCR4 mRNA在胃肠道肿瘤细胞系HT-29、SW-480、SGC-7901和AGS中表达情况进行检测. 结果显示CXCR4在这些肿瘤细胞中均有明显表达(图2). 采用Western blot技术对CXCR4蛋白在胃肠道肿瘤细胞系HT-29、SW-480、SGC-7901和AGS中表达情况进行检测. 结果显示CXCR4蛋白在这些肿瘤细胞中亦均有明显表达(图3).
肿瘤组织中CXCR4 mRNA表达水平为正常组织平均CXCR4 mRNA表达水平5倍以上时被定义为CXCR4表达阳性. 采用Fisher's检验, 我们对CXCR4表达与胃癌患者的临床病理特征之间的相关性进行分析. 按诊断时年龄进行年龄分组, >50为一组, ≤50为一组; 淋巴结转移状况按是否有转移进行分组; 在肿瘤分期上, 将T1和T2分为一组, T3和T4分为另一组; 组织类型上肠型为一组, 弥漫型为另一组. 结果显示, CXCR4表达与胃癌患者年龄、性别及组织类型均无相关性, 而与肿瘤分期(P = 0.01)、淋巴结转移情况(P = 0.02)具有相关性(表1).
| 因素 | n | CXCR4(+) | P |
| 性别 | 0.32 | ||
| 男 | 21 | 15 | |
| 女 | 9 | 6 | |
| 年龄(诊断时) | 0.29 | ||
| >50 | 18 | 12 | |
| ≤50 | 12 | 9 | |
| 分期 | 0.01 | ||
| T1T2 | 12 | 5 | |
| T3T4 | 18 | 16 | |
| 淋巴结转移情况 | 0.02 | ||
| N0 | 13 | 6 | |
| N1-N3 | 17 | 15 | |
| 组织类型 | 0.27 | ||
| 肠型 | 11 | 7 | |
| 弥漫型 | 19 | 14 |
胃肠道肿瘤是人类常见的肿瘤之一, 在我国一直具有较高的发病率和致死率. 胃肠道恶性肿瘤发病的分子机制非常复杂, 涉及到多重基因突变或表达改变, 其中包括抑癌基因失活和原癌基因激活等. 这些基因表达改变导致细胞增殖过度和凋亡减弱, 从而导致细胞出现失控性生长. 在临床上, 部分胃肠道恶性肿瘤较早出现转移, 进展迅速, 增加了治疗难度, 导致预后不良. 研究发现, 这些肿瘤细胞表面常常出现了部分趋化因子或趋化因子受体的过度表达, 提示这些趋化因子及其受体参与了胃肠道肿瘤的发展过程.
趋化因子受体家族根据氨基酸序列可分为四种类型, 即CR, CCR, CXCR和CX3CR. 由于白细胞对某种特殊趋化因子的反应能力依赖于其细胞表面所表达的趋化因子受体. 在趋化因子受体作用下, 白细胞向趋化因子所在部位进行运动, 参与炎症的发展过程. 近些年研究发现, 肿瘤细胞表面亦可表达趋化因子受体, 这些受体包括CXCR4、CXCR3[11-12]、CCR10[13]、CCR9[14-15]、CCR7、CCR4[16]和CCR3[17]等. 其中CXCR4的研究最为广泛, 其已被发现参与了多种肿瘤的发病过程. 研究显示CCL21(一种CCR7配体)和CXCL12(一种CXCR4配体)在淋巴结、肺和肝脏等组织中高度表达, 故表达CCR7和CXCR4的肿瘤常常转移到这些部位.
在本研究中, 我们对CXCR4在胃肠道肿瘤中的表达情况进行了研究. 我们采用即时定量PCR对肿瘤组织及其配对的癌旁正常组织中CXCR4 mRNA进行了定量检测. 结果显示CXCR4在结直肠癌组织标本及胃癌组织标本中均出现过度表达, 其表达量均显著高于其配对的癌旁正常组织. 同时在对部分结肠癌及胃癌细胞系的研究中亦发现, CXCR4 mRNA和CXCR4蛋白在这些胃肠道肿瘤细胞系中均存在明显表达. 在对CXCR4表达与胃癌患者临床病理特征之间的相关性分析中发现, CXCR4表达与胃癌患者分期及淋巴结转移中具有相关性. 综合以上结果显示, CXCR4在胃肠道肿瘤中存在过度表达. 结果提示CXCR4的过度表达, 可能促进胃肠道肿瘤较早发生转移, 从而加速了胃肠道肿瘤的进展过程.
肿瘤细胞表面可表达趋化因子受体. 这些肿瘤细胞在趋化物质的作用下, 亦可出现定向的趋化运动, 并导致肿瘤出现转移.
钱睿哲, 教授, 复旦大学上海医学院生理与病理生理学系血管分子生物学实验室; 于颖彦, 教授, 上海交通大学医学院附属瑞金医院消化外科研究所与器官移植中心
本文采用即时定量PCR技术对CXCR4在胃肠道肿瘤中的表达进行了定量检测, 同时对部分胃肠道肿瘤细胞系也进行了研究, 故而全面、准确地探讨了CXCR4在胃肠道肿瘤中的表达状况及其在胃肠道肿瘤发展过程中的作用.
本研究选题新颖, 实验技术手段较为先进, 结果具有一定的意义.
编辑: 李军亮 电编:何基才
| 1. | Kodama J, Hasengaowa , Seki N, Kusumoto T, Hiramatsu Y. Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer. Eur J Gynaecol Oncol. 2007;28:370-375. [PubMed] |
| 2. | Pan J, Mestas J, Burdick MD, Phillips RJ, Thomas GV, Reckamp K, Belperio JA, Strieter RM. Stromal derived factor-1 (SDF-1/CXCL12) and CXCR4 in renal cell carcinoma metastasis. Mol Cancer. 2006;5:56. [PubMed] [DOI] |
| 3. | Engl T, Relja B, Marian D, Blumenberg C, Müller I, Beecken WD, Jones J, Ringel EM, Bereiter-Hahn J, Jonas D. CXCR4 chemokine receptor mediates prostate tumor cell adhesion through alpha5 and beta3 integrins. Neoplasia. 2006;8:290-301. [PubMed] [DOI] |
| 4. | Salvucci O, Bouchard A, Baccarelli A, Deschênes J, Sauter G, Simon R, Bianchi R, Basik M. The role of CXCR4 receptor expression in breast cancer: a large tissue microarray study. Breast Cancer Res Treat. 2006;97:275-283. [PubMed] [DOI] |
| 5. | Scala S, Ottaiano A, Ascierto PA, Cavalli M, Simeone E, Giuliano P, Napolitano M, Franco R, Botti G, Castello G. Expression of CXCR4 predicts poor prognosis in patients with malignant melanoma. Clin Cancer Res. 2005;11:1835-1841. [PubMed] [DOI] |
| 6. | Ishigami S, Natsugoe S, Nakajo A, Tokuda K, Uenosono Y, Arigami T, Matsumoto M, Okumura H, Hokita S, Aikou T. Prognostic value of CCR7 expression in gastric cancer. Hepatogastroenterology. 2007;54:1025-1028. [PubMed] |
| 7. | Mashino K, Sadanaga N, Yamaguchi H, Tanaka F, Ohta M, Shibuta K, Inoue H, Mori M. Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma. Cancer Res. 2002;62:2937-2941. [PubMed] |
| 8. | Wilson JL, Burchell J, Grimshaw MJ. Endothelins induce CCR7 expression by breast tumor cells via endothelin receptor A and hypoxia-inducible factor-1. Cancer Res. 2006;66:11802-11807. [PubMed] [DOI] |
| 9. | Heresi GA, Wang J, Taichman R, Chirinos JA, Regalado JJ, Lichtstein DM, Rosenblatt JD. Expression of the chemokine receptor CCR7 in prostate cancer presenting with generalized lymphadenopathy: report of a case, review of the literature, and analysis of chemokine receptor expression. Urol Oncol. 2005;23:261-267. [PubMed] [DOI] |
| 10. | Mori T, Kim J, Yamano T, Takeuchi H, Huang S, Umetani N, Koyanagi K, Hoon DS. Epigenetic up-regulation of C-C chemokine receptor 7 and C-X-C chemokine receptor 4 expression in melanoma cells. Cancer Res. 2005;65:1800-1807. [PubMed] [DOI] |
| 11. | Kawada K, Hosogi H, Sonoshita M, Sakashita H, Manabe T, Shimahara Y, Sakai Y, Takabayashi A, Oshima M, Taketo MM. Chemokine receptor CXCR3 promotes colon cancer metastasis to lymph nodes. Oncogene. 2007;26:4679-4688. [PubMed] [DOI] |
| 12. | Ocaña E, Delgado-Pérez L, Campos-Caro A, Muñóz J, Paz A, Franco R, Brieva JA. The prognostic role of CXCR3 expression by chronic lymphocytic leukemia B cells. Haematologica. 2007;92:349-356. [PubMed] [DOI] |
| 13. | Notohamiprodjo M, Segerer S, Huss R, Hildebrandt B, Soler D, Djafarzadeh R, Buck W, Nelson PJ, von Luettichau I. CCR10 is expressed in cutaneous T-cell lymphoma. Int J Cancer. 2005;115:641-647. [PubMed] [DOI] |
| 14. | Singh S, Singh UP, Stiles JK, Grizzle WE, Lillard JW Jr. Expression and functional role of CCR9 in prostate cancer cell migration and invasion. Clin Cancer Res. 2004;10:8743-8750. [PubMed] [DOI] |
| 15. | Letsch A, Keilholz U, Schadendorf D, Assfalg G, Asemissen AM, Thiel E, Scheibenbogen C. Functional CCR9 expression is associated with small intestinal metastasis. J Invest Dermatol. 2004;122:685-690. [PubMed] [DOI] |
| 16. | Ishida T, Ishii T, Inagaki A, Yano H, Kusumoto S, Ri M, Komatsu H, Iida S, Inagaki H, Ueda R. The CCR4 as a novel-specific molecular target for immunotherapy in Hodgkin lymphoma. Leukemia. 2006;20:2162-2168. [PubMed] [DOI] |
| 17. | Jöhrer K, Zelle-Rieser C, Perathoner A, Moser P, Hager M, Ramoner R, Gander H, Höltl L, Bartsch G, Greil R. Up-regulation of functional chemokine receptor CCR3 in human renal cell carcinoma. Clin Cancer Res. 2005;11:2459-2465. [PubMed] [DOI] |