修回日期: 2009-01-07
接受日期: 2009-01-12
在线出版日期: 2009-02-08
目的: 探讨表没食子儿茶素没食子酸酯[(-)- epigallocatechin-3-gallate, EGCG)]对缺氧诱导的肝细胞癌HepG2细胞HIF-1α及VEGF表达的影响.
方法: 在缺氧条件体外培养肝细胞癌HepG2细胞16 h, 并以不同浓度EGCG处理, 即低剂量(10 μmol/L)、中剂量(50 μmol/L)、高剂量(100 μmol/L), 制成细胞爬片以免疫组化SABC法检测HIF-1α及VEGF表达的变化, 同时设常氧组及缺氧对照组进行比较.
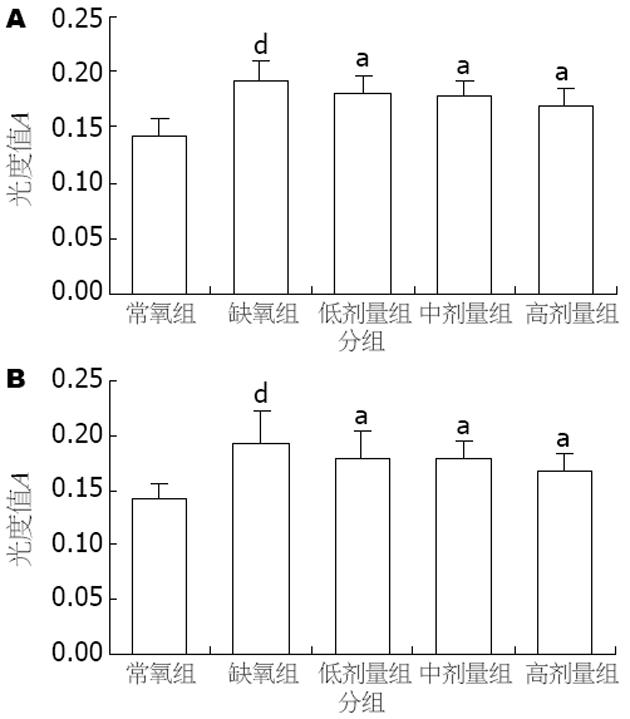
结果: 常氧状态下HepG2细胞中HIF-1α几乎无表达, VEGF有少量表达. 缺氧对照组经16 h缺氧后HIF-1α表达明显上调, 与常氧组相比有显著差异(t = 3.579, P<0.01); VEGF表达亦较常氧组明显上调, 两者有明显差异(t = 6.372, P<0.01). 同浓度的EGCG对缺氧各组细胞HIF-1α及VEGF表达, 与缺氧对照组相比均有不同明显抑制作用(HIF: F = 56.818, P<0.05; VEGF: F = 10.016, P<0.05), EGCG对HIF-1α及VEGF表达的抑制作用呈剂量依赖性, 且相关分析显示, HIF-1α及VEGF蛋白表达同步化(r = 0.617, P<0.05).
结论: EGCG可从蛋白水平下调缺氧诱导的HepG2细胞HIF-1α及VEGF的表达水平, 从而有可能抑制肿瘤血管新生.
引文著录: 王熙, 谢纪文, 刘礼. 表没食子儿茶素没食子酸酯对缺氧诱导的肝细胞癌HepG2细胞HIF-1α及VEGF蛋白表达的影响. 世界华人消化杂志 2009; 17(4): 357-361
Revised: January 7, 2009
Accepted: January 12, 2009
Published online: February 8, 2009
AIM: To explore the effect of (-)-epigallocatechin-3-gallate (EGCG) on hypoxia-induced expression of hypoxia inducible factor 1 alpha (HIF-1α) and vascular endothelial growth factor (VEGF) in human hepatoma line HepG2 cells.
METHODS: The human hepatoma line HepG2 cells were cultured under hypoxic conditions in vitro. The cultured cells were treated with different concentrations of EGCG for 16 h in the 6-well dish with coverslips. The expression of HIF-1α and VEGF proteins were determined by immunohistochemical staining. HepG2 cells were also cultured in normal oxygen condition as normal control group and in hypoxic condition without EGCG as hypoxia control group.
RESULTS: Under normal condition, there was almost no HIF-1α protein expression and weak VEGF protein expression in HepG2 cells. Hypoxia significantly induced up-regulation of the expression of both HIF-1α and VEGF (t = 3.579, P < 0.01; t = 6.372, P < 0.01, respectively). Compared with hypoxia control group, marked inhibitory effect on both HIF-1α and VEGF expression in all hypoxia groups was observed by EGCG at a definite concentration (HIF: F = 56.818, P < 0.05; VEGF: F = 10.016, P < 0.05). The inhibition by EGCG on HIF-1α and VEGF expression showed a dose-dependent relationship. Additionally, correlation analysis showed that HIF-1α expression synchronized with VEGF expression (r = 0.617, P < 0.05).
CONCLUSION: EGCG has significant inhibitory effects on the protein expression of HIF-1α and VEGF induced by hypoxia in a dose-dependent manner.
- Citation: Wang X, Xie JW, Liu L. Effect of (-)-epigallocatechin-3-gallate on hypoxia-induced expression of HIF-1α and VEGF protein in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 357-361
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.357
原发性肝癌是我国发病率最高的恶性肿瘤之一, 并且有逐年增高的趋势, 其中肝细胞肝癌占原发性肝癌的90%以上. 实体肿瘤的生长和转移有赖于血管生成[1], 经典的血管生成理论认为, 当瘤体直径大于2 mm时需要构建新生血管获取血供, 否则肿瘤会因为缺血缺氧发生坏死, 因此抗肿瘤血管生成逐渐成为抗肿瘤治疗的新手段. 缺氧诱导因子(hypoxia inducible factor-1, HIF-1)是近年来发现的一个普遍存在于人和哺乳动物细胞内的缺氧应答调控因子, 研究表明他与其下游靶基因血管内皮生长因子VEGF, 在肿瘤缺氧状态下维持生长及转移起着关键作用[2]. 茶多酚是从绿茶中提取出来的最主要的对人体最有益成分, 近来大量研究表明茶多酚尤其主要成分表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate, EGCG]对肿瘤的生长有明显的抑制作用[3], 其机制是否与下调HIF-1α及VEGF表达有关可能成为EGCG抑制肿瘤转移的新靶点. 本文拟在体外培养HepG2肝癌细胞并建立缺氧模型, 通过给与不同浓度的EGCG, 观察对HepG2细胞中HIF-1α及VEGF表达的影响, 以探讨EGCG是否能成为辅助治疗肝细胞癌的有效候选药物.
HepG2细胞系由协和医院普外科实验室传代培养, 为贴壁细胞. 高糖DMEM培养基(武汉博士德生物工程有限公司); 胎牛血清(杭州四季青公司); 鼠抗mAb HIF-1α抗体、鼠抗mAb VEGF抗体(美国Santa Cruz公司), 工作浓度均为1∶40; SABC试剂盒(武汉博士德生物工程有限公司); EGCG(美国Sigma公司)纯度>95%绿茶提取, 以无血清DMEM培养基稀释成浓度为0.02 mol/L的储存液保存于-80℃冰箱备用, 使用前以无血清DMEM培养基配成实验所需浓度; 免疫组化分析软件系统: HMIAS-2000高清晰度彩色医学图文分析系统(华中科技大学同济医学院清屏影像公司).
1.2.1 细胞培养: HepG2细胞生长于含100 mL/L胎牛血清DMEM培养基中, 常氧组在50 mL/L CO2, 210 mL/L O2, 37℃饱和湿度培养箱内, 缺氧组在50 mL/L CO2, 10 mL/L O2, 饱和湿度三气培养箱中培养.
1.2.2 爬片制作及分组: 取对数生长期HepG2细胞以2.5 g/L胰酶消化成单细胞悬液反复吹打, 并计数后种于含有多聚赖氨酸包被盖玻片(约1 mm×1 mm×3片)的六孔板内, 每孔加入2 mL完全培养基, 培养24 h待80%细胞贴壁后换液, 根据下述分组要求加入不同体积培养基及药物. 常氧组换液后仍每孔给予2 mL完全培养基培养, 缺氧组以终浓度分别为10 μmol/L, 50 μmol/L, 100 μmol/L即低剂量、中剂量、高剂量含药培养基2 mL, 并设缺氧对照组(加等量无药培养基), 预处理1 h后置缺氧环境继续培养16 h.
1.2.3 细胞固定及SABC免疫组化: 处理后各组爬片弃去培养液→PBS漂洗3次(5 min/次)→40 g/L多聚甲醛固定30 min→PBS洗3次(5 min/次)→固定好的爬片以3 g/L H2O2甲醇液消除内源性过氧化物酶→羊血清封闭特异性抗体→加入HIF-1α及VEGF抗体→4℃孵育过夜→加入二抗和SABC(1∶100)→DAB显色→常规脱水透明封片.
1.2.4 图像分析: 在图像分析监视器上对染色强度作区域性测定, 随机选取5个视野分别输入图像仪. 染色强度用吸光度值(A)表示. 每例共检测10个细胞, 取其平均值代表阳性细胞A值.
统计学处理 所有实验数据均以mean±SD表示. 采用SPSS13.0进行数据录入和统计分析. 组内比较采用单因素方差分析LSD方法, 相关分析采用Pearson相关分析法. 以P<0.05为差异有统计学意义.
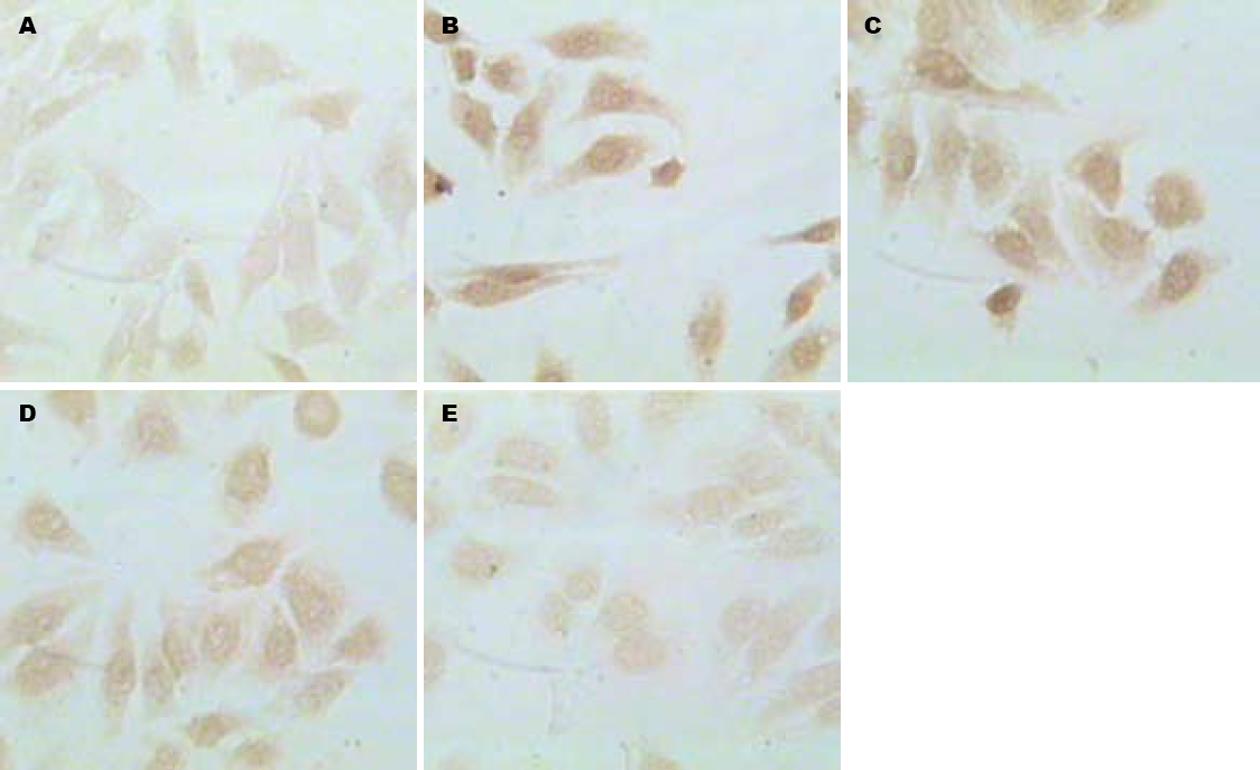
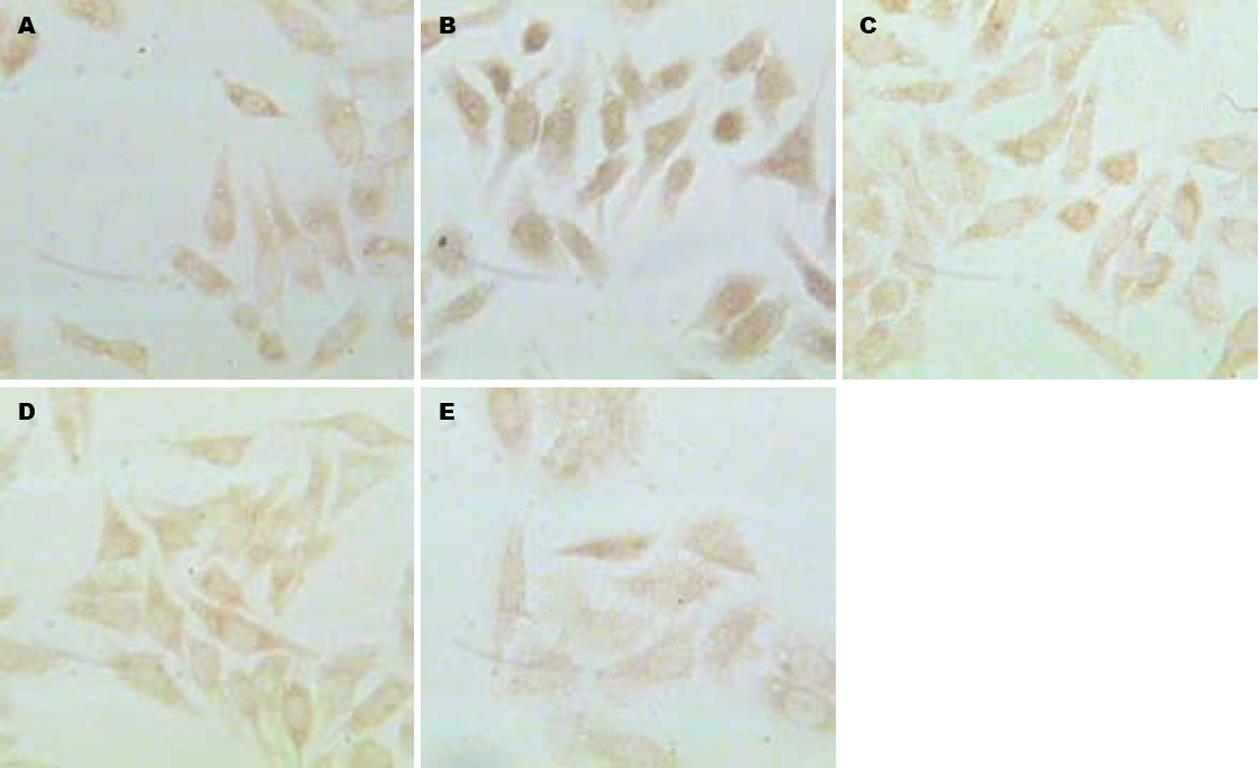
常氧状态下HepG2细胞中HIF-1α几乎无表达, VEGF有少量表达, 阳性表达为棕黄色, 主要分布于细胞质, 细胞核也可见. 缺氧对照组经16 h缺氧后HIF-1α表达明显上调, 呈棕黄色, 主要位于细胞核, 与常氧组相比有显著差异(t = 3.579, P<0.01); VEGF表达亦较常氧组明显上调, 颜色加深, 两者有明显差异(t = 6.372, P<0.01, 图1-3).
同浓度的EGCG对缺氧各组细胞HIF-1α及VEGF表达, 与缺氧对照组相比均有不同明显抑制作用(HIF: F = 56.818, P<0.05; VEGF: F = 10.016, P<0.05), EGCG对HIF-1α及VEGF表达的抑制作用呈剂量依赖性, 且相关分析显示, HIF-1α及VEGF蛋白表达同步化(r = 0.617, P<0.05, 表1).
人体肿瘤大多为实体瘤, 由瘤细胞和间质构成. 实体瘤间质主要包括血管、淋巴管、结缔组织、炎细胞和胞外基质等, 其中血管起营养肿瘤细胞的作用. 由于肿瘤细胞不断恶性增殖导致局部血供不足, 血管比例失调, 瘤体组织出现缺氧状态. 在缺氧条件下, 肿瘤细胞为了继续生长, 启动一系列缺氧适应性反应, 其中就包括缺氧诱导因子-1(HIF-l). HIF-1由120 kDa的α亚单位(HIF-lα)和91-94 kDa的β亚单位(HIF-1β)组成的异源二聚体结构. 研究表明, HIF-1α是唯一的氧调节亚单位, 他决定HIF-1的活性. 而HIF-1β是许多bHLH蛋白的共同亚单位, 他可能与稳定HIF-1及其二聚化有关. 常氧状态下, 细胞虽然不断地合成HIF-1α, 但由于他受泛素蛋白酶体系统(ubiquitin-proteasomesystem)的作用迅速降解, 很难检测到[4], 而在缺氧时则出现降解抑制[5]. 周围环境的氧浓度下降时, HIF-lα表达增加, 且表达的增加表现为多个水平上. 目前, 缺氧在哪个水平上影响HIF-lα仍有争论. 在缺氧状态下HIF-1α大量表达并与缺氧反应元件HREs结合, 促进靶基因转录[6], 血管内皮生长因子VEGF就是其中影响肿瘤生长重要的靶基因之一. VEGF是迄今认为重要的血管生成诱导因子, VEGF能强烈地刺激血管内皮细胞增生、迁移和形成新生血管. 研究表明, 在许多实体肿瘤, 包括胃肠道肿瘤、子宫颈癌以及肺癌中都存在活跃的血管生成, 并发现其血管生成的活跃程度与这些肿瘤的预后相关[7-8]. VEGF作为主要的促血管新生因子, 在缺氧状态下HIF-1α大量表达不仅能使其表达上调而且能增加其转录活性[9]. 因此抑制HIF-1α及VEGF表达有可能通过抗血管生成途径作为抗肿瘤的新的治疗方法.
绿茶是一类普遍存在于自然界的黄酮类物质, 茶多酚是茶叶药效的主要活性成分, 占茶叶干质量20%-35%, 其主要组分为儿茶素, 占其总量的80%左右, 其中EGCG含量最高, 占儿茶素的50%左右. 众多的研究表明, EGCG在肿瘤的防治中有重要作用, 其抑癌机制包括抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和抑制端粒酶的活性等. 除此之外, 还有研究表明他能够在多种肿瘤模型包括子宫癌, 前列腺癌中[10-11], 通过抑制血管生成达到抑瘤效应, 其机制有可能与抑制VEGF生成及其受体活性有关[12], 但并不十分明确. 另外也有研究表明EGCG通过抑制胰岛素样生长因子及其受体IGF/IGF-1R系统活化达到抗肝细胞肝癌的作用[13], 由此证实, EGCG对肝细胞肝癌也有较强的抗肿瘤作用. 本实验选取不同浓度的EGCG, 观察其对肝细胞癌细胞HepG2中HIF-1α及VEGF的影响, 结果发现正常氧分压下HIF-1α蛋白几乎无表达, VEGF有少量蛋白表达, 而缺氧状态下两者表达水平明显上调, 较小剂量(10 mmol/L)EGCG对二者即有抑制作用, 且其作用有明显剂量依赖性, 改变趋势亦成正相关, 说明EGCG作用方式与HIF-1α-VEGF途径有关. 而即使是高剂量组(100 mmol/L)药物水平干预下, 细胞形态并未出现明显改变, 说明其作用不会引起细胞损伤并影响实验结果, 此作用可能与阻止HIF-1α与缺氧反应元件HRE有关, 但究竟在何种时期及水平产生HIF-1α抑制作用有待进一步考究.
本实验研究提示, 绿茶茶多酚活性物质EGCG能够对缺氧诱导的HepG2细胞HIF-1α及VEGF基因表达产生明显下调作用, 可为抗血管生成抑瘤靶向治疗提供新的依据, 但EGCG如何抑制HIF-1α机制有待进一步研究. 绿茶是人们所喜爱的传统保健饮料之一, EGCG作为绿茶茶多酚的一种, 来源广泛. 深入研究其抗肿瘤机制和药理效应, 对开发新的抗肿瘤药物有重要意义.
血管新生是肿瘤生长转移的主要原因, 因此抗肿瘤血管生成逐渐成为抗肿瘤治疗的关键手段. 血管内皮生长因子(VEGF)与肿瘤血管新生过程中发挥关键作用, 而HIF-1α在缺氧条件下是促进VEGF基因转录的重要调节因子.
王学美, 研究员, 北京大学第一医院中西医结合研究室
EGCG作为茶多酚生物活性的主要成分已有研究证实, 通过抑制血管生成达到抑瘤效应, 其机制是否与HIF-1α-VEGF途径有关? 本文通过体外实验探讨其作用机制.
Fassina et al研究发现EGCG在子宫癌, 前列腺癌肿瘤模型中, 可能通过抑制VEGF生成及其受体活性机制从而抑制血管生成达到抑瘤效应.
本实验选取不同浓度的EGCG, 观察其对肝细胞癌细胞HepG2中 HIF-1α及VEGF的影响, 分析了EGCG抗肿瘤血管生成的作用靶点.
肝癌在我国的发病率较高, 本研究以茶多酚对肝癌细胞的相关血管生成蛋白的表达水平为切入点, 进而研究对其抗肿瘤作用, 具有一定的现实意义.
编辑: 李军亮 电编:何基才
| 2. | Ma J, Zhang L, Ru GQ, Zhao ZS, Xu WJ. Upregulation of hypoxia inducible factor 1alpha mRNA is associated with elevated vascular endothelial growth factor expression and excessive angiogenesis and predicts a poor prognosis in gastric carcinoma. World J Gastroenterol. 2007;13:1680-1686. [PubMed] |
| 3. | Ju J, Lu G, Lambert JD, Yang CS. Inhibition of carcinogenesis by tea constituents. Semin Cancer Biol. 2007;17:395-402. [PubMed] [DOI] |
| 4. | Salceda S, Caro J. Hypoxia-inducible factor 1alpha (HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions. Its stabilization by hypoxia depends on redox-induced changes. J Biol Chem. 1997;272:22642-22647. [PubMed] [DOI] |
| 5. | Kallio PJ, Pongratz I, Gradin K, McGuire J, Poellinger L. Activation of hypoxia-inducible factor 1alpha: posttranscriptional regulation and conformational change by recruitment of the Arnt transcription factor. Proc Natl Acad Sci U S A. 1997;94:5667-5672. [PubMed] [DOI] |
| 6. | Hägg M, Wennström S. Activation of hypoxia-induced transcription in normoxia. Exp Cell Res. 2005;306:180-191. [PubMed] [DOI] |
| 7. | Duff SE, Jeziorska M, Kumar S, Haboubi N, Sherlock D, O'Dwyer ST, Jayson GC. Lymphatic vessel density, microvessel density and lymphangiogenic growth factor expression in colorectal cancer. Colorectal Dis. 2007;9:793-800. [PubMed] [DOI] |
| 8. | Lee JJ, Chu E. An update on treatment advances for the first-line therapy of metastatic colorectal cancer. Cancer J. 2007;13:276-281. [PubMed] [DOI] |
| 9. | Powis G, Kirkpatrick L. Hypoxia inducible factor-1alpha as a cancer drug target. Mol Cancer Ther. 2004;3:647-654. [PubMed] |
| 10. | Fassina G, Venè R, Morini M, Minghelli S, Benelli R, Noonan DM, Albini A. Mechanisms of inhibition of tumor angiogenesis and vascular tumor growth by epigallocatechin-3-gallate. Clin Cancer Res. 2004;10:4865-4873. [PubMed] [DOI] |
| 11. | Adhami VM, Siddiqui IA, Ahmad N, Gupta S, Mukhtar H. Oral consumption of green tea polyphenols inhibits insulin-like growth factor-I-induced signaling in an autochthonous mouse model of prostate cancer. Cancer Res. 2004;64:8715-8722. [PubMed] [DOI] |
| 12. | Lamy S, Gingras D, Béliveau R. Green tea catechins inhibit vascular endothelial growth factor receptor phosphorylation. Cancer Res. 2002;62:381-385. [PubMed] |
| 13. | Shimizu M, Shirakami Y, Sakai H, Tatebe H, Nakagawa T, Hara Y, Weinstein IB, Moriwaki H. EGCG inhibits activation of the insulin-like growth factor (IGF)/IGF-1 receptor axis in human hepatocellular carcinoma cells. Cancer Lett. 2007; Dec 28. [Epub ahead of print]. [PubMed] |