修回日期: 2008-12-25
接受日期: 2008-12-29
在线出版日期: 2009-02-08
目的: 评价肝脏血流阻断联合射频后消融灶的变化及其对兔肝功能的影响.
方法: 兔VX2肝肿瘤接种成功后分为两组: 单独射频组、射频联合肝脏血流阻断组(联合射频组). 射频采用冷循环射频消融治疗(参数设定为30 W、8 min); 联合射频组肝脏血流阻断采用Pringle法. 两组分别于术前、术后1、3、7 d检测血清ALT、AST、AKP、GGT; 观察两组动物的并发症; 1wk后处死实验动物, 比较两组射频消融灶的大小及体积.
结果: 与单独射频组比较, 联合射频组消融灶的体积和垂直径显著增大, 且有统计学意义, 平行径虽有所增大, 但无统计学差异. 与单独射频组比较, 联合射频组动物术后1、3、7 d的血清ALT、GGT显著升高(P<0.05), 联合射频组术后的血清GGT有明显升高的趋势. 两组之间AST、AKP在术后各时间点没有明显差异. 联合射频组1例发生胆漏, 1例因出血于术后第1天死亡, 1例因肝功能衰竭于术后第4天死亡.
结论: 射频联合肝动脉门静脉双重血流阻断可增大射频的毁损灶体积, 但对兔肝脏损伤较严重, 临床应用应持谨慎的态度.
引文著录: 韩建波, 仇毓东, 张炜炜, 孔文韬, 邱君澜, 韩冰. 肝脏血流阻断下兔VX2肝肿瘤射频消融的疗效观察. 世界华人消化杂志 2009; 17(4): 352-356
Revised: December 25, 2008
Accepted: December 29, 2008
Published online: February 8, 2009
AIM: To evaluate the effects of vascular occlusion of hepatic blood flow on radiofrequency lesion and liver injury in rabbit VX2 tumor model.
METHODS: Rabbit VX2 liver tumor models were successfully established, and than they were assigned to two groups: radiofrequency ablation alone group and radiofrequency ablation with hepatic blood flow occlusion (vascular-occluded RFA) group. Radiofrequency lesions were created in vivo using a cool-tip radiofrequency electrode (radiofrequency parameters were 8 min in time and 30 W in power). The hepatic blood flow occlusion was got by pringle maneuver. Serum ALT, AST, AKP and GGT were detected before the operation and the 1st, 3rd, 7th day after the operation, and the adverse events were observed. The animals were sacrificed one week later. The size, volume of necrosis lesions in the two groups were then analyzed.
RESULTS: Volume and vertical diameter of the coagulated area were significantly greater with the pringle maneuver. The parallel diameter was larger than that coagulated by standard RFA, but there were no significantly differences between the groups. Serum ALT, GGT was higher in radiofrequency ablation combined with Pringle maneuver group than radiofrequency ablation alone group at each time after the operation (P < 0.05), and serum GGT lever was gradually increased postoperatively. Differences in serum AST, AKP between the two groups at each time postoperatively were not significant. One case of vascular-occluded RFA group was complicated with mild bile leakage, one case died on the 1st day for hemorrhage, and one case died for liver injury on the 4th day.
CONCLUSION: Radiofrequency ablation combined with occlusion of the hepatic artery and portal vein increases the volume of necrosis when compared with radiofrequency ablation alone, but much more serious liver injuries are found, careful attention should be paid when this technique is used in clinical practice.
- Citation: Han JB, Qiu YD, Zhang WW, Kong WT, Qiu JL, Han B. Effect of vascular occlusion on radiofrequency ablation of the liver in a rabbit VX2 tumor model. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 352-356
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/352.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.352
射频消融是一种局部热疗措施, 毁损体积的大小是射频成功的关键, 但由于热流失的影响, 局部热量被肝脏血流带走, 影响消融效果, 肝脏血流阻断可以减少热流失[1-4]、扩大射频消融体积. 以前的实验中动物射频术后立即处死, 难以评价射频消融灶进展期的变化及其肝损伤情况. 本研究目的是评价肝脏血流阻断联合射频后消融灶的变化及其对兔肝功能的影响.
新西兰大白兔18只(由南京大学附属鼓楼医院动物中心提供), 雌雄不限, 体质量为2.6-3.2 kg. 荷瘤VX2种兔由东南大学附属中大医院放射科滕皋军教授惠赠. 射频装置采用Radionics公司的冷循环射频治疗仪.
1.2.1 兔VX2肝肿瘤模型的建立: 氯胺酮: 氟哌利多(1∶1)静脉麻醉荷瘤种兔, 无菌条件下取出VX2肿瘤, 于超净台剔除瘤周组织、肿瘤包膜和坏死组织, 选取靠近瘤体边缘的质嫩灰白色鱼肉样组织, 用眼科剪剪成约1.5 mm×1.5 mm×1.5 mm大小的瘤块备用.
参照文献[5]中的方法, 略加改进. 氯胺酮: 氟哌利多(6 mL∶6 mL)加入500 mL生理盐水中静脉滴入维持麻醉, 麻醉成功后取仰卧位固定, 常规上腹部剪毛、备皮及消毒, 经腹白线正中切口进腹, 暴露肝脏左前叶, 轻压腹部将其挤出, 用盐水纱布拉出体外. 将2-3块备用瘤组织塞入16号针头, 后接1 mL注射器, 在距肝脏下缘约1.0-1.5 cm处斜向下插入约1.5 cm. 将瘤组织注入后拔出, 盐水纱布压迫至不再出血后用1号丝线两层关腹. 所有实验动物术前12 h禁食、不禁水. 术后连续3 d后肢肌肉注入青霉素40万单位、硫酸阿米卡星0.1 g预防感染.
1.2.2 实验分组和操作方法: 2 wk后种植VX2兔肝脏可形成直径约1.5 cm的单发肿瘤, 模型建立成功后随机分为2组: 单独射频组和射频联合肝脏血流阻断组(联合射频组).
术前准备及麻醉同上, 兔双后肢内侧备皮后贴电极板, 上腹部常规消毒、铺巾, 原切口进腹, 冷盐水纱布将荷瘤肝叶与周围的脏器分开. 射频采用射频针垂直插入肿瘤中心, 射频参数设定为30 W、8 min, 肝脏血流阻断采用Pringle法即绕扎肝十二指肠韧带阻断入肝血流. 确定无活动性出血及周围脏器损伤后关腹. 射频术后腹腔灌洗生理盐水50 mL补充丢失的水分. 术后抗生素应用同上.
术后1 wk所有实验动物静脉推注氯胺酮处死, 切取射频消融的肝叶, 沿RFA针道切开肝叶, 测量消融灶的平行径a[平行于针道的最大径(cm)]、垂直径b[垂直于针道的最大径(cm)], 消融灶体积V[V(cm3) = 3.14×a×b×b/6][6].
1.2.3 肝功能检测: 术前及术后第1、3、7天抽取兔耳静脉血, 检测ALT、AST、AKP、GGT.
1.2.4 病理学检查: 术后1 wk处死动物, 切取荷瘤肝叶置于40 g/L甲醛中固定至少24 h, 常规病理切片行HE染色.
统计学处理 采用SPSS11.5统计软件, 计量资料均采用mean±SD表示, 采用t检验进行统计分析, P<0.05认为具有统计学意义.
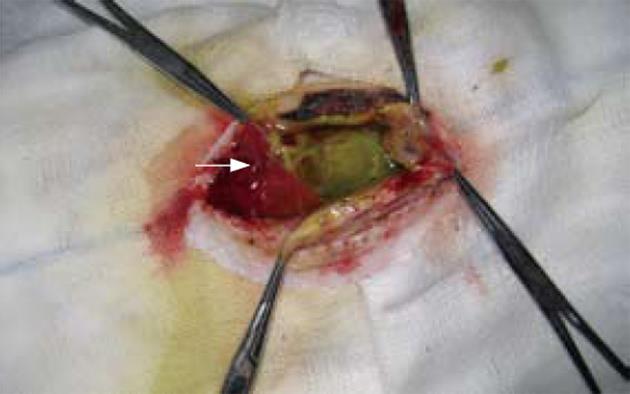
18只大白兔第1次接种后, 1只因肿瘤肝内多发转移、1只因腹壁种植被剔除实验, 另有2只接种失败, 再次接种后成功, 建立模型成功率为89%(16/18). 随机编号分组后, 各组间动物体质量、肿瘤大小没有显著性差异, 联合射频组其中1只因腹腔出血于术后第1天死亡, 1只因肝损害于术后第4天死亡, 1只于术后1 wk开腹时发现发生严重的胆漏(图1).
血流阻断增大射频的毁损体积, 两组之间存在显著性的差异(P<0.05). 联合射频组平行径a及垂直径b均大于单独射频组, 但是垂直径之间差异有统计学意义(P<0.001), 平行径之间差异无统计学意义(表1).
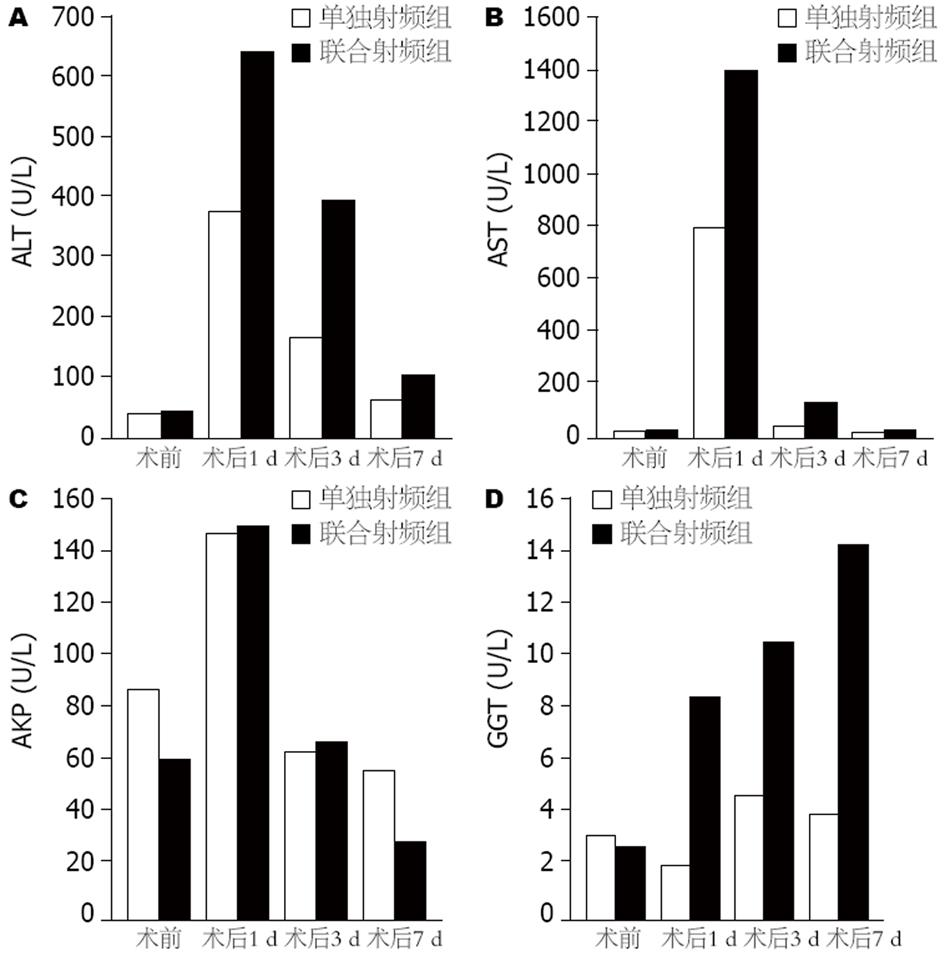
术前两组ALT、AST、AKP、GGT之间差异没有统计学意义. 术后第1天两组ALT、AST升高较明显, 之后逐渐降低, 至术后第7天射频组ALT、AST均恢复至术前水平, 但是联合射频组术后第7天ALT仍维持在较高水平. 联合射频组ALT术后各时间点均较单独射频组高, 且都有统计学意义, 但其AST术后各时间点之间差异没有统计学意义. 联合射频组术后GGT逐渐升高, 且术后1、3、7天均高于单独射频组, 并有统计学意义. 两组术后第1天AKP均升高较明显, 之后逐渐下降, 两组之间AKP在术后各时间点差异没有统计学意义(图2).
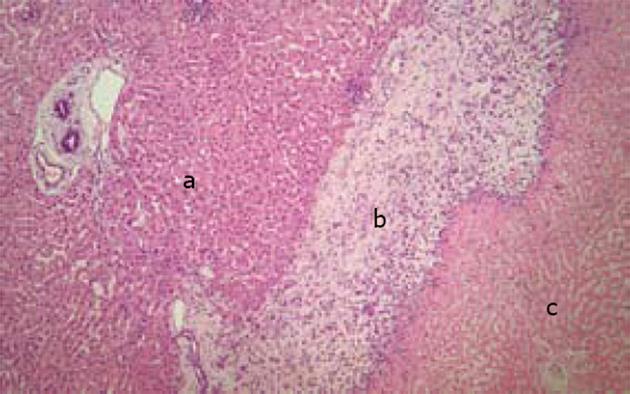
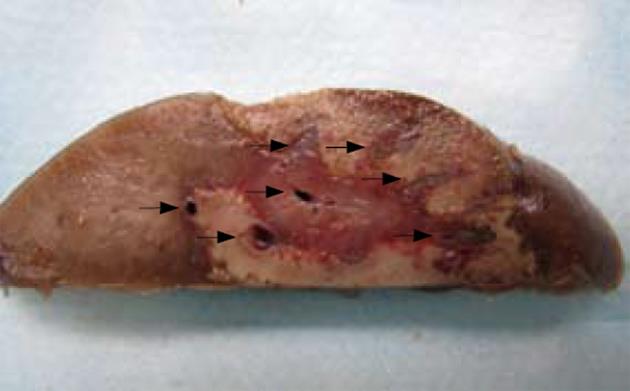
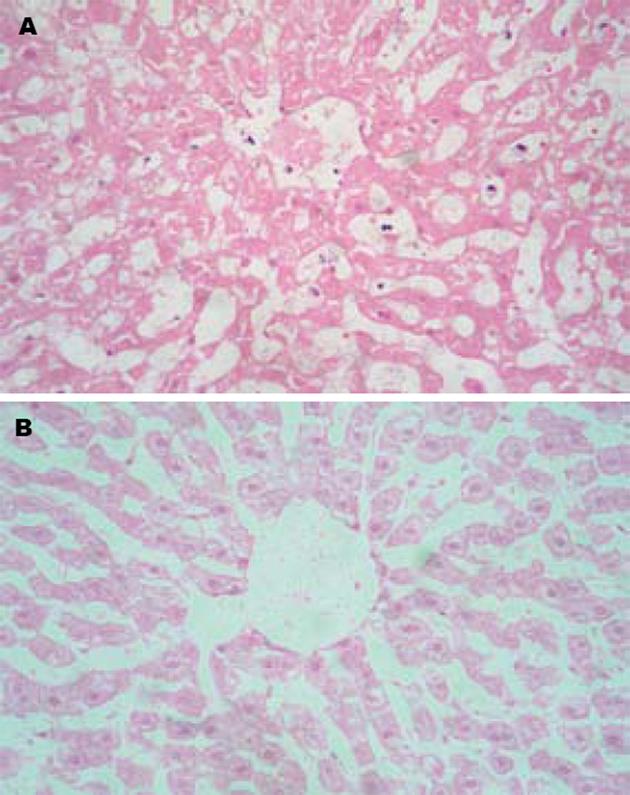
大体观察毁损灶为灰白色区域, 与周围肝脏组织分界清楚, 毁损灶与正常肝脏组织之间有一宽约1 mm的边缘带, 镜下观察边缘带内可见纤维结缔组织, 被较多的炎症细胞浸润(图3). 单独射频组大体标本可见血管周围的毁损灶不规则, 血管周围毁损灶形成缺失(图4). 单独射频组的肝脏毁损灶仍然保持肝小叶基本结构, 少数肝细胞仍可见细胞轮廓、细胞核, 但是血流阻断后射频的肝脏毁损灶, 肝小叶结构破坏, 肝细胞膜不完整, 少见细胞核, 细胞质嗜酸性, 一片红染(图5).
肝癌是常见的恶性肿瘤之一, 手术切除虽仍然是肝癌的标准治疗措施, 但由于肿瘤位置、大小和患者合并症等等原因, 手术切除并不适用于所有的肝癌. 事实上当肿瘤发现时, 仅仅有20%的患者有手术切除的机会[7]. 射频由于其微创、并发症少、可重复性、住院日短等优势, 在肝癌治疗中逐渐增多.
射频的机制是射频发生器发出的射频波使电极周围组织中的离子发生振荡, 摩擦生热, 导致组织细胞损伤, 肿瘤组织蛋白变性. 但由于"热流失"的影响[1-4], 肝脏血液流动将射频局部产生的热量带走, 靠近血管周围的肿瘤毁损不完全, 局部复发率增高. 通过外科手段及药物影响肝脏血流及肿瘤的血液供应可减少"热流失", 从而增大消融范围、降低局部复发率. 药物包括血管加压素[8]、三氧化二砷[9]、索拉非尼[10]等. 外科血流阻断包括肝动脉和门静脉联合阻断、肝动脉阻断、门静脉阻断、肝静脉阻断等[3-4]. 肝动脉和门静脉联合阻断即Pringle法联合射频可通过腹腔镜[11-12]进行, 减少开腹的损伤, 不违背微创的目的.
实验证实肝动脉和门静脉联合阻断较肝动脉、门静脉单独阻断射频消融范围大[3-4]. 这些实验中动物射频术后立即处死, 这只能评价射频直接损伤期(direct injury)[13]的变化, 难以评价肝脏血流阻断射频进展损伤期(progressive injury)[13]的变化及对肝损伤的影响, 肝脏血流阻断射频的有效性及安全性难以得到评估. 本实验通过在兔VX2肝肿瘤模型上进行肝脏血流阻断联合射频, 术后检测肝功能、观察并发症, 1 wk后测量射频消融灶, 以此评价射频消融灶进展期的变化及血流阻断后射频对肝功能的影响.
Wiersinga et al[2]发现射频毁损灶的最终毁损面积将随着时间的推移而变化, 应该将肝实质中引起的继发坏死(secondary heat-induced necrosis)计算在内. 以前的实验动物立即处死, 难以评价继发坏死的程度. 该实验射频术后1 wk观察毁损灶, 联合射频组体积大于单独射频组(P<0.05), 同时其垂直径、平行径均大于单独射频组, 虽平行径之间没有统计学意义, 可能由于兔肝脏体积小同时较薄, 其有一定的局限性. 血流阻断后射频毁损范围增大, 肿瘤周边的肝脏组织毁损增多, 理想毁损面积是能够覆盖肿瘤周围1 cm的正常肝脏组织[8], 这保证了肿瘤毁损后的安全边缘, 降低局部复发率.
本实验术后检测血清转氨酶评价肝损伤情况, 发现ALT在射频术后第1天升高较明显, 之后逐渐恢复, 单独射频组术后第7天恢复至术前水平, 但是联合射频组仍维持在较高的水平. 同时术后各时间点ALT较单独射频组高且都是有统计学意义, 说明血流阻断后射频较单独射频对肝脏的肝功能影响较大, 这可能是由于阻断后射频对肝细胞的损伤有缺血和高热的共同影响. 射频中血流阻断后的缺血损伤对射频的进展期损伤有一定的作用[2]. 缺血损伤使肝脏组织损伤较明显, 同时联合射频组有一只因肝损害于术后第4天死亡, 故临床应用血流阻断联合射频应合理选择手术适应证.
"热流失"的一个重要的潜在优势是保护大血管和胆道免于受热损伤的影响. 入肝血流的阻断虽可减少热流失, 但将会导致大血管及胆管更加易于受到热损伤的影响[14]. 该实验术后检测血清AKP、GGT, 发现联合射频组术后1、3、7 d GGT逐渐升高, 且术后1、3、7 d均高于单独射频组, 并有统计学意义, 说明血流阻断后射频对胆管损伤较重, 并且其中一只发生严重的胆漏. Kim et al[14]、Denys et al[15]亦报道血流阻断后射频胆道损伤及并发症如胆道狭窄、胆道扩张等较单独射频增加. 虽然胆道冷灌注联合射频可减少胆道并发症[16], 但是这仍处于初步探索阶段, 临床应用血流阻断联合射频应谨慎.
射频联合肝动脉门静脉双重血流阻断1 wk后观察毁损灶体积较单独射频组大, 但是血流阻断联合射频对兔肝脏损伤较严重, 临床应用应持谨慎的态度, 合理选择适应证, 以防止血流阻断联合射频后并发症的发生.
本实验选择射频术后1 wk比较射频毁损灶大小和肝损伤情况, 但是对于射频1 wk后其变化情况没有进一步的研究. 这正是本实验的局限性, 值得下一步的探索.
肝癌的治疗除了手术外还有射频等微创治疗. 射频消融是一种局部热疗措施, 毁损体积的大小是射频成功的关键, 但由于热流失的影响, 局部热量被肝脏血流带走, 影响消融效果, 肝脏血流阻断可以减少热流失、扩大射频消融体积. 以前的实验中动物射频术后立即处死, 难以评价射频消融灶进展期的变化及其肝损伤情况.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
该领域的研究重点是如何减少"热流失", 扩大射频消融范围.
Wiersinga et al发现射频毁损灶的最终毁损面积将随着时间的推移而变化, 应该将肝实质中引起的继发坏死(secondary heat-induced necrosis)计算在内.
射频治疗联合肝动脉门静脉双重血流阻断可扩大射频消融范围, 但是肝损伤较重, 临床应合理选择手术适应证.
本研究对临床应用有一定参考作用, 学术价值较好.
编辑: 史景红 电编:何基才
| 1. | Rossi S, Garbagnati F, De Francesco I, Accocella F, Leonardi L, Quaretti P, Zangrandi A, Paties C, Lencioni R. Relationship between the shape and size of radiofrequency induced thermal lesions and hepatic vascularization. Tumori. 1999;85:128-132. [PubMed] |
| 2. | Wiersinga WJ, Jansen MC, Straatsburg IH, Davids PH, Klaase JM, Gouma DJ, van Gulik TM. Lesion progression with time and the effect of vascular occlusion following radiofrequency ablation of the liver. Br J Surg. 2003;90:306-312. [PubMed] [DOI] |
| 3. | Chinn SB, Lee FT Jr, Kennedy GD, Chinn C, Johnson CD, Winter TC 3rd, Warner TF, Mahvi DM. Effect of vascular occlusion on radiofrequency ablation of the liver: results in a porcine model. AJR Am J Roentgenol. 2001;176:789-795. [PubMed] |
| 4. | Chang CK, Hendy MP, Smith JM, Recht MH, Welling RE. Radiofrequency ablation of the porcine liver with complete hepatic vascular occlusion. Ann Surg Oncol. 2002;9:594-598. [PubMed] |
| 5. | Chen JH, Lin YC, Huang YS, Chen TJ, Lin WY, Han KW. Induction of VX2 carcinoma in rabbit liver: comparison of two inoculation methods. Lab Anim. 2004;38:79-84. [PubMed] [DOI] |
| 6. | Zhang YJ, Chen MS, Li JQ, Zhang YQ, Zhong C, Liang HH. [Radiofrequency ablation combined with ethanol injection for liver cancer treatment---an experimental study]. Ai Zheng. 2006;25:1092-1096. [PubMed] |
| 7. | Wood TF, Rose DM, Chung M, Allegra DP, Foshag LJ, Bilchik AJ. Radiofrequency ablation of 231 unresectable hepatic tumors: indications, limitations, and complications. Ann Surg Oncol. 2000;7:593-600. [PubMed] |
| 8. | Goldberg SN, Hahn PF, Halpern EF, Fogle RM, Gazelle GS. Radio-frequency tissue ablation: effect of pharmacologic modulation of blood flow on coagulation diameter. Radiology. 1998;209:761-767. [PubMed] |
| 9. | Horkan C, Ahmed M, Liu Z, Gazelle GS, Solazzo SA, Kruskal JB, Goldberg SN. Radiofrequency ablation: Effect of pharmacologic modulation of hepatic and renal blood flow on coagulation diameter in a VX2 tumor model. J Vasc Interv Radiol. 2004;15:269-274. [PubMed] |
| 10. | Hakimé A, Hines-Peralta A, Peddi H, Atkins MB, Sukhatme VP, Signoretti S, Regan M, Goldberg SN. Combination of radiofrequency ablation with antiangiogenic therapy for tumor ablation efficacy: study in mice. Radiology. 2007;244:464-470. [PubMed] [DOI] |
| 11. | Scott DJ, Fleming JB, Watumull LM, Lindberg G, Tesfay ST, Jones DB. The effect of hepatic inflow occlusion on laparoscopic radiofrequency ablation using simulated tumors. Surg Endosc. 2002;16:1286-1291. [PubMed] [DOI] |
| 12. | Shen P, Fleming S, Westcott C, Challa V. Laparoscopic radiofrequency ablation of the liver in proximity to major vasculature: effect of the Pringle maneuver. J Surg Oncol. 2003;83:36-41. [PubMed] [DOI] |
| 13. | Nikfarjam M, Malcontenti-Wilson C, Christophi C. Focal hyperthermia produces progressive tumor necrosis independent of the initial thermal effects. J Gastrointest Surg. 2005;9:410-417. [PubMed] [DOI] |
| 14. | Kim SK, Lim HK, Ryu JA, Choi D, Lee WJ, Lee JY, Lee JH, Sung YM, Cho EY, Hong SM. Radiofrequency ablation of rabbit liver in vivo: effect of the pringle maneuver on pathologic changes in liver surrounding the ablation zone. Korean J Radiol. 2004;5:240-249. [PubMed] |
| 15. | Denys AL, De Baere T, Mahe C, Sabourin JC, Sa Cunha A, Germain S, Roche A. Radio-frequency tissue ablation of the liver: effects of vascular occlusion on lesion diameter and biliary and portal damages in a pig model. Eur Radiol. 2001;11:2102-2108. [PubMed] [DOI] |
| 16. | Ohnishi T, Yasuda I, Nishigaki Y, Hayashi H, Otsuji K, Mukai T, Enya M, Omar S, Soehendra N, Tomita E. Intraductal chilled saline perfusion to prevent bile duct injury during percutaneous radiofrequency ablation for hepatocellular carcinoma. J Gastroenterol Hepatol. 2008;23:e410-e415. [PubMed] [DOI] |