修回日期: 2009-11-17
接受日期: 2009-11-23
在线出版日期: 2009-12-28
目的: 分析三叶因子3(TFF3)在不同胃黏膜病变中的表达及其与间质微血管密度(MVD)值的关系, 探讨其在胃癌、癌前病变及胃腺瘤发生、发展中的作用.
方法: 应用免疫组织化学PV6000法检测20例正常胃黏膜、20例胃腺瘤、20例萎缩性胃炎伴肠化生、20例不典型增生、40例胃癌组织中TFF3的表达, 同时检测MVD值, 以抗CD34标记.
结果: TFF3在胃腺瘤、萎缩性胃炎伴肠化生、不典型增生和胃癌各组表达均高于正常组(50.0%, 65.0%, 70.0%, 57.5% vs 5.0%, 均P<0.01). 胃癌MVD值高于正常胃黏膜、胃腺瘤、萎缩性胃炎伴肠化生和不典型增生(30.65±6.04 vs 14.87±3.06, 22.33±3.78, 23.16±3.20, 25.22±4.66, 均P<0.01), 各组MVD值均高于正常胃黏膜组(均P<0.01). TFF3表达和MVD值与胃癌淋巴结转移和分期有关(均P<0.05), MVD值还与胃癌浸润深度有关(P<0.05). TFF3阳性表达组的MVD值明显高于TFF3阴性组(34.53±4.45 vs 25.39±3.25, P<0.01).
结论: TFF3可能是胃黏膜癌变过程中的早期分子事件, 在胃黏膜癌变和癌变后的恶性演进过程中起作用, 对胃癌早期诊断和预测胃癌发生转移可能具有重要的提示作用.
引文著录: 路艳艳, 田字彬, 魏良洲, 孔心涓, 赵清喜, 李玉军, 孙显路. TFF3在胃癌、癌前病变及胃腺瘤中的表达及其与血管生成的关系. 世界华人消化杂志 2009; 17(36): 3688-3692
Revised: November 17, 2009
Accepted: November 23, 2009
Published online: December 28, 2009
AIM: To investigate the expression of trefoil factor 3 (TFF3) in gastric carcinoma, precancerous lesions, gastric adenoma and explore its correlation with microvessel density (MVD) in gastric carcinogenesis.
METHODS: The expression of TFF3 was detected by the immunohistochemical PV-6000 method in 120 gastric mucosal specimens, including 20 cases of normal gastric mucosa (NGM), 20 cases of gastric adenoma (GA), 20 cases of chronic atrophic gastritis with intestinal metaplasia (IM), 20 cases of dysplasia (DYS), and 40 cases of gastric carcinoma (GC). MVD was examined by immunohistochemistry using anti-CD34 antibody.
RESULTS: The positive rates of TFF3 expression were significantly higher in GA, IM, DYS and GC than in NGM (50.0%, 65.0%, 70.0% and 57.5% vs 5.0%, respectively; all P < 0.01). MVD was significantly higher in GC than in NGM, GA, IM and DYS (30.65 ± 6.04 vs 14.87 ± 3.06, 22.33 ± 3.78, 23.16 ± 3.20 and 25.22 ± 4.66, respectively; all P < 0.01). MVD was also significantly higher in GA, IM, DYS and GC than in NGM (all P < 0.01). TFF3 expression and MVD were correlated with lymph node metastasis and tumor stage in GC (all P < 0.05). MVD was also correlated with depth of invasion in GC (P < 0.05). MVD in specimens showing positive expression of TFF3 was higher than that in specimens showing negative expression (34.53 ± 4.45 vs 25.39 ± 3.25, P < 0.01).
CONCLUSION: TFF3 may be involved in an early event in gastric carcinogenesis and play an important role in gastric carcinogenesis. Detection of TFF3 expression may be of great significance for early diagnosis and prediction of metastasis in gastric carcinoma.
- Citation: Lu YY, Tian ZB, Wei LZ, Kong XJ, Zhao QX, Li YJ, Sun XL. Correlation of trefoil factor 3 expression in gastric carcinoma, precancerous lesions, gastric adenoma with angiogenesis. Shijie Huaren Xiaohua Zazhi 2009; 17(36): 3688-3692
- URL: https://www.wjgnet.com/1009-3079/full/v17/i36/3688.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i36.3688
胃癌是消化系最常见的恶性肿瘤之一, 预后很差, 5年生存率不足20%. 早诊断、早治疗是目前提高胃癌存活率的唯一有效措施, 因而提高早期胃癌的检出率非常重要. 三叶因子3(trefoil factor 3, TFF3)是三叶肽家族成员之一, 生理状况下TFF3主要分布于小肠及结肠的杯状细胞中, 在胃肠道黏膜保护、溃疡修复过程有重要作用. 近年来研究表明其在乳腺、胃、结肠肿瘤中异常表达, 可能与肿瘤的发生发展有关. 本试验通过免疫组织化学方法检测TFF3和微血管密度(micro-vessel density, MVD)在胃癌、癌前病变(萎缩性胃炎伴肠上皮化生、不典型增生)及胃腺瘤中的表达, 旨在探讨TFF3在胃癌发生发展中的作用, 为胃癌早期诊断和临床防治提供新的思路和前景.
选取青岛大学医学院附属医院2006-03/2009-03存档的胃镜活检及胃癌根治术后标本蜡块120例, 其中萎缩性胃炎伴肠化生、不典型增生、胃腺瘤组各20例, 胃癌组40例. 胃癌病例术前均未接受放疗、化疗, 年龄32-82(平均61.5±11.7)岁. 并取远端正常胃组织20例作对照. 实验选用与HE染色一致的蜡块制成4 µm切片行免疫组织化学染色.
1.2.1 免疫组织化学(PV6000)法: 兔抗人TFF3多克隆抗体(工作浓度为1:250), CD34单克隆抗体(即用型), PV6000试剂盒, 柠檬酸抗原修复缓冲液、DAB染色剂分别购自北京博奥森生物技术有限公司及北京中山金桥生物技术有限公司, 切片染色前根据抗体要求行柠檬酸缓冲液高温高压抗原修复, 余具体操作过程按试剂盒说明书完成, 并设立阳性对照(结肠组织)和阴性对照(以PBS缓冲液代替一抗).
1.2.2 结果判定: TFF3的判断标准: 以胞质内出现淡黄色至棕黄色染色视为阳性细胞, 根据细胞染色强度和染色细胞所占面积之和来判断. 染色强度积分为: 无染色0分, 弱染色1分, 中等染色2分, 强染色3分; 染色面积积分为: 阳性范围≤10%为0分, 11-25%为1分, 26-50%为2分, 51-75%为3分, >75%为4分. 若两者积分之和>2分则为阳性, ≤2分则为阴性. MVD计数: CD34表达位于血管内皮上, 通常最密集的微血管染色区主要分布于肿瘤与周围组织交界区, 按Weider推荐的方法, 任何染成棕色的可与周围血管、肿瘤细胞和其他结缔组织区分开的血管内皮细胞或血管内皮细胞簇均作为一个血管计数. 但肌层较厚及管腔面积大于8个红细胞直径的血管不计数. 每例首先在低倍镜(100×)下选择MVD最高的肿瘤区域, 然后在400倍光镜下随机计数5个视野内微血管数, 求其平均值.
统计学处理 采用SPSS11.5软件进行统计学处理, TFF3在不同胃黏膜组织中的表达之间的关系、与胃癌的临床病理特征之间的关系用χ2检验, MVD以mean±SD表示, 在不同胃黏膜中的表达用单因素方差分析, 与TFF3的表达及胃癌临床病理特征之间的关系用t检验. 取P<0.05为差别有统计学意义.
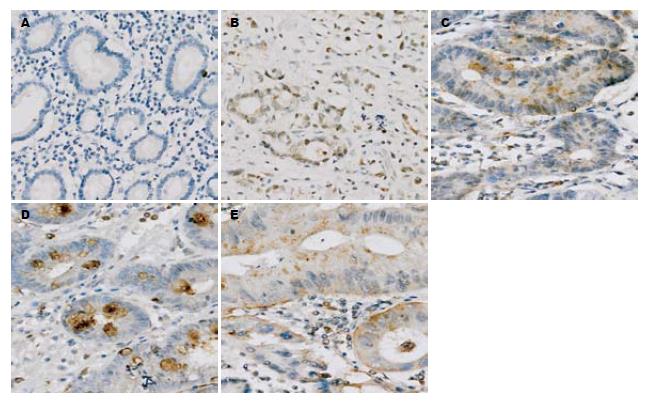
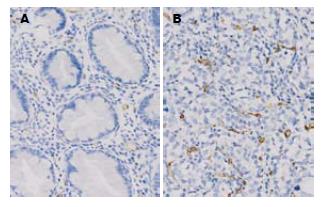
TFF3表达位于细胞质中(图1), CD34表达位于血管内皮细胞膜上(图2), 各组间TFF3表达及MVD值差异均有统计学意义(均P = 0.000). TFF3、MVD值随着正常胃黏膜→胃腺瘤→萎缩性胃炎伴肠化生→不典型增生而逐渐升高, 但胃癌组TFF3表达低于萎缩性胃炎、不典型增生组, 与胃腺瘤、萎缩性胃炎伴肠化生、不典型增生组比较TFF3表达均无显著差异; 胃腺瘤、萎缩性胃炎伴肠化生、不典型增生、胃癌组TFF3表达均显著高于正常胃黏膜(50.0%, 65.0%, 70.0%, 57.5% vs 5.0%, 均P<0.001). 胃癌MVD依次高于正常胃黏膜、胃腺瘤、萎缩性胃炎伴肠化生和不典型增生(30.65±6.04 vs 14.87±3.06, 22.33±3.78, 23.16±3.20, 25.22±4.66, 均P<0.001); 胃腺瘤、萎缩性胃炎伴肠化生、不典型增生、胃癌组MVD均明显高于正常胃黏膜(均P<0.001), 胃腺瘤、萎缩性胃炎伴肠化生、不典型增生三者间差别无统计学意义(表1).
TFF3表达和MVD值与胃癌淋巴结转移和分期有关(均P<0.05), TFF3的表达在淋巴结转移组高于无淋巴结转移组(χ2 = 7.821, P<0.01), 进展期胃癌组高于早期胃癌组(χ2 = 4.816, P<0.05), 而与患者的性别、年龄、肿瘤的浸润程度、肿瘤细胞的分化程度无关. MVD还与胃癌浸润深度有关(t = 2.331, P<0.05), 淋巴结转移组高于无淋巴结转移组(t = 3.226, P<0.01), 进展期胃癌高于早期胃癌组(t = 2.224, P<0.05, 表2).
| 临床病理特征 | n | TFF3 | CD34 | ||
| 阳性n(%) | P值 | MVD(mean±SD) | P值 | ||
| 性别 | 0.680 | 0.755 | |||
| 男 | 25 | 15(60.0) | 30.88±6.32 | ||
| 女 | 15 | 8(53.3) | 30.25±5.73 | ||
| 年龄(岁) | 0.962 | 0.278 | |||
| <60 | 19 | 11(57.9) | 31.75±6.47 | ||
| ≥60 | 21 | 12(57.1) | 29.65±5.58 | ||
| 分化程度 | 0.680 | 0.91 | |||
| 高中分化 | 15 | 8(53.3) | 30.79±5.89 | ||
| 低分化 | 25 | 15(60.0) | 30.56±6.25 | ||
| 浆膜浸润 | 0.151 | 0.025 | |||
| 无 | 16 | 7(43.8) | 28.06±3.83 | ||
| 有 | 24 | 16(66.7) | 32.37±6.67 | ||
| 淋巴结转移 | 0.005 | 0.003 | |||
| 无 | 18 | 6(33.3) | 27.59±3.82 | ||
| 有 | 22 | 17(77.3) | 33.15±6.43 | ||
| 分期 | 0.028 | 0.032 | |||
| 早期 | 6 | 1(16.7) | 26.93±4.41 | ||
| 进展期 | 34 | 22(64.7) | 32.25±5.53 | ||
胃癌中TFF3阳性表达组的MVD值高于阴性表达组(34.53±4.45 vs 25.39±3.25), 二者间差异有显著意义(t = 7.163, P<0.01).
TFF3也称肠三叶因子(intestinal trefoil factor, ITF)是三叶肽家族一员, 1991年由Suemori et al[1]首次在大鼠空肠发现, 其基因与TFF1、TFF2基因密集于染色体21q22.3上, 主要在小肠和结肠中表达, 是由杯状细胞分泌的特异分布于肠黏膜表面的小分子多肽物质, 在哺乳动物体内具有黏膜保护、修复作用[2]. 近年来其在肿瘤中的作用日益受到重视, 通过抑制细胞黏附、促进细胞侵袭、抑制凋亡及促进新生血管形成等, 在肿瘤中发挥作用.
胃癌的发生是一个漫长过程, 一般认为胃癌是从正常胃黏膜上皮细胞经内外因素作用发生慢性胃炎到胃癌前病变, 包括腺瘤、肠化生和不典型增生, 经过一系列基因突变的积累最终导致胃癌的发生[3-4].
Leung et al发现, TFF3在胃黏膜发生肠化、不典型增生到胃癌的发生过程中表达逐步增高[5]. Taupin et al通过制造大鼠胃黏膜病变模型, 研究TFF1及TFF3在不同阶段的表达, 发现在从胃黏膜化生到不典型增生再到胃癌这一过程中, TFF3的表达逐步增高, 并认为TFF3的表达增高早于胃黏膜上皮的化生, 即在胃黏膜出现化生之前已经有TFF3的表达增高[6]. 本研究结果显示, TFF3表达随着正常胃黏膜→胃腺瘤→萎缩性胃炎伴肠化生→不典型增生而逐渐升高, 但胃癌TFF3表达低于萎缩性胃炎、不典型增生, 胃腺瘤、萎缩性胃炎伴肠化生、不典型增生和胃癌间差异不显著, 4组均显著高于正常胃黏膜, 提示TFF3高表达参与了胃黏膜腺瘤形成、肠上皮化生、不典型增生和恶性转化的过程, 其可能是胃黏膜癌变过程中的早期分子事件.
文献报道胃癌TFF3的表达与性别、淋巴结转移及分期有关[7-8]. 本研究结果显示, TFF3表达与胃癌淋巴结转移和分期有关, 有淋巴结转移组高于无淋巴结转移组, 进展期胃癌高于早期胃癌, 但与年龄、性别、分化程度和浸润深度无关, 提示TFF3在胃黏膜癌变后的恶性演进过程中起重要作用. 其机制可能是TFF3抑制细胞黏附, 促进癌细胞侵袭, 阻断细胞凋亡. TFF3是胃肠道内源性具有抗凋亡特性的肽类物质, 能激活细胞内NF-κB, 阻止处于级联反应的caspase-8的活化. NF-κB的靶基因为凋亡抑制蛋白c-IAP1、c-IAP2等, 其协同作用能阻止下游caspases的活化以及细胞凋亡[9]. TFF3降低肿瘤细胞之间粘连: 一是通过TFF3降低β-连环蛋白、E-钙黏蛋白的活性, 导致细胞间粘连的破坏, 使上皮细胞互相离移; 二是通过环氧合酶(COX)、血栓素A2受体(TXA2-R)、PLC/PKC及PI-3K依赖途径, 促进细胞间粘连的降低, 导致肿瘤的浸润、转移[10].
血管生成(angiogenesis)是指从已有的毛细血管或毛细血管后静脉发展而成新生血管的过程. 肿瘤组织的增殖依赖血液供应, 血管生成在肿瘤的生长、侵袭和转移中发挥重要作用. MVD是用CD34标记肿瘤血管, 是判定血管生成的一个良好指标. 有研究发现: 在肿瘤发生的早期即显示血管表型, 随着胃黏膜腺瘤形成、炎症和肠上皮化生、不典型增生的发生, 微血管生成也增加, 可有利于病变的修复, 但随着肿瘤的进展, MVD显著增加, MVD越高, 已癌变细胞进入血循环及淋巴循环的机会越多, 转移机率也越大, 其预后可能越差. 肿瘤在生长过程中确有异常血管形成, 这些异常血管的形成, 又为肿瘤的生长提供了适合的基础, 促进了肿瘤的生长[11]. 本研究结果表明MVD在正常的胃黏膜、胃腺瘤、萎缩性胃炎伴肠化生、不典型增生、胃癌组织均表达依次增高, 胃腺瘤、萎缩性胃炎伴肠化生与不典型增生之间差异不显著, 正常胃黏膜、胃癌与其他3组间差别均有显著统计学意义, 胃癌组MVD值明显高于正常胃黏膜. 胃癌组织中MVD与肿瘤的浸润深度、淋巴结转移及分期有关.
血管生成是肿瘤细胞适应局部缺氧环境而发生的, 缺氧导致新生血管形成基因的表达, 是肿瘤生长和扩散的必要条件. 体内外研究发现TFF3可促进鸡胚绒毛尿囊膜的血管生成, 可诱导人脐静脉内皮细胞形成类微血管结构, 提示其在血管生成中的作用[12]. 在本研究中, TFF3阳性的胃癌组MVD值明显高于TFF3阴性者, 表明TFF3的表达与胃癌血管形成有关. 在肿瘤的发展过程中, 缺氧环境及癌基因的激活和抑癌基因的突变, HIF-lα基因被激活并过量生成, HIF-1α活性增加, 并与不同目的基因如VEGF, iNOS等的缺氧反应元件中的序列5'-A/GCGTG-3'相连接, 激活许多基因的转录[13], 促进肿瘤血管生成[14-15]. 在TFF3启动子中的缺氧反应元件中即存在着这一共有序列, 提示在胃癌组织中可能通过缺氧依赖途径促进TFF3 mRNA及其蛋白的表达, 进而影响胃癌血管生成, 促进肿瘤的侵袭、转移, 其机制还有待进一步的研究证实.
本研究结果表明TFF3作为胃肠黏膜中一个重要的细胞因子, 其参与了胃黏膜腺瘤形成、肠上皮化生、不典型增生和恶性转化的过程, 可能是胃黏膜癌变过程中的早期分子事件, 并且可以影响胃癌血管生成, 促进肿瘤的侵袭、转移, 但TFF3的结合蛋白尚未明确, 其细胞内作用机制、具体信号转导途径的相关研究尚处于起始阶段, 随着分子生物学的不断发展可进一步了解TFF3与胃癌发生、发展的关系, 从而有利于胃癌的早期诊断和治疗.
胃癌的发生是一个多步骤、多因素进行性发展的过程, 目前尚且缺乏有效的早期诊断指标. TFF3是三叶肽家族一员, 其基因与TFF1、TFF2基因密集于染色体21q22.3上, 近年来研究表明TFF3在肿瘤发生发展中起重要作用.
许乐, 主任医师, 北京医院消化科
TFF3在肿瘤中异常表达, 其在癌前状态是否也有表达, 与肿瘤血管形成之间的关系, 在肿瘤发生、浸润及转移中的作用机制是当前研究的热点问题.
Taupin et al研究发现, 从胃黏膜化生到不典型增生再到胃癌, TFF3的表达逐步增高, 并认为TFF3的表达增高早于胃黏膜上皮的化生.
本文研究发现, TFF3可能是胃黏膜癌变过程中的早期分子事件, 在胃黏膜癌变和癌变后的恶性演进过程中起作用, 随着分子生物学的不断发展可进一步了解TFF3与胃癌发生、发展的关系, 为胃癌的早期诊断和临床治疗提供新的思路和前景.
本研究通过免疫组织化学方法检测TFF3和微血管密度在胃癌、癌前病变及胃腺瘤中的表达, 探讨TFF3在胃癌发生发展中的作用, 为胃癌早期诊断提供了新的思路和前景, 有一定的临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Suemori S, Lynch-Devaney K, Podolsky DK. Identification and characterization of rat intestinal trefoil factor: tissue- and cell-specific member of the trefoil protein family. Proc Natl Acad Sci USA. 1991;88:11017-11021. [PubMed] [DOI] |
| 3. | Yokozaki H, Yasui W, Tahara E. Genetic and epigenetic changes in stomach cancer. Int Rev Cytol. 2001;204:49-95. [PubMed] [DOI] |
| 4. | 唐 忠辉, 陈 华生, 邹 宗楷, 蔡 韶滨, 苏 海燕, 沈 洪武, 吴 文乔, 林 莉, 王 元亨. TFF3和CD147在不同胃黏膜病变中的表达及其与血管生成的关系. 世界华人消化杂志. 2008;16:3631-3636. [DOI] |
| 5. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [PubMed] [DOI] |
| 6. | Taupin D, Pedersen J, Familari M, Cook G, Yeomans N, Giraud AS. Augmented intestinal trefoil factor (TFF3) and loss of pS2 (TFF1) expression precedes metaplastic differentiation of gastric epithelium. Lab Invest. 2001;81:397-408. [PubMed] |
| 7. | Yamachika T, Werther JL, Bodian C, Babyatsky M, Tatematsu M, Yamamura Y, Chen A, Itzkowitz S. Intestinal trefoil factor: a marker of poor prognosis in gastric carcinoma. Clin Cancer Res. 2002;8:1092-1099. [PubMed] |
| 8. | Dhar DK, Wang TC, Tabara H, Tonomoto Y, Maruyama R, Tachibana M, Kubota H, Nagasue N. Expression of trefoil factor family members correlates with patient prognosis and neoangiogenesis. Clin Cancer Res. 2005;11:6472-6478. [PubMed] [DOI] |
| 9. | Chen YH, Lu Y, De Plaen IG, Wang LY, Tan XD. Transcription factor NF-kappaB signals antianoikic function of trefoil factor 3 on intestinal epithelial cells. Biochem Biophys Res Commun. 2000;274:576-582. [PubMed] [DOI] |
| 10. | Rodrigues S, Nguyen QD, Faivre S, Bruyneel E, Thim L, Westley B, May F, Flatau G, Mareel M, Gespach C. Activation of cellular invasion by trefoil peptides and src is mediated by cyclooxygenase- and thromboxane A2 receptor- dependent signaling pathways. FASEB J. 2001;15:1517-1528. [PubMed] [DOI] |
| 12. | Rodrigues S, Van Aken E, Van Bocxlaer S, Attoub S, Nguyen QD, Bruyneel E, Westley BR, May FE, Thim L, Mareel M. Trefoil peptides as proangiogenic factors in vivo and in vitro: implication of cyclooxygenase-2 and EGF receptor signaling. FASEB J. 2003;17:7-16. [PubMed] [DOI] |
| 13. | Semenza GL. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annu Rev Cell Dev Biol. 1999;15:551-578. [PubMed] [DOI] |