修回日期: 2009-11-25
接受日期: 2009-11-30
在线出版日期: 2009-12-28
目的: 检测镇江地区幽门螺杆菌(Helicobacter pylori, H. pylori)尿素通道蛋白基因ureI, 并进行克隆和序列分析.
方法: 从胃十二指肠疾病患者胃黏膜组织中分离培养获得 60例H. pylori, PCR扩增检测ureI基因, 部分菌株的ureI基因克隆至pMD18-T载体上, 进行测序和序列分析.
结果: 60例H. pylori菌株的ureI检出率为100%, 成功克隆了8株来源于慢性胃炎、消化性溃疡和胃癌的H. pylori菌株ureI并进行了序列分析. 结果表明不同来源H. pylori菌株之间ureI核苷酸和氨基酸序列同源性均高达95.6%以上.
结论: ureI基因在H. pylori中高度保守, 可以作为鉴定H. pylori的分子诊断标志.
引文著录: 邵长江, 张尤历, 王文兵, 孔梅, 陈鑫, 宋永站. 幽门螺杆菌尿素通道蛋白基因ureI的检测、克隆及序列分析. 世界华人消化杂志 2009; 17(36): 3684-3687
Revised: November 25, 2009
Accepted: November 30, 2009
Published online: December 28, 2009
AIM: To detect, clone and sequence the urea channel protein gene ureI of Helicobacter pylori (H. pylori) strains isolated from Zhenjiang area.
METHODS: Sixty H. pylori strains were isolated from gastric mucosa of patients with chronic gastritis, peptic ulcer or gastric cancer, and cultured on solid agar medium. The gene encoding UreI protein was amplified from H. pylori genomic DNA by polymerase chain reaction (PCR). The amplified ureI genes from some strains derived from different patients were cloned into T vector, sequenced and analyzed using bioinformatic methods.
RESULTS: The ureI gene was detected in 100% (60/60) of H. pylori strains. The ureI genes of eight H. pylori strains derived from patients with chronic gastritis, peptic ulcer and gastric cancer were cloned and sequenced. The nucleotide and amino acid sequence homology among the ureI genes derived from different H. pylori strains is more than 95.6%.
CONCLUSION: The ureI gene is conserved among H. pylori strains and can be used as a good molecular marker for identification of H. pylori.
- Citation: Shao CJ, Zhang YL, Wang WB, Kong M, Chen X, Song YZ. Detection, cloning and sequence analysis of the urea channel protein gene ureI of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2009; 17(36): 3684-3687
- URL: https://www.wjgnet.com/1009-3079/full/v17/i36/3684.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i36.3684
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种定植于人胃部的革兰氏阴性杆菌, 是慢性胃炎、消化性溃疡的主要病因, 并与胃癌和胃黏膜相关淋巴组织恶性淋巴瘤等疾病的发生密切相关[1-2], 世界卫生组织已将其列为Ⅰ级致癌因子[3]. 幽门螺杆菌尿素通道蛋白(UreI)在H. pylori致病中起到了关键作用. UreI为pH依赖性尿素通道蛋白, 当外界环境中的pH值小于6.2时, 通道开放, 有选择地使尿素通过, 进入胞质中的尿素被尿素酶水解成氨和二氧化碳, 迅速扩散至周质腔中和胃酸[4]. 氨的生成是H. pylori对抗胃酸、耐受胃酸以及在胃内定植的基础, 因此UreI是H. pylori在胃内定植和持续感染的一个最关键环节[5]. 本实验采用PCR技术检测了60例来源于胃炎, 消化性溃疡和胃癌的H. pylori菌株的ureI基因, 并对其中的8例进行克隆、序列测定和分析, 以了解不同疾病来源菌株的ureI在致病过程中的变化情况及明确ureI基因是否适合作为诊断H. pylori感染的分子标记, 为进一步研究打下基础.
H. pylori基础培养基、微需氧环境发生袋、选择性抗生素及厌氧培养罐购自德国Merck公司. 改良布氏肉汤培养基由上海腹泻疾病控制中心提供, 无菌羊全血为金坛欣迪公司产品. Escherichia coli DH5α为江苏大学生命科学研究院实验室保存. pMD18-T载体、Taq DNA聚合酶、质粒抽提试剂盒购自TaKaRa大连公司. 酵母提取物、蛋白胨为OXOID公司产品. 其他常规试剂为市售分析纯.
1.2.1 H. pylori菌株的来源: 分离的H. pylori来自60例2008-05/2008-12因消化系症状来江苏大学附属医院消化科胃镜室检查患者的胃窦黏膜(距幽门5 cm以内)活检组织, 每例取新鲜胃黏膜3块, 其中1块置于输送液中用于分离培养H. pylori, 1块用于快速尿素酶检测, 1块用于病理组织学检查. 60例中慢性胃炎22例, 消化性溃疡28例, 胃癌10例. 疾病的诊断依据胃镜和病理学检查.
1.2.2 H. pylori的培养: 自输送液中取出胃黏膜标本, 将活检新鲜组织用接种环均匀涂于固体琼脂培养基, 在微需氧环境, 37 ℃下培养, 3-5 d后收集细菌. 经菌落形态、涂片染色显微镜下观察以及生化反应(尿素酶、化酶和触酶)证实.
1.2.3 H. pylori基因组DNA提取: 刮取培养的菌落, 悬于适量TE缓冲液, 以GES液(含异硫氰酸胍, EDTA, sarkosyl)-氯仿法提取DNA, 加适量TE液, 4 ℃过夜溶解. 于-20 ℃保存备用.
1.2.4 引物设计与合成: 参照GenBank中的H. pylori 26695标准株(GenBank登录号: NC_000915)的全序列设计PCR引物: 上游引物 P1: 5'-ATGCTAGGACTTGTATTGTTATATG-3'; 下游引物 P2: 5'-CACCCAGTGTTGGATAAAGAG-3'. 引物由上海生工生物工程技术服务有限公司合成.
1.2.5 PCR扩增ureI片段: 以获得的H. pylori基因组DNA为模板, P1和P2为引物, 用Taq DNA聚合酶进行PCR扩增(在20 μL反应体系中, 分别加入dNTP 2.0 μL, 10×PCR Buffer 2.0 μL, DNA模板 1 μL, P1和P2引物各0.5 μL, Taq DNA聚合酶0.3 μL, ddH2O 13.7 μL, 按照PCR条件扩增, 扩增条件为: 94 ℃预变性5 min后, 按94 ℃ 30 s, 54.5 ℃ 30 s, 72 ℃ 40 s, 38个循环, 最后72 ℃延伸10 min. PCR产物经1%的琼脂糖凝胶电泳检测.
1.2.6 TA克隆: 胶回收试剂盒回收目的片段, 回收PCR产物与pMD18-T载体在16 ℃连接过夜. 连接产物转化DH5α感受态细胞, 转化后的细菌涂布于含100 mg/L氨苄青霉素的LB平板上, 37 ℃培养12 h. 挑取菌落转种于含氨苄青霉素100 mg/L的LB液体培养基, 37 ℃振荡培养12 h后收集细菌, 质粒抽提试剂盒抽提质粒.
1.2.7 重组质粒的酶切鉴定和序列测定: 获得重组质粒pMD18-T-ureI后用HindⅢ和EcoRⅠ双酶切, 酶切产物经1%的凝胶电泳鉴定. 为了进一步从序列的准确性上得到验证, 将阳性克隆菌株送到上海生物工程有限公司测序.
1.2.8 ureI序列比对: 用MEGA 4.0和DNAstar 7.0生物软件对菌株测序结果和公布H. pylori标准株26695的ureI序列进行比对分析.
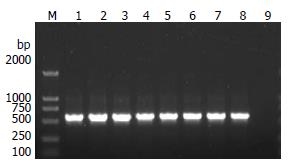
不同疾病来源的60例H. pylori菌株DNA经PCR扩增, 进行1%的琼脂糖凝胶电泳, 在约585 bp附近可见均1条带, 与预期大小相符, 见图1.
镇江地区ureI基因检测结果显示, 60例不同胃十二指肠疾病来源的H. pylori菌株中ureI总阳性率为100%(60/60).
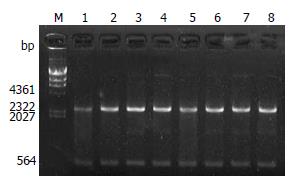
将8例不同疾病来源H. pylori菌株的ureI克隆于pMD18-T载体后用HindⅢ和EcoRⅠ双酶切鉴定, 所获片段大小与预期相符, 见图2.
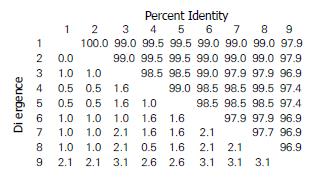
采用MEGA 4.0生物软件对菌株测序结果以及GenBank公布的H. pylori标准株26695序列进行比对. 结果发现镇江地区不同疾病来源的菌株与标准菌株26695的核苷酸序列同源性达95.6%-96.9%, 而不同疾病来源菌株之间的核苷酸序列同源性高达97.4%-99.8%. 镇江地区不同疾病来源的菌株与标准菌株26695的氨基酸序列的同源性96.9%-97.9%, 不同疾病来源菌株之间的氨基酸序列高达97.9%-100%, 虽然26695标准株的UreI蛋白第54位和第74位的组氨酸和丝氨酸在8例镇江地区不同疾病来源的H. pylori中均被天冬酰胺取代(图3-4), 但是4个保守的组氨酸残基(H71、H123、H131和H193)以及胞内环保守区域均未发生变异.
H. pylori的尿素酶基因是由7个基因组成的一基因簇, 编码UreA和UreB两个结构亚单位和5个辅助蛋白(UreI、UreE、UreF、UreG和UreH). ureI基因全长585 bp, 编码相对分子质量21 600 Da的膜蛋白, 有6个跨膜螺旋序列, 无信号肽. 早期的研究认为是H. pylori表面的尿素酶对于他在胃内的酸性环境下定植起了关键作用, 但是进一步的研究表明, 当pH低于4.5时, 细胞表面的尿素酶就失去了活性, 因此推测细胞表面的尿素酶对于H. pylori在胃内定居作用微弱, 胞质内的尿素酶可能发挥主要作用[6]. 但是胃内尿素的浓度一般在1-3 mmol/L之间, 尿素渗入脂质双层的速度不足以使细菌内部的尿素酶达到饱和状态. Weeks et al[4]证明了UreI蛋白是一种pH依赖的尿素通道蛋白. 尿素和氢离子通过外膜的孔隙扩散入周质, 使UreI的构象发生变化, 允许尿素快速进入胞质, 被尿素酶迅速水解, 产生二氧化碳和氨气, 氨气快速扩散到周质, 中和周质腔中的H+, 当周质腔中的pH值升至6.2时, 形成的UreI尿素通道再次关闭, 阻止尿素转运, 避免胞质过度碱化[7-9]. Mollenhauer-Rektorschek et al[10]证实ureI-突变株H. pylori在沙鼠胃内不能定植. 虽然ureI基因是H. pylori在胃内酸性环境下的生存和定植所必需的, 但是UreI蛋白与尿素酶的活性却无必要关系[11]. 在酸性pH条件下, UreI蛋白4个保守的组氨酸残基(H71、H123、H131和H193)以及胞内环保守区域对氨的生成起到决定性的作用, 如果发生上述基因点突变, 则会导致UreI通道的失活[12]. 如果能采取有效的手段抑制UreI蛋白的活性, 则有可能清除胃内的H. pylori, 这一观点为根除H. pylori提供了一个新思路[10].
目前H. pylori感染的分子生物学诊断, 常用的检测基因有尿素酶基因(ureA)、16s rRNA基因、26-ku种属特异抗原基因(SSA)、磷酸葡萄糖氨基转移酶基因(glmM)、细胞毒素相关基因(cagA)等[13-15]. Lu et al[14]认为glmM是诊断H. pylori感染灵敏度和特异度较好的指标, 吴莺 et al检测了镇江地区不同胃十二指肠疾病患者H. pylori中cagA的阳性率为93.3%[16], 但是尚未见到应用ureI基因作为诊断H. pylori感染的报道. ureI基因是H. pylori所特有的. 本实验中, 我们应用PCR技术检测了镇江地区不同胃十二指肠疾病来源的60例H. pylori菌株, ureI基因的检出率高达100%, 说明ureI基因可作为诊断H. pylori感染的良好的分子标记. PCR是检测H. pylori最敏感的技术, 简便、快捷、特异性强[17-18], 且对原材料的要求低, 除新鲜活检标本外, 还可检测唾液、胃液、牙菌斑、粪便、石蜡包埋和已做过快速尿素酶试验的标本.
H. pylori通过点突变、等位基因交换、基因重排及序列插入等使基因呈现出多样性, 导致H. pylori不同基因组间的差异极大, H. pylori的尿素酶基因也呈现出同样的特点[19]. 克隆测序不同胃十二指肠疾病来源H. pylori ureI基因核苷酸序列虽然与国际标准株26695不同, 但与之相比核苷酸序列同源性达到95.6%-96.9%, 推定氨基酸序列的同源性达到96.9%-97.9%, 并且4个保守的组氨酸残基(H71、H123、H131和H193) 以及胞内环保守区域均未发生变异. UreI蛋白结构高度保守, 不同H. pylori菌株之间同源性非常高. 这为UreI重组疫苗的制备提供了依据. 本研究表明不同疾病来源的幽门螺杆菌ureI基因高度保守, ureI基因的PCR扩增可以作为鉴定H. pylori的分子标记.
H. pylori是嗜中性、微需氧性革兰氏阴性杆菌, 世界范围内约有50%的人群感染, 为了能够在胃环境中存活, H. pylori进行了一系列的抗酸、耐酸机制的进化过程. 其最大特征是能产生大量高活性的尿素酶, 将尿素降解为氨和二氧化碳, 氨中和胃酸.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
Weeks及Sachs研究发现UreI有6个螺旋构成的2个环状结构(PL1和PL2), 其中PL1对中性环境中限制尿素转运重要, 而PL2对酸性环境激活尿素转运很重要.
本研究证实, 不同疾病来源的H. pylori ureI基因高度保守, ureI基因的PCR扩增可以作为鉴定H. pylori的一种新的较好的分子标记, 以UreI为抗原的H. pylori疫苗将具有广阔的应用前景.
本研究进行了H. pylori尿素通道蛋白基因ureI的检测、克隆及序列分析, 结论有一定的应用价值.
编辑: 李军亮 电编:何基才
| 1. | Arfaoui D, Elloumi H, Ben Abdelaziz A. [Helicobacter pylori and gastric adenocarcinoma]. Tunis Med. 2009;87:231-236. [PubMed] |
| 2. | Peter S, Beglinger C. Helicobacter pylori and gastric cancer: the causal relationship. Digestion. 2007;75:25-35. [PubMed] [DOI] |
| 3. | Herrera V, Parsonnet J. Helicobacter pylori and gastric adenocarcinoma. Clin Microbiol Infect. 2009;15:971-976. [PubMed] [DOI] |
| 4. | Weeks DL, Eskandari S, Scott DR, Sachs G. A H+-gated urea channel: the link between Helicobacter pylori urease and gastric colonization. Science. 2000;287:482-485. [PubMed] [DOI] |
| 5. | Bury-Moné S, Skouloubris S, Labigne A, De Reuse H. [UreI: a Helicobacter pylori protein essential for resistance to acidity and for the early steps of murine gastric mucosa infection]. Gastroenterol Clin Biol. 2001;25:659-663. [PubMed] |
| 6. | Hong W, Sano K, Morimatsu S, Scott DR, Weeks DL, Sachs G, Goto T, Mohan S, Harada F, Nakajima N. Medium pH-dependent redistribution of the urease of Helicobacter pylori. J Med Microbiol. 2003;52:211-216. [PubMed] [DOI] |
| 7. | Stingl K, De Reuse H. Staying alive overdosed: how does Helicobacter pylori control urease activity? Int J Med Microbiol. 2005;295:307-315. [PubMed] [DOI] |
| 8. | Sachs G, Weeks DL, Wen Y, Marcus EA, Scott DR, Melchers K. Acid acclimation by Helicobacter pylori. Physiology (Bethesda). 2005;20:429-438. [PubMed] [DOI] |
| 9. | Rektorschek M, Buhmann A, Weeks D, Schwan D, Bensch KW, Eskandari S, Scott D, Sachs G, Melchers K. Acid resistance of Helicobacter pylori depends on the UreI membrane protein and an inner membrane proton barrier. Mol Microbiol. 2000;36:141-152. [PubMed] [DOI] |
| 10. | Mollenhauer-Rektorschek M, Hanauer G, Sachs G, Melchers K. Expression of UreI is required for intragastric transit and colonization of gerbil gastric mucosa by Helicobacter pylori. Res Microbiol. 2002;153:659-666. [PubMed] [DOI] |
| 11. | Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infect Immun. 1998;66:4517-4521. [PubMed] |
| 12. | Weeks DL, Sachs G. Sites of pH regulation of the urea channel of Helicobacter pylori. Mol Microbiol. 2001;40:1249-1259. [PubMed] [DOI] |
| 13. | Zsikla V, Hailemariam S, Baumann M, Mund MT, Schaub N, Meier R, Cathomas G. Increased rate of Helicobacter pylori infection detected by PCR in biopsies with chronic gastritis. Am J Surg Pathol. 2006;30:242-248. [PubMed] [DOI] |
| 14. | Lu JJ, Perng CL, Shyu RY, Chen CH, Lou Q, Chong SK, Lee CH. Comparison of five PCR methods for detection of Helicobacter pylori DNA in gastric tissues. J Clin Microbiol. 1999;37:772-774. [PubMed] |
| 15. | Smith SI, Oyedeji KS, Arigbabu AO, Cantet F, Megraud F, Ojo OO, Uwaifo AO, Otegbayo JA, Ola SO, Coker AO. Comparison of three PCR methods for detection of Helicobacter pylori DNA and detection of cagA gene in gastric biopsy specimens. World J Gastroenterol. 2004;10:1958-1960. [PubMed] |
| 17. | Oyedeji KS, Smith SI, Coker AO, Arigbabu AO. Antibiotic susceptibility patterns in Helicobacter pylori strains from patients with upper gastrointestinal pathology in western Nigeria. Br J Biomed Sci. 2009;66:10-13. [PubMed] |
| 18. | Chisholm SA, Owen RJ. Application of polymerase chain reaction-based assays for rapid identification and antibiotic resistance screening of Helicobacter pylori in gastric biopsies. Diagn Microbiol Infect Dis. 2008;61:67-71. [PubMed] [DOI] |
| 19. | Falush D, Kraft C, Taylor NS, Correa P, Fox JG, Achtman M, Suerbaum S. Recombination and mutation during long-term gastric colonization by Helicobacter pylori: estimates of clock rates, recombination size, and minimal age. Proc Natl Acad Sci USA. 2001;98:15056-15061. [PubMed] [DOI] |