修回日期: 2009-11-22
接受日期: 2009-11-23
在线出版日期: 2009-12-28
目的: 探讨己酮可可碱(PTX)对三硝基苯磺酸(TNBS)诱导的大鼠溃疡性结肠炎(UC)肠黏膜炎性细胞因子TNF-α及IL-1β表达的影响.
方法: 应用三硝基苯磺酸(TNBS)/乙醇灌肠制备大鼠UC的模型. 实验设正常对照组(C组)、TNBS损伤组(T组)、PTX治疗组(D组), 从造模后第3天开始给予D组大鼠PTX腹腔注射治疗, C组、T组则注入等量生理盐水, bid, 连用5 d. 观察疾病活动指数(DAI). 处死大鼠, 应用RT-PCR(逆转录-聚合酶链反应)方法半定量检测技术, 对UC大鼠结肠黏膜中TNF-α、IL-1β mRNA表达进行测定.
结果: TNBS损伤组大鼠肠黏膜TNF-α、IL-1β mRNA的表达及DAI评分明显高于正常对照组和PTX治疗组(6.85±2.78 vs 0.45±0.11, 1.85±2.01; 1.02±0.16 vs 0.61±0.08, 0.74±0.16; 0.95±0.17 vs 0.57±0.07, 0.64±0.13, 均P<0.05), 而PTX治疗组与对照组相比则无明显差异(均P>0.05).
结论: UC的发生过程中炎性细胞因子TNF-α及IL-1β表达升高; 己酮可可碱可能通过降低炎性细胞因子TNF-α及IL-1β的表达而发挥其干预作用.
引文著录: 钟江鹏, 李登欣, 李石, 李杰, 徐静. 己酮可可碱对大鼠溃疡性结肠炎TNF-α及IL-1β表达的影响. 世界华人消化杂志 2009; 17(36): 3679-3683
Revised: November 22, 2009
Accepted: November 23, 2009
Published online: December 28, 2009
AIM: To investigate the effects of pentoxifylline (PTX) on the expression of tumor necrosis factor-alpha (TNF-α) and interleukin-1β (IL-1β) in trinitrobenzene sulfonic acid (TNBS)-induced ulcerative colitis (UC) in rats.
METHODS: UC was induced in rats with TNBS and ethanol. The rats were randomly divided into three groups: normal group (C), TNBS group (T), and PTX group (D). Three days after UC was induced, the rats in the PTX group received a PTX injection every 12 hours for five consecutive days, while the remaining two groups received an injection of distilled water. The disease activity index (DAI) was evaluated daily. The expression of TNF-α and IL-1β mRNAs was measured by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with the normal group and the PTX group, the expression of TNF-α and IL-1β mRNAs and DAI in the TNBS group were markedly higher (6.85 ± 2.78 vs 0.45 ± 0.11 and 1.85 ± 2.01; 1.02 ± 0.16 vs 0.61 ± 0.08 and 0.74 ± 0.16; and 0.95 ± 0.17 vs 0.57 ± 0.07 and 0.64 ± 0.13, respectively; all P < 0.05). No significant differences were noted in the expression levels of TNF-α and IL-1β mRNAs and DAI between the normal group and the PTX group (all P > 0.05).
CONCLUSION: The expression of proinflammatory factors TNF-α and IL-1β mRNAs increases in rat ulcerative colitis. PTX exerts protective effects against UC possibly by downregulating the expression of TNF-α and IL-1β mRNAs.
- Citation: Zhong JP, Li DX, Li S, Li J, Xu J. Pentoxifylline suppresses the expression of tumor necrosis factor-α and interleukin-1β in ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(36): 3679-3683
- URL: https://www.wjgnet.com/1009-3079/full/v17/i36/3679.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i36.3679
溃疡性结肠炎(ulcerative colitis, UC)是一种比较常见的慢性非特异性肠道炎症疾病, 且在我国发病率有增高的趋势[1]. 该病病程长, 易反复发作, 其发病机制尚未完全阐明. 目前, UC的治疗仍然是临床上一大难题, 传统的三类药物(水杨酸类、类固醇激素和免疫抑制剂)对UC的缓解率在80%左右, 最佳的维持缓解方案也仅能使复发降低50%左右, 约有1/3的病例最终需手术治疗, 而且这3类药不良反应也较大, 严重影响了其广泛运用. 因此, 寻找新的治疗药物已是当今UC研究领域的一大热点. PTX(己酮可可碱)为甲基黄嘌呤衍生物, 能抑制细胞内环核苷酸磷酸二酯酶活性, 使细胞内cAMP浓度增加. 目前, 主要用于改善血液流变学, 近来研究发现他还有抗肿瘤和免疫抑制作用[2-4], 从而自上游或源头发挥抗TNF-α等致炎性细胞因子作用. 2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzenesulfonicacid, TNBS)诱导的结肠炎模型, 在临床和免疫等方面与人类炎症性肠病极为相似[5], 因此, 本研究将探讨PTX对TNBS诱导的UC鼠模型肠黏膜TNF-α及IL-1β表达的影响, 并探讨其机制, 为寻找一种具有开发潜力的治疗UC的新药物提供重要的理论依据.
♂Wistar大鼠30只, 体质量200±20 g, 购于山东中医药大学动物中心. TNBS购自Sigma公司, PTX购自日本WAKO公司, TRIzol试剂盒, 逆转录试剂盒及PCR试剂盒购自上海生物工程公司, 其他试剂为国产分析纯. 美国伯乐公司的PCR仪(BIO-RAD MyCyder), 美国HE33水平电泳槽, 美国UVP凝胶成像分析系统(Biospectrum AC).
1.2.1 造模及分组: 将30只♂Wistar大鼠, 随机分为对照组(C组)、TNBS损伤组(T组)、PTX治疗组(D组), 每组10只. 给予标准饮食1 wk后开始制备模型. 用100 mL/L水合氯醛(300 mg/kg)腹腔轻度麻醉大鼠后, 将直径2 mm长约12 cm的橡胶输液管(术前石蜡油润滑)由肛门轻缓插入, 深约8 cm, 再将400 mL/L的乙醇0.3 mL和50 mg/L TNBS(100 mg/kg)经细管注入. 造模后第3天, 取D组大鼠, 每只腹腔内注入200 μL PTX溶液(生理盐水稀释), PTX按5 mg/kg给予, bid. C组、T组则注入等量生理盐水, 连用5 d. 每日观察大鼠一般状况及粪便性状, 记录评分, 评分标准采用疾病活动指数(DAI)[6], DAI与组织学治愈具有良好相关性[7-8], DAI评分表见表1.
| 记分 | 体质量下降(%) | 大便性状 | 便血 |
| 0 | 无 | 正常 | 阴 |
| 1 | 1-5 | - | - |
| 2 | 6-10 | 半稀便 | 隐血(+) |
| 3 | 11-15 | - | - |
| 4 | >15 | 稀便 | 肉眼血便 |
1.2.2 标本收集: 实验结束后, 水合氯醛麻醉大鼠, 将其仰卧固定于手术台, 腹部正中切口, 分离结肠组织(从肛门至盲肠约8 cm), 沿肠系膜纵轴剪开, 冰生理盐水冲洗干净, 取50-100 mg肠黏膜迅速置于液氮中用于提取RNA[9].
1.2.3 逆转录-聚合酶链反应(RT-PCR)测定炎性细胞因子的表达: 按TRIzol试剂盒说明提取总RNA, 紫外分光光度计测定总RNA浓度, 重复测定3次, 取5 μg总RNA按说明书进行逆转录反应合成cDNA, 按PCR说明书将cDNA进行PCR扩增. 以β-actin为内参照, β-actin引物序列如下: 上游: GAGAGGGAAATCGTGCGTGAC, 下游CATCTGCTGGAAGGTGGACA. IL-1β上游引物为CCTGTGGCCTTGGGCCTCAA, 下游引物为GGTGCTGATGTACCAGTTGGG, 以95 ℃预变性3 min, 然后进行循环扩增, 95 ℃变性45 s, 56 ℃退火40 s, 72 ℃延伸1 min, 共35个循环, 最后72 ℃延伸10 min. TNF-α上游引物为CCAGGAGAAAGTCAGCCTCCT, 下游引物为TCATACCAGGGCTTGAGCTCA, 以95 ℃预变性3 min, 然后进行循环扩增, 95 ℃变性45 s, 55 ℃退火40 s, 72 ℃延伸1 min, 共35个循环, 最后72 ℃延伸10 min. 扩增后以15 g/L琼脂糖凝胶(含0.5 mg/L的溴化乙啶)电泳, 用凝胶成像分析系统拍照并分析, 以目的基因条带和内参的灰度值比值作为目的基因的相对表达量.
统计学处理 各组数据均以mean±SD表示, 两组间比较用单因素方差分析, 采用SPSS16.0统计软件进行分析.
造模后第2天即出现腹泻, T组大鼠实验过程中一直有腹泻, 部分出现肉眼血便, 所有大鼠均粪便隐血阳性. D组大鼠经PTX治疗后腹泻次数减少, 部分有隐血阳性, 一直未出现肉眼血便. C组大鼠无改变. DAI评分显示, T组明显高于D组和C组(P<0.05), 而C组和D组之间的差异则无显著性(P>0.05, 表2).
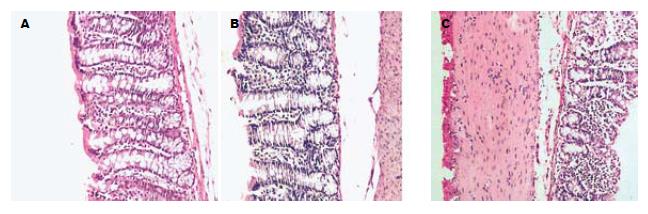
T组镜下可见腺管排列紊乱, 黏膜及黏膜下层血管高度扩张充血, 大量炎细胞浸润, 以中性粒细胞、淋巴细胞为主. 而PTX治疗组镜下黏膜及黏膜浅层仅有少量中性粒细胞、淋巴细胞浸润, 组织损伤较轻(图1).
UC是一种以侵犯直肠和结肠黏膜与黏膜下层为主的慢性肠道炎症, 其发病机制可能与易感基因、免疫系统异常等的相互作用有关[10-11]. 免疫反应异常是造成UC和组织损伤的重要因素, 而细胞因子又在异常的免疫反应中起着重要作用[12-14].
在众多的细胞因子中, IL-1β和TNF-α已成为当前的研究热点之一. IL-1β能通过自分泌或旁分泌刺激其他细胞因子和炎症递质的产生, 诱发抗原提呈及细胞表面免疫分子的表达, 为T淋巴细胞活化提供第二信使, 促进B细胞的增殖以及分化, 从而介导免疫球蛋白的分泌, 激活补体, 增强细胞免疫和体液免疫介导的组织损伤过程. TNF-α为促炎性蛋白[15], 主要由脂多糖(LPS)激活的单核巨噬细胞产生, 具有广泛的生物活性, 除抗肿瘤外, 对免疫反应、机体代谢、炎症反应均有重要的调节介导作用[16].
Rachmilewitz et al[17]的研究表明, 在UC患者中, 活动性UC病变部位的TNF-α、IL-1β与正常部位相比明显增高, 是正常的7倍和3倍左右. 同时Hadziselimovie et al[18]、Yamamoto et al[19]和Raddatz et al[20]的研究也得出了类似结果. 与这些研究结果一致, 从本实验中, 我们也发现, UC鼠肠黏膜组织中TNF-α、IL-1β mRNA表达与对照组相比明显增强, 进一步证实了这两种因子可能参与了UC的发生和发展过程, 但目前还没足够的特异性替代临床表现作为UC的标志[21-22].
一直以来, PTX作为血管活性药物用于血管功能不全性疾病的治疗[23], 可以减少白细胞与内皮细胞的黏附[24]. 近年来有研究发现其具有较强的抗炎和免疫调节作用. 王祥和 et al的研究表明PTX抑制TNF mRNA的转录[25-27], 本研究也证实, 大鼠应用PTX治疗后, 显著改善了UC的症状, 同时与UC组相比两种因子的表达也明显降低. 其机制可能与PTX增加细胞内cAMP浓度, 抑制TNF-α和IL-1β基因的转录活性, 降低了TNF-α、IL-1β等细胞因子的表达, 从而减轻了炎症反应有关. 本研究也为该药抗炎及调节免疫反应的临床应用价值提供了一定的理论依据.
尽管细胞因子在UC发病中的作用基本得到公认, 但调控这些因子释放的机制目前仍不十分清楚. 近年来, 随着对核因子(NF)-κB结构与功能研究的深入, 细胞因子与NF-κB的关系已引起了人们高度的重视. 有研究表明, NF-κB在炎症性肠病发生过程起着重要作用, 许多细胞因子包括TNF-α刺激均能导致NF-κB的活化[28-29]. 本研究中PTX使大鼠症状明显减轻, 是否是PTX抑制了NF-κB的激活, 减少了TNF-α、IL-1β mRNA的表达, 减轻炎性细胞浸润的原因, 还有待考证, 这也是我们进一步研究的方向.
PTX(己酮可可碱)为甲基黄嘌呤衍生物, 能抑制细胞内环核苷酸磷酸二酯酶活性, 使细胞内CAMP浓度增加, 近来研究发现他还有抗肿瘤作用和免疫抑制作用. 目前, 主要用于治疗改善血液流变学. 但对PTX进行分子水平的研究, 探讨其治疗溃疡性结肠炎(UC)的作用及机制报道甚少.
房静远, 教授, 上海交通大学医学院附属仁济医院 上海市消化疾病研究所
近年, 越来越多的研究证明, 免疫调节异常在UC发病机制中起着相当重要的作用, 但到底是什么原因导致的免疫调节异常还不是很清楚, 而细胞因子IL-1β和TNF-α在分子免疫中有着重要作用, 成为当前的研究热点之一.
Hadzisclimove et al证实UC患者组织、肠腔和血清中TNF-α水平与疾病活动相关, 用抗TNF-α抗体治疗, 可使肠炎症很快消退.
本研究发现PTX对大鼠UC中TNF-α及IL-1β表达的影响机制涉及一些炎性细胞因子, 有一定新意和可读性.
编辑: 李军亮 电编:何基才
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 2. | Samlaska CP, Winfield EA. Pentoxifylline. J Am Acad Dermatol. 1994;30:603-621. [PubMed] [DOI] |
| 3. | Ward A, Clissold SP. Pentoxifylline. A review of its pharmacodynamic and pharmacokinetic properties, and its therapeutic efficacy. Drugs. 1987;34:50-97. [PubMed] [DOI] |
| 5. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 7. | Murthy S, Cooper HS, Yoshitake H, Meyer C, Meyer CJ, Murthy NS. Combination therapy of pentoxifylline and TNFalpha monoclonal antibody in dextran sulphate-induced mouse colitis. Aliment Pharmacol Ther. 1999;13:251-260. [PubMed] [DOI] |
| 8. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 10. | Zhang SZ, Zhao XH, Zhang DC. Cellular and molecular immunopathogenesis of ulcerative colitis. Cell Mol Immunol. 2006;3:35-40. [PubMed] |
| 11. | Papadakis KA, Targan SR. Current theories on the causes of inflammatory bowel disease. Gastroenterol Clin North Am. 1999;28:283-296. [PubMed] [DOI] |
| 12. | Schreiber S, Raedler A, Stenson WF, MacDermott RP. The role of the mucosal immune system in inflammatory bowel disease. Gastroenterol Clin North Am. 1992;21:451-502. [PubMed] |
| 13. | Rogler G, Andus T. Cytokines in inflammatory bowel disease. World J Surg. 1998;22:382-389. [PubMed] [DOI] |
| 14. | Ishiguro Y. Mucosal proinflammatory cytokine production correlates with endoscopic activity of ulcerative colitis. J Gastroenterol. 1999;34:66-74. [PubMed] [DOI] |
| 16. | 陈 英群, 马 贵同. 细胞因子与溃疡性结肠炎相关性研究进展. 中国中西医结合消化杂志. 2003;11:57-59. |
| 17. | Rachmilewitz D, Karmeli F, Shteingart S, Lee J, Takabayashi K, Raz E. Immunostimulatory oligonucleotides inhibit colonic proinflammatory cytokine production in ulcerative colitis. Inflamm Bowel Dis. 2006;12:339-345. [PubMed] [DOI] |
| 18. | Hadziselimovic F, Emmons LR, Gallati H. Soluble tumour necrosis factor receptors p55 and p75 in the urine monitor disease activity and the efficacy of treatment of inflammatory bowel disease. Gut. 1995;37:260-263. [PubMed] [DOI] |
| 19. | Yamamoto T, Umegae S, Kitagawa T, Matsumoto K. Systemic and local cytokine production in quiescent ulcerative colitis and its relationship to future relapse: a prospective pilot study. Inflamm Bowel Dis. 2005;11:589-596. [PubMed] [DOI] |
| 20. | Raddatz D, Bockemühl M, Ramadori G. Quantitative measurement of cytokine mRNA in inflammatory bowel disease: relation to clinical and endoscopic activity and outcome. Eur J Gastroenterol Hepatol. 2005;17:547-557. [PubMed] [DOI] |
| 21. | Bitton A, Peppercorn MA, Antonioli DA, Niles JL, Shah S, Bousvaros A, Ransil B, Wild G, Cohen A, Edwardes MD. Clinical, biological, and histologic parameters as predictors of relapse in ulcerative colitis. Gastroenterology. 2001;120:13-20. [PubMed] [DOI] |
| 22. | Nielsen OH, Vainer B, Madsen SM, Seidelin JB, Heegaard NH. Established and emerging biological activity markers of inflammatory bowel disease. Am J Gastroenterol. 2000;95:359-367. [PubMed] |
| 23. | Mandell GL. ARDS, neutrophils, and pentoxifylline. Am Rev Respir Dis. 1988;138:1103-1105. [PubMed] |
| 28. | Neurath MF, Becker C, Barbulescu K. Role of NF-kappaB in immune and inflammatory responses in the gut. Gut. 1998;43:856-860. [PubMed] |
| 29. | Blackwell TS, Christman JW. The role of nuclear factor-kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol. 1997;17:3-9. [PubMed] |