修回日期: 2009-11-14
接受日期: 2009-11-16
在线出版日期: 2009-12-18
目的: 探讨TFF3蛋白在贲门肠化及肠化伴不典型增生组织中的表达与贲门癌变的相关性.
方法: 采用免疫组织化学SP法, 检测河南贲门癌高发区贲门炎组织24例、肠化组织52例、肠化伴不典型增生组织65例及贲门癌组织35例中TFF3蛋白的表达变化.
结果: 在贲门炎及肠化组织中, TFF3蛋白主要表达在柱状细胞的纹状缘, 肠化伴不典型增生及癌变组织中, 主要表达在细胞质中. TFF3蛋白在贲门炎、肠化组织、肠化伴不典型增生及癌变组织中的阳性表达率分别为20.8%、44.2%、46.2%和54.3%, 贲门黏膜组织从正常至不典型增生再至癌变这一过程与TFF3表达阳性率呈正相关(r = 0.232, P<0.05). TFF3蛋白表达的位点与病理类型相关(Kappa = 0.490).
结论: TFF3蛋白在细胞质中的过表达参与了贲门癌变过程, 有可能成为贲门组织早期癌变的预警分子.
引文著录: 冯笑山, 郝曙光, 王立东, 高社干, 王公平, 侯建峰, 茹艺, 陈强. TFF3在贲门肠化组织中的蛋白表达及其与癌变的相关性. 世界华人消化杂志 2009; 17(35): 3640-3643
Revised: November 14, 2009
Accepted: November 16, 2009
Published online: December 18, 2009
AIM: To explore the relationship between the expression of trefoil factor 3 (TFF3) protein and the evolution of gastric cardiac adenocarcinoma.
METHODS: The streptavidin-peroxidase immunohistochemistry method was used to detect TFF3 protein expression in 24 cardiac gastritis specimens, 52 intestinal metaplasia specimens, 65 specimens of intestinal metaplasia with dysplasia and 35 gastric cardiac adenocarcinoma specimens from a high incidence area of gastric cardiac adenocarcinoma in Henan.
RESULTS: TFF3 protein is predominantly expressed in the striated border of the columnar cells in cardiac gastritis and intestinal metaplasia tissues, and in the cytoplasm in dysplasia and carcinoma tissues. The positive rates of TFF3 protein in cardiac gastritis, intestinal metaplasia, dysplasia, and carcinoma tissues were 20.8%, 44.2%, 46.2% and 54.3%, respectively. The expression of TFF3 was correlated well with the pathological grade of the lesions (r = 0.232, P < 0.05). The location of TFF3 expression was correlated with the pathological types of the lesions (Kappa = 0.490).
CONCLUSION: Overexpression of TFF3 protein in the cytoplasm is involved in gastric cardiac carcinogenesis and might be one of important risk factors for gastric cardiac adenocarcinoma.
- Citation: Feng XS, Hao SG, Wang LD, Gao SG, Wang GP, Hou JF, Ru Y, Chen Q. Relationship between TFF3 expression and gastric cardiac carcinogenesis. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3640-3643
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3640.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3640
在贲门癌发生之前贲门黏膜发生的不同病理变化称之为贲门黏膜的癌前期病变, 肠化是其中重要的一个病变环节, 深入对贲门肠化的研究有助于明确贲门肠化和癌变发生的关系, 发现癌变的预警分子, 为贲门癌的早期预防诊断提供理论依据, 并为进一步研究贲门癌的演进过程中的具体机制提供线索. TFF3蛋白是三叶因子家族(trefoil factors, TFFs)中的一员, 正常情况下仅在大肠上皮黏膜中高表达[1-2], 然而以往的研究表明TFF3蛋白对胃黏膜的肠化组织也具有偏爱性[3-4]. 本试验利用兔多克隆TFF3蛋白抗体对贲门各级病变组织进行检测, 初步探讨TFF3蛋白在贲门肠化及其癌变中的作用及意义.
入组标本均来自河南贲门癌高发区林州地区, 共计176例组织. 其中贲门炎组织24例, 男16例, 女8例, 平均年龄47.5±12.3岁; 贲门肠化组织52例, 男38例, 女14例, 平均年龄55.2±11.1岁; 贲门肠化伴不典型增生组织65例, 男47例, 女18例, 平均年龄60.4±7.7岁; 贲门癌组织35例, 男26例, 女9例, 平均年龄59.4±9.3岁. 患者术前均未接受放疗和化疗. 所有组织均经850 mL/L乙醇固定, 常规石蜡包埋. 一抗TFF3蛋白购自北京博奥森生物技术有限公司(兔源多克隆抗体, bs-0535R, 工作浓度1:150); SP试剂盒, DAB显色剂均购自福州迈新公司.
1.2.1 组织制作: 每个石蜡包埋的组织标本连续切4张(4 μm厚), 每个组织的第1张及最后1张常规HE染色, 以重新核实病理诊断并确保病变存在. 第2张做TFF3蛋白组织化学染色, 另一张备用.
1.2.2 免疫组织化学: 严格按照SP试剂盒标准步骤进行. 操作流程均在室温中进行, 同时为排除实验中的假阳性和假阴性, 每次组织化学染色均包含已知阳性片为阳性对照和PBS液代替一抗设为阴性对照.
1.2.3 结果判定: 采用双盲法, 有两名病理学专家独立观察, 计数相差10%以上重新计数, 染色结果采用半定量积分的方法, 先在低倍镜下观察, 然后在400倍高倍镜下随机计数5个视野, 染色面积分为0(0%), 1(0%-25%), 2(25%-50%), 3(50%-75%), 4(75%-100%)5个级别; 同时将染色强度分为0(蓝色), 1(淡黄色), 2(棕色), 3(深棕色)4个级别. 根据染色面积和强度的乘积, 得出以下结论: 阴性(0), +(<4), ++(4-8), +++(8-12).
统计学处理 采用SPSS15.0软件包数据分析, 定性变量分析采用χ2检验或者Fisher确切概率检验法; 两个病理专家对结果的判读采用Kappa一致性检验; 检验水准α = 0.05.
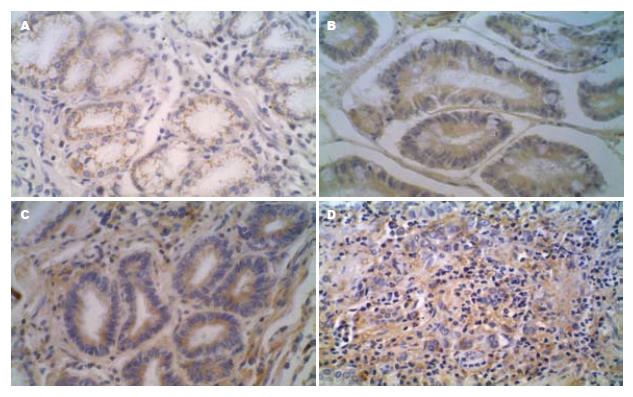
在贲门炎组织中, TFF3蛋白主要表达在柱状细胞的胞质腔缘侧(纹状缘), 染色强度以淡黄色为主(图1A); 贲门肠化组织中, TFF3蛋白主要表达在杯状细胞和柱状细胞的纹状缘, 也见于杯状细胞的细胞质中, 染色以淡黄色和棕色为主(图1B); 不典型增生组织中, TFF3蛋白主要表达在杯状细胞和柱状细胞的细胞质中, 染色以棕色和深棕色为主(图1C); 贲门癌组织中, TFF3蛋白主要表达在癌细胞的细胞质中, 染色以棕色为主(图1D).
TFF3蛋白在贲门炎、肠化、肠化伴不典型增生及贲门癌组织中表达呈上升趋势, 等级相关分析结果显示, 贲门黏膜组织从正常至不典型增生再至癌变这一过程与TFF3表达阳性率呈正相关(r = 0.232, P<0.05, 表1). 贲门炎、肠化及贲门癌组间比较具有统计学意义(均P<0.05). 肠化组与肠化伴不典型增生组阳性率比较无统计学意义(P>0.05), 但其染色面积及其强度显著增加.
| 分组 | n | TFF3蛋白 n(%) | |||
| - | + | ++ | +++ | ||
| 贲门炎 | 24 | 19(79.2) | 5(20.8) | 0(0.0) | 0(0.0) |
| 贲门肠化 | 52 | 29(55.8) | 5(17.2) | 16(30.8) | 2(3.8) |
| 肠化伴不典型增生 | 65 | 34(52.3) | 2(3.1) | 9(13.8) | 19(29.2) |
| 贲门癌 | 35 | 16(45.7) | 0(0.0) | 11(31.4) | 8(22.9) |
TFF蛋白家族是一类主要由胃肠道黏液细胞分泌的小分子多肽, 具有特征性三叶状结构, 并因其形状而得名, 其结构较为稳定, 能抗酸、耐热及抗蛋白酶, 对黏膜具有保护作用. 正常生理情况下, TFFs的分布具有组织、细胞特异性. TFF3主要有大肠的杯状细胞分泌到黏膜的纹状缘, 在维持胃肠道黏膜的完整性及修复损伤中起重要作用[5]. 近年来研究发现该蛋白在消化道肿瘤中也高表达, 与肿瘤细胞的凋亡及血管生成有关[6-7].
本研究的重要发现是在贲门癌变过程中, TFF3蛋白的表达位置出现空间和时间上的转变, 即随着组织学分级的逐步改变, 该蛋白表达的位点及强度发生改变, 这可能是该蛋白出现不同作用的结构基础. 以往的研究[5]表明TFF3蛋白是胃肠黏膜中一个重要的黏膜保护因子, 在胃肠黏膜的损伤、修复中起重要作用. 本试验贲门炎组织中, 该蛋白主要表达于柱状细胞的纹状缘, 表达强度也弱, 在该部位其作用可能是通过与黏液糖蛋白相互作用或交联, 形成黏弹性的黏液凝胶层, 以及募集炎症因子到黏膜上皮协同保护各种损害因素对胃肠道上皮细胞的损伤, 从而增强胃肠道黏膜防御屏障, 促进黏膜的愈合修复. 而在贲门肠化组织中, TFF3蛋白主要表达在杯状细胞和柱状细胞的纹状缘, 也见于杯状细胞的细胞质中, 表达强度进一步增强, 呈淡黄色和棕色为主. 这种改变可能是因为贲门黏膜发生肠上皮化生后该蛋白的分泌得到进一步加强, 从而呈现上述的改变. Furuta et al[8]证实在结肠上皮细胞系Caco-2中缺氧环境可诱导TFF3 mRNA及其蛋白的表达. 提示在贲门肠化组织中可能通过缺氧依赖途径促进TFF3的表达, 导致该蛋白在肠化细胞质中的累积. 然而, 表达在不同位置可能所起的作用也发生了改变, 从不典型增生组织到癌组织这一阶段中, TFF3蛋白主要表达在杯状细胞、柱状细胞及癌细胞的细胞质, 染色以棕色和深棕色为主, 出现过表达, 推测该蛋白在细胞质中的累积可能参与了细胞癌变的过程. 以往学者[9-11]的研究也显示该蛋白在胞质中可通过调节MAPK、EGF-R、β-粘连素、PI-3、COX及TXA2-R等途径使细胞免于凋亡以及促进肿瘤血管的生成, 从而加快了肿瘤的发生. 本研究中TFF3蛋白的表达在肠化伴不典型增生到贲门癌的发生过程中逐渐高表达, 表明该蛋白与贲门癌变有关. Taupin et al[12]研究表明TFF3蛋白在正常肠黏膜中、结肠腺瘤及结肠腺癌中均有表达, 且其RNA及其蛋白的表达与结肠腺癌的Duke分期呈负相关, 而与肿瘤细胞分化状态呈正相关, 也表明该蛋白可能参与了癌变过程.
在71.4%的贲门炎及肠化组织中, TFF3蛋白表达在细胞的纹状缘; 77.6%的不典型增生及癌组织表达在细胞质, 其表达的位点与病理类型相关(Kappa = 0.490), 提示该蛋白的作用可能与其表达的位点相关. Madsen et al[13]在大肠组织中的研究也发现了随着组织形态学的演变, TFFs表达的位点及强度都有不同程度的变化, 这与本实验的研究一致.
总之, 本试验初步表明当TFF3蛋白表达在贲门柱状细胞的纹状缘时, 其作用可能主要与黏膜防御、保护及修复作用有关, 这种作用可能阻碍了致癌因素对细胞的影响, 总体表现为抑癌作用. 当TFF3蛋白过表达在贲门不典型增生及癌细胞胞质时, 与组织形态学变化呈正相关, 其作用可能参与了组织癌变过程. 这说明该蛋白在不同的位点、不同的强度表达对组织所产生的影响也不同. 可能对正常或癌前病变细胞起促分化作用, 而对肿瘤细胞促生长作用. 但其具体的作用机制还须大量基础研究, 为肿瘤防治提供新的思路.
贲门癌因其独立的流行病学特征近年来作为独立性疾病而研究, 贲门肠化与癌变的相关性至今仍是研究热点. 三叶因子是一群主要由胃肠道黏膜细胞分泌的小分子多肽, 在黏膜修复与重建及肿瘤的发生、发展过程中发挥了重要的作用. 因此, 对贲门肠化组织中TFF3蛋白的监测有助于阐明贲门肠化与癌变的相关性, 还能为进一步开展贲门癌的分子诊断和治疗提供重要的理论依据.
王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科.
随着分子生物学技术的飞速发展, TFF3蛋白对黏膜的保护作用及其对肿瘤的发生、增殖、浸润和转移的作用逐渐被人们所重视, 但作用机制尚不清楚. 有关TFF3蛋白在癌前期病变中所呈现出的双重作用将会成为当今肿瘤研究领域中的新热点.
以往研究表明, TFF3蛋白是胃肠黏膜中一个重要的黏膜保护因子, 与胃肠黏膜的损伤、修复有着重要的关系; 也有研究表明TFF3蛋白与肿瘤的发生、发展、预后有一定的关系, 但TFF3蛋白所呈现出的双重作用的具体机制尚不明了.
本文首次报道了TFF3蛋白随着组织学分级的逐步改变, 其表达位置出现空间和时间上的转变, 可能是该蛋白出现不同作用的结构基础.
本课题采用免疫组织化学技术对TFF3贲门不同病变中的表达进行了检测分析, 结果提示TFF3贲门黏膜癌变演进过程中起重要作用, 有可能作为贲门癌早期诊断的重要参考指标之一.
本研究应用常规方法检测了贲门癌高发地区贲门炎、肠化组织、肠化伴不典型增生以及癌中TFF3的表达、定位情况, 探讨了TFF3在表达量及位点与肠化过程的相关性, 对于认识TFF3在贲门癌发生过程中的作用具有重要意义.
编辑: 李军亮 电编:吴鹏朕
| 3. | Gutiérrez-González L, Wright NA. Biology of intestinal metaplasia in 2008: more than a simple phenotypic alteration. Dig Liver Dis. 2008;40:510-522. [PubMed] [DOI] |
| 4. | Nam KT, Lee HJ, Mok H, Romero-Gallo J, Crowe JE Jr, Peek RM Jr, Goldenring JR. Amphiregulin-deficient mice develop spasmolytic polypeptide expressing metaplasia and intestinal metaplasia. Gastroenterology. 2009;136:1288-1296. [PubMed] [DOI] |
| 5. | Paulsen FP, Woon CW, Varoga D, Jansen A, Garreis F, Jäger K, Amm M, Podolsky DK, Steven P, Barker NP. Intestinal trefoil factor/TFF3 promotes re-epithelialization of corneal wounds. J Biol Chem. 2008;283:13418-13427. [PubMed] [DOI] |
| 6. | Dürer U, Hartig R, Bang S, Thim L, Hoffmann W. TFF3 and EGF induce different migration patterns of intestinal epithelial cells in vitro and trigger increased internalization of E-cadherin. Cell Physiol Biochem. 2007;20:329-346. [DOI] |
| 7. | 唐 忠辉, 陈 华生, 邹 宗楷, 蔡 韶滨, 苏 海燕, 沈 洪武, 吴 文乔, 林 莉, 王 元亨. TFF3和CD147在不同胃黏膜病变中的表达及其与血管生成的关系. 世界华人消化杂志. 2008;16:3631-3636. [DOI] |
| 8. | Furuta GT, Turner JR, Taylor CT, Hershberg RM, Comerford K, Narravula S, Podolsky DK, Colgan SP. Hypoxia-inducible factor 1-dependent induction of intestinal trefoil factor protects barrier function during hypoxia. J Exp Med. 2001;193:1027-1034. [PubMed] [DOI] |
| 9. | Storesund T, Hayashi K, Kolltveit KM, Bryne M, Schenck K. Salivary trefoil factor 3 enhances migration of oral keratinocytes. Eur J Oral Sci. 2008;116:135-140. [PubMed] [DOI] |
| 10. | Babyatsky M, Lin J, Yio X, Chen A, Zhang JY, Zheng Y, Twyman C, Bao X, Schwartz M, Thung S. Trefoil factor-3 expression in human colon cancer liver metastasis. Clin Exp Metastasis. 2009;26:143-151. [DOI] |
| 12. | Taupin D, Ooi K, Yeomans N, Giraud A. Conserved expression of intestinal trefoil factor in the human colonic adenoma-carcinoma sequence. Lab Invest. 1996;75:25-32. [PubMed] |
| 13. | Madsen J, Nielsen O, Tornøe I, Thim L, Holmskov U. Tissue localization of human trefoil factors 1, 2, and 3. J Histochem Cytochem. 2007;55:505-513. [PubMed] [DOI] |