修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2009-12-18
目的: 探讨食管鳞状细胞癌中基因EphA2与hMLH1、hMSH2 mRNA在新疆维吾尔族和汉族中的表达以及与临床病理特征之间的关系.
方法: 利用RT-PCR技术检测30例维吾尔族和30例汉族食管鳞癌组织与食管远隔无癌组织中EphA2与hMLH1、hMSH2 mRNA的表达.
结果: EphA2在癌组织和远隔无癌组织中的阳性表达率分别为71.7%和46.7%, 差异有统计学意义(χ2 = 7.761, P = 0.005), EphA2的差异表达率为56.7%(癌组织大于远隔无癌组织), EphA2表达与浸润深度、淋巴结转移和民族有关(P<0.05); hMLH1在癌组织中的阳性表达率(63.3%)低于远隔无癌组织(88.3%), 差异有统计学意义(χ2 = 9.130, P = 0.003), hMLH1的差异表达率为75.0%(远隔无癌组织大于癌组织), hMSH2在癌组织和远隔无癌组织中的阳性表达率分别为: 83.3%和86.7%, 差异无统计学意义(χ2 = 0.261, P = 0.609), hMSH2的差异表达率为81.7%(远隔无癌组织大于癌组织), hMLH1和hMSH2阳性表达率与临床分期有关(P<0.05); EphA2的表达与hMLH1、hMSH2两者之间成负相关.
结论: 基因EphA2、hMLH1、hMSH2通过不同的途径和机制共同促进食管癌的发生、发展, 联合检测有望成为食管癌高发人群普查和筛查的标志物.
引文著录: 叶骉飞, 李惠武, 庞作良, 李卉, 田勍, 陈艳, 郭文佳, 李秀梅, 王洪江. EphA2、hMLH1、hMSH2 mRNA在新疆维吾尔及汉族食管鳞癌中的表达及意义. 世界华人消化杂志 2009; 17(35): 3635-3639
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: December 18, 2009
AIM: To investigate the significance of Ephrin A2 (EphA2), human mutl homolog 1 (hMLH1) and hMSH2 mRNA expression and explore their relationship with clinicopathological parameters in esophageal carcinoma in Chinese Uygur and Han patients in Xinjiang.
METHODS: The expression of EphA2, hMLH1 and hMSH2 mRNAs was detected by reverse transcription-polymerase chain reaction (RT-PCR) in esophageal carcinoma and distant non-carcinoma tissues from 30 Chinese Uygur patients and 30 Chinese Han patients.
RESULTS: The positive rate of EphA2 expression was significantly higher in esophageal carcinoma than in distant non-carcinoma tissue (71.7% vs 46.7%; χ2 = 7.761, P = 0.005). The differential expression rate of EphA2 was 56.7% between esophageal carcinoma and distant non-carcinoma tissue. The expression of EphA2 was correlated with the depth of invasion, lymph node metastasis and patients' nationality in esophageal carcinoma (P < 0.05). The positive rate of hMLH1 expression was significantly lower in esophageal carcinoma than in distant non-carcinoma tissue (63.3% vs 88.3%, χ2 = 10.231, P = 0.001). The differential expression rate of hMLH1 was 75.0% between esophageal carcinoma and distant non-carcinoma tissue. There was significant difference in the positive rate of hMSH2 expression between carcinoma and non-carcinoma tissue (83.3% vs 86.7%, χ2 = 0.261, P = 0.609). The differential expression rate of hMSH2 was 81.7% between esophageal carcinoma and distant non-carcinoma tissue. Significant correlations were noted between the expression of hMLH1 and hMSH2 and tumor stage (both P < 0.05). The expression of EphA2 was negatively correlated with hMLH1 and hMSH2 expression.
CONCLUSION: EphA2, hMLH1 and hMSH2 play important roles in the carcinogenesis and metastasis of esophageal cancer. Combined detection of EphA2, hMLH1 and hMSH2 expression may be used to screen for esophageal carcinoma in a high-risk population.
- Citation: Ye BF, Li HW, Pang ZL, Li H, Tian Q, Chen Y, Guo WJ, Li XM, Wang HJ. Significance of EphA2, hMLH1 and hMSH2 mRNA expression in esophageal squamous cell carcinoma in Chinese Uygur and Han patients in Xinjiang. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3635-3639
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3635.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3635
食管癌是常见的消化系恶性肿瘤之一, 我国是世界上食管癌发病率和死亡率最高的国家. 全世界每年新增患者约有30万人, 其中一半以上来自我国[1]. 流行病学调查显示, 新疆是我国食管癌的高发区之一. 目前, 食管癌的发病机制尚不清楚. 近年来随着分子生物学的快速发展, DNA损伤修复基因和信号转导通路成为研究的热点. 本研究通过逆转录-聚合酶链反应(RT-PCR)技术对30例新疆维吾尔族和30例汉族食管鳞癌组织及其对应的远隔无癌组织中EphA2和hMLH1、hMSH2的mRNA表达情况进行检测并分析其意义.
60例食管鳞癌组织标本取自2008-01/2009-05新疆医科大学附属肿瘤医院手术切除标本, 维吾尔族和汉族各30例, 男43例, 女17例, 年龄36-75(中位62)岁. 60例全部为鳞癌, 所有病例术前均未行放疗、化疗. 所有标本在离体后30 min内迅速取材, 每例标本均取癌组织及远端6 cm以上的远隔无癌组织两部分置于液氮罐中, 然后放于-70 ℃冰箱中保存.
1.2.1 组织总RNA的提取: 取约0.1 g组织, 加入1 mL预冷的TRIzol提取液, 在玻璃匀浆器充分匀浆, 其余步骤严格按TRIzol RNA提取试剂盒说明书进行, 再用紫外分光光度计检测RNA的含量及纯度, 所得RNA溶解于50 μL DRPC处理水中.
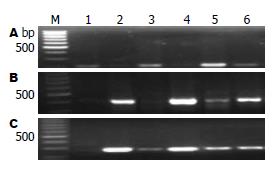
1.2.2 RT-PCR检测: 经过逆转录后再以cDNA为模板扩增. PCR操作步骤严格按照试剂盒说明书进行, 主要引物序列见表1, 主要扩增片段大小分别为: EphA为204 bp, hMLH1为400 bp, hMSH2为279 bp, GAPDH: 300 bp. 总体系为20 μL, 其中Taq酶缓冲液10 μL, 上下游引物各1 μL, Mg2+ 0.4 μL, 模板cDNA 2 μL, 剩余用水补至20 μL, 混合离心后30 s, 取出混匀后的反应体系置于PCR仪中进行扩增, 循环次数为35次, 扩增产物取6 μL在20 g/L琼脂糖进行凝胶电泳, 在凝胶成像仪上照相和测定分析.
| 基因 | 上游引物 | 下游引物 | 退火温度( ℃) | 循环次数 | |
| EphA2 | 5'-ATCCTCGTCAACAGCAAC-3' | 5'-GGTCATCACCTCCCACAT-3' | 60 | 35 | |
| hMLH1 | 5'-GCTTGCCTTAGATAGTCCAG-3' | 5'-GACAATGTGTTCCACAGTCC-3' | 57 | 35 | |
| hMSH2 | 5'-ACGATGGATTTGGGTTAG-3' | 5'-CCAGGGCTTTCTGTTTAG-3' | 56 | 35 | |
| GAPDH | 5'-CGCGGGCTCTCCAGAACATCAT-3' | 5'-CCAGCCCCAGCGTCAAAGGTG-3' | 59 | 35 | |
统计学处理 所有数据均经SPSS13.0统计软件进行统计学处理, 采用χ2检验, P<0.05有统计学意义.
与标准Marker相比, 在204、279和400 bp处可见明显亮带, 与预期目的片段大小一致(图1).
在60例食管鳞癌患者的癌组织和远隔无癌组织中, EphA2在两组织中表达差异有统计学意义(χ2 = 7.761, P = 0.005), 其差异表达率为56.7%(癌组织大于远隔无癌组织); hMLH1在两组织中表达差异有统计学意义(χ2 = 10.231, P = 0.001), 其差异表达率为75.0%(远隔无癌组织大于癌组织); hMSH2在两组织中的表达差异无统计学意义(χ2 = 0.261, P = 0.609), 其差异表达率为81.7%(远隔无癌组织大于癌组织); EphA2表达与肿瘤浸润深度、淋巴结转移和民族有关, 而与分期、分化程度无关; hMLH1、hMSH2的表达均与食管癌的临床分期有关, 而与浸润深度、分化程度、淋巴结转移及民族无关(表2). 食管鳞癌中EphA2、hMLH1、hMSH2 mRNA三者表达之间的关系(表3).
| 项目 | n | EphA2 n(%) | χ2值 | P值 | hMLH1 n(%) | χ2值 | P值 | hMSH2 n(%) | χ2值 | P值 | |||
| 正常组织 | 60 | 28(46.7) | 7.761 | 0.005 | 53(88.3) | 9.130 | 0.003 | 52(86.7) | 0.261 | 0.609 | |||
| 癌组织 | 60 | 43(71.7) | 39(65.0) | 50(83.3) | |||||||||
| 民族 | |||||||||||||
| 汉族 | 30 | 17(56.7) | 6.648 | 0.010 | 23(76.7) | 3.590 | 0.058 | 26(86.7) | 0.480 | 0.488 | |||
| 维族 | 30 | 26(86.7) | 16(53.3) | 24(80.0) | |||||||||
| 浸润深度 | |||||||||||||
| T1+T2 | 11 | 5(45.5) | 4.558 | 0.033 | 8(72.7) | 0.354 | 0.552 | 8(72.7) | 1.091 | 0.296 | |||
| T3+T4 | 49 | 38(77.6) | 31(63.3) | 42(85.7) | |||||||||
| 分期 | |||||||||||||
| Ⅰ+Ⅱa | 20 | 15(75.0) | 0.164 | 0.685 | 18(90.0) | 8.242 | 0.009 | 20(100.0) | 6.000 | 0.014 | |||
| Ⅱb+Ⅲ | 40 | 28(70.0) | 21(52.5) | 30(75.0) | |||||||||
| 分化程度 | |||||||||||||
| 高分化 | 16 | 11(68.8) | 0.091 | 0.762 | 8(50.0) | 2.158 | 0.142 | 12(75.0) | 1.091 | 0.296 | |||
| 中-低分化 | 44 | 32(72.7) | 31(70.5) | 38(86.4) | |||||||||
| 淋巴结转移 | |||||||||||||
| 是 | 35 | 31(88.6) | 11.822 | 0.001 | 22(62.9) | 0.170 | 0.681 | 27(77.1) | 2.318 | 0.128 | |||
| 否 | 25 | 12(48.0) | 17(68.0) | 23(92.0) | |||||||||
| 基因 | EphA2 | χ2值 | P值 | ||
| + | - | ||||
| HMLH1 | + | 23 | 16 | 8.840 | 0.003 |
| - | 20 | 1 | |||
| hMSH2 | + | 39 | 11 | 5.926 | 0.015 |
| - | 4 | 6 | |||
在外界的刺激信息传递给细胞核并转化成细胞效应的信号转导通路过程中, 具有酪氨酸激酶活性的受体(RTKs)起着重要作用. Eph(erythropoietin producing hepatomacellular)是RTKs家族成员之一, EphA2是EphA亚家族受体14个成员中的第2个, 也是Eph亚家族成员中被发现的具有酪氨酸酶活性的第1个基因编码产物, 其广泛表达于人的多种组织或细胞系中, 包括皮肤、肺脏、肠道上皮细胞和卵巢组织等. 正常上皮细胞EphA2与配体结合, 导致自身及下游大量底物酪氨酸磷酸化, 从而调节细胞增殖及分化, 促进胚胎发育. 在癌细胞中, 主要以非磷酸化状态存在. 近年来研究显示, EphA2在多种肿瘤组织中高表达, 包括乳腺癌、肺癌、胃癌等, 进一步的研究证实EphA2过表达促进肿瘤向恶性转化及肿瘤的浸润和转移的作用[2-4], 但EphA2在食管癌中的研究少见报道.
本研究应用RT-PCR方法对食管癌组织和食管远隔无癌组织中EphA2 mRNA的表达进行检测, 结果显示, EphA2在食管癌组织和远隔无癌组织中均有表达, 但EphA2 mRNA在癌组织中的表达明显高于远隔无癌组织(P = 0.002), 而且癌组织大于远隔无癌组织的差异表达率为56.7%, 提示EphA2有双重调节作用, 一方面参与了正常食管细胞的生长发育, 另一方面作为一种重要的致癌基因促进了食管癌的发生和发展. 在肿瘤组织中, 过表达的EphA2不能与配体很好的结合, 丧失了对肿瘤细胞生长和迁移的负调节作用, 消弱了肿瘤细胞之间的黏附, 并增强细胞与细胞外基质的黏附, 破坏细胞骨架的稳定性, 导致细胞失控性生长而形成肿瘤, 以及运动无规则导致肿瘤细胞的侵袭、浸润、甚至转移的发生. 有关食管癌中EphA2表达的国内研究也有报道, 徐峰et al[5]研究结果显示, 19例正常食管上皮中, EphA2蛋白的阳性表达6例(31.6%), 173例食管鳞癌中EphA2蛋白的阳性表达140例(80.9%), 两者具有显著性差异(P<0.05). 研究发现EphA2 mRNA的表达在食管癌组织和其正常黏膜中未见显著性差异, 但其蛋白在食管癌组织中的表达明显高于其正常黏膜, EphA2的mRNA水平和蛋白表达水平不完全一致[6], 这可能与转录后的不协调有关. 本研究中食管鳞癌EphA2的表达与民族、临床分期和淋巴结转移有关, 临床分期越晚, EphA2的阳性表达率越高; 淋巴结转移阳性者明显高表达于淋巴结转移阴性者(P = 0.020), 表明EphA2与食管鳞癌的侵袭转移有关, 其过表达提示恶性程度高, 分期晚, 易发生远处转移. 维吾尔族EphA2高表达于汉族, 提示EphA2在两民族中的表达可能具有差异性, 希望通过以后的大样本研究使其成为高发区食管癌普查和筛查的生物学标志物.
DNA损伤在细胞增殖的过程中是一种比较普遍的现象, 但是遗传信息得以能够完整稳定的代代相传, 依赖于生物进化过程中形成的一套十分有效的DNA损伤修复系统. hMLH1和hMSH2是错配修复(mismatch repair, MMR)基因系统中的重要成员[7], 之所以说重要是因为二者在错配修复过程中起主要作用. hMSH2在一开始就参与了错配碱基位点的识别, hMLH1则是在中间过程中特定的结合到前者识别的错配位点, 整个过程两者既联系又独立, 任一基因出现问题, 均会导致错配修复的失败. DNA修复能力低下与癌症风险增高相关. 在散发性大肠癌、胃癌、肝癌、肺癌、乳癌、卵巢癌及子宫内膜癌等肿瘤中,均存在错配修复系统的异常[11], 常常表现为hMLH1和(或)hMSH2基因表达上调或下调. 如在食管癌中, 常常由于错配修复基因的突变、缺失引起蛋白表达的水平降低[8], 研究在口腔鳞癌[9]、大肠癌[10]等恶性肿瘤中亦有相同结果. 而另一些研究表明, 肺癌、膀胱癌及胃癌等hMLH1和hMSH2基因表达出现增多的现象[11-12]. 目前的研究多集中于蛋白水平, 本研究采用RT-PCR方法, 在食管鳞癌组织和食管远隔无癌组织中对这2个基因的mRNA水平进行检测, 结果显示, 癌组织中hMLH1的表达水平低于远隔组织, 而hMSH2在两组织中的表达无差异, 但是在研究远隔无癌组织较癌组织的差异表达率时发现, 两者均有很高的比率, 并且早期(Ⅰ+Ⅱa)患者明显高表达于中晚期(Ⅱb+Ⅲ), 提示hMLH1在食管癌的发生过程中起主导作用, 同时hMLH1和hMSH2基因的突变在早期即参与了食管鳞癌的发生和发展. 究竟是什么原因引起该基因的突变呢? 已有不少研究证实[13-14], 启动子甲基化是重要原因.
通过分析, EphA2与hMLH1、hMSH2两者之间成负相关, 他们通过不同的途径和机制共同促进食管癌的发生以及浸润和转移. 在临床工作中通过联合检测EphA2和hMLH1、hMSH2三者的表达情况, 尤其是在食管癌的高发人群, 如新疆哈萨克族和维吾尔族人群, 希望能成为普查和筛查的生物学标志物, 同时联合检测有望成为食管癌早期诊断、判断预后及预测远处转移的分子标志物之一.
近年来研究显示, EphA2在多种肿瘤组织中高表达, 包括乳腺癌、肺癌、胃癌等, 进一步的研究证实EphA2过表达促进肿瘤向恶性转化及肿瘤的浸润和转移的作用, 但EphA2在食管癌中的研究少见报道.
张军, 教授, 西安交通大学医学院第二附属医院消化内科.
目前, 食管癌的发病机制尚不清楚. 近年来随着分子生物学的快速发展, DNA损伤修复基因和信号转导通路成为研究的热点.
徐峰 et al研究结果显示, 19例正常食管上皮中, EphA2蛋白的阳性表达6例(31.6%), 173例食管鳞癌中EphA2蛋白的阳性表达140例(80.9%), 两者具有显著性差异.
本研究选题较好, 设计合理, 结果可靠, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 2. | Abraham S, Knapp DW, Cheng L, Snyder PW, Mittal SK, Bangari DS, Kinch M, Wu L, Dhariwal J, Mohammed SI. Expression of EphA2 and Ephrin A-1 in carcinoma of the urinary bladder. Clin Cancer Res. 2006;12:353-360. [PubMed] [DOI] |
| 3. | Wu D, Suo Z, Kristensen GB, Li S, Troen G, Holm R, Nesland JM. Prognostic value of EphA2 and EphrinA-1 in squamous cell cervical carcinoma. Gynecol Oncol. 2004;94:312-319. [PubMed] [DOI] |
| 4. | Nasreen N, Mohammed KA, Antony VB. Silencing the receptor EphA2 suppresses the growth and haptotaxis of malignant mesothelioma cells. Cancer. 2006;107:2425-2435. [PubMed] [DOI] |
| 5. | 徐 峰, 李 娅, 袁 丽, 李 继昌, 索 振河, Jahn M. Nesland. 食管鳞状细胞癌组织中EphA2和EphrinA1的表达. 郑州大学学报(医学版). 2008;43:422-425. |
| 7. | Ellison AR, Lofing J, Bitter GA. Human MutL homolog (MLH1) function in DNA mismatch repair: a prospective screen for missense mutations in the ATPase domain. Nucleic Acids Res. 2004;32:5321-5338. [PubMed] [DOI] |
| 8. | Uehara H, Miyamoto M, Kato K, Cho Y, Kurokawa T, Murakami S, Fukunaga A, Ebihara Y, Kaneko H, Hashimoto H. Deficiency of hMLH1 and hMSH2 expression is a poor prognostic factor in esophageal squamous cell carcinoma. J Surg Oncol. 2005;92:109-115. [PubMed] [DOI] |
| 10. | Chialina SG, Fornes C, Landi C, de la Vega Elena CD, Nicolorich MV, Dourisboure RJ, Solano A, Solis EA. Microsatellite instability analysis in hereditary non-polyposis colon cancer using the Bethesda consensus panel of microsatellite markers in the absence of proband normal tissue. BMC Med Genet. 2006;7:5. [PubMed] [DOI] |
| 11. | Srivastava T, Chattopadhyay P, Mahapatra AK, Sarkar C, Sinha S. Increased hMSH2 protein expression in glioblastoma multiforme. J Neurooncol. 2004;66:51-57. [PubMed] [DOI] |
| 12. | 李 梅, 刘 丽娜, 王 朝晖, 王 丽宏, 刘 志敏, 许 国旺, 吕 申. 错配修复蛋白hMSH2、hMLH1表达在胃癌发生中的作用及临床意义. 中国肿瘤临床. 2007;34:1396-1399. |
| 13. | Tzao C, Hsu HS, Sun GH, Lai HL, Wang YC, Tung HJ, Yu CP, Cheng YL, Lee SC. Promoter methylation of the hMLH1 gene and protein expression of human mutL homolog 1 and human mutS homolog 2 in resected esophageal squamous cell carcinoma. J Thorac Cardiovasc Surg. 2005;130:1371. [PubMed] [DOI] |