修回日期: 2009-12-12
接受日期: 2009-12-14
在线出版日期: 2009-12-18
目的: 进一步研究干扰素-α(IFN-α)对人肝癌细胞胸苷磷酸化酶(TP)表达及凋亡的双重影响.
方法: 体外分别用0、10、100、1000、5000、10 000 kU/L IFN-α处理人肝癌细胞SMMC-7721, RT-PCR检测细胞TP mRNA表达水平, 免疫细胞化学方法检测细胞TP蛋白表达变化, 流式细胞仪检测凋亡细胞百分比.
结果: IFN-α上调SMMC-7721细胞TP mRNA表达水平, 呈现剂量依赖性. 与未处理组相比, 浓度为5000、10 000 kU/L的IFN-α处理的细胞TP mRNA表达水平显著升高(P<0.05), 而且细胞质内TP蛋白染色强度及阳性染色细胞数均较未处理组的细胞差别明显, 但不同浓度的IFN-α对凋亡细胞百分比的影响不明显, 对照组和浓度10 000 kU/L IFN-α组的凋亡细胞百分比分别为7.19%±2.76%和6.42%±3.66%, 差别无统计学意义.
结论: 一定剂量的IFN-α既能上调肝癌细胞TP表达水平, 又能抵消TP表达上调后抑制细胞凋亡的作用.
引文著录: 肖永胜, 周俭, 樊嘉, 孙绮蛮, 赵燕, 薛琼, 沈早卓, 汤钊猷. 干扰素对肝癌细胞胸苷磷酸化酶表达和凋亡的双重影响. 世界华人消化杂志 2009; 17(35): 3630-3634
Revised: December 12, 2009
Accepted: December 14, 2009
Published online: December 18, 2009
AIM: To investigate the effects of interferon-alpha (IFN-α) on thymidine phosphorylase (TP) expression and apoptosis in human hepatocellular carcinoma SMMC-7721 cells.
METHODS: The expression of TP mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR). The expression of TP protein was evaluated by immunocytochemistry. The percentage of apoptotic cells was measured by flow cytometry.
RESULTS: IFN-α upregulated the expression of TP mRNA in a dose-dependent manner in SMMC-7721 cells. IFN-α at a dose of 5000 or 10 000 kU/L induced a 3-fold upregulation of TP mRNA compared to non-treated cells (P < 0.05). Compared with non-treated cells, the intensity of TP staining and the number of TP-positive cells significantly increased in IFN-α treated cells (5000 or 10 000 kU/L). However, no significant difference was found in the percentage of apoptotic cells between IFN-α (10 000 kU/L)-treated cells and non-treated cells (6.42% ± 3.66% vs 7.19% ± 2.76%, P > 0.05).
CONCLUSION: IFN-α at appropriate doses may upregulate the expression of TP mRNA and protein and antagonize TP-induced inhibition of apoptosis in human hepatocellular carcinoma cells.
- Citation: Xiao YS, Zhou J, Fan J, Sun QM, Zhao Y, Xue Q, Shen ZZ, Tang ZY. Effects of interferon-alpha on thymidine phosphorylase expression and apoptosis in human hepatocellular carcinoma SMMC-7721 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3630-3634
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3630.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3630
胸苷磷酸化酶(thymidine phosphorylase, TP)在肿瘤组织内部催化卡培他滨等5-氟尿嘧啶(5-fluorouracil, 5-FU)的前体药物转化为有细胞毒作用的5-FU, 是5-FU前体化疗药物发挥作用的关键酶[1]. 但TP同时能抵抗缺氧[2]、细胞毒性化疗药物[3]诱导的细胞凋亡. 有报道干扰素(interferon, IFN)能够上调肿瘤细胞内TP酶的表达[4-6], 同时一定剂量的IFN又能够诱导肝癌细胞的凋亡[7-9]. 本课题拟进一步研究干扰素-α (IFN-α)对肝癌细胞TP表达及凋亡的双重影响, 为临床联合应用IFN-α与卡培他滨防治肝癌提供实验依据.
人肝癌细胞系SMMC-7721引自第二军医大学, 用含10%小牛血清的RPMI 1640培养液, 在37 ℃、50 mL/L CO2的培养箱中培养和传代. 干扰素-α(IFN-α): 由罗氏公司上海分公司惠赠.
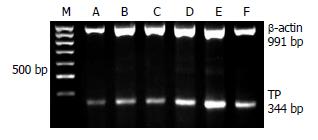
1.2.1 不同浓度IFN-α对SMMC-7721细胞TP mRNA表达水平的影响: 将对数生长期的细胞铺于6孔板, 培养24 h, 弃去原培养液, 分别加入含IFN-α的新鲜培养液, IFN-α的浓度分别为0、10、100、1000、5000、10 000 kU/L, 继续培养24 h, 每个浓度2个孔. 利用半定量RT-PCR方法[10]检测细胞TP mRNA表达水平, TP引物5'-ACAAGGTCAGCCTGGTCCTC-3'(forward)和5'-TCCGAACTTAACGTCCACCAC-3'(reverse), 产生344 bp PCR产物. 内参照β-actin引物5'-TGGGCATGGGTCAGAAGGAT-3'(forward)和5'-AAGCATTTGCGGTGGACGAT-3'(reverse), 产生991 bp PCR产物. PCR反应参数: 94 ℃预变性5 min; 94 ℃变性30 s、60 ℃退火1 min、72 ℃延伸2 min, 35个循环后72 ℃再延伸10 min. PCR产物于1.7%琼脂糖凝胶电泳, 用Imagemaster VDS system给凝胶照相, 并分析凝胶中的PCR产物. 重复上述实验3次.
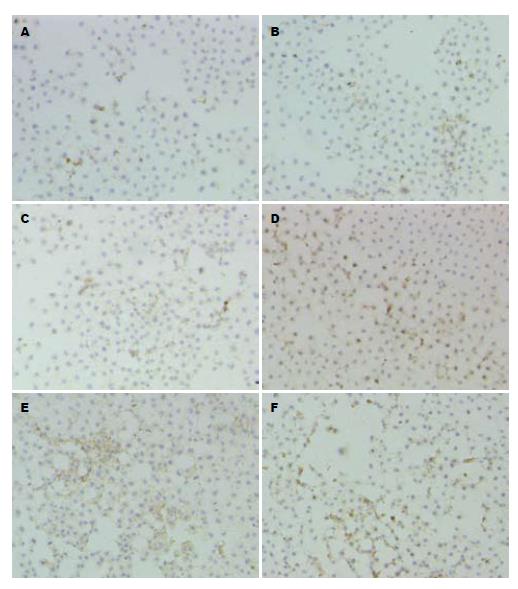
1.2.2不同浓度IFN-α对SMMC-7721细胞TP蛋白表达水平的影响: 胰酶消化、收集IFN-α处理的肝癌细胞, 室温, 400 g离心4 min, 弃上清. 加入1 mL PBS, 重悬细胞, 室温, 400 g离心4 min, 弃去大部分上清, 保留约50-100 μL, 重悬细胞, 涂于载玻片上, 滴入鼠抗人TP/PD-ECGF抗体, 置于湿盒中室温孵育60 min, TBS缓冲液冲洗载玻片3次, 滴入EnVisionTM液, 置于湿盒室温孵育30 min. 涂片置新鲜配置的0.04% DAB显色液中(40 mg DAB溶于TBS液70 mL中, 滴加1% H2O2 30 mL)显色2-10 min. 水洗终止反应, 苏木素复染, 盐酸酒精分化, 65 ℃恒温烤片30 min, 二甲苯透明中性树胶封片, NIKON MICROPHOT EPI-FL显微镜观片.
1.2.3 不同浓度IFN-α对SMMC-7721细胞凋亡水平的影响: 将上述不同浓度IFN-α处理的肝癌细胞制成1×109个/L单细胞悬液, 离心, 弃上清, 加入2 mL预冷的柠檬酸固定30 min. 再离心, 弃上清, 加入RNase A, 37 ℃孵育10 min后放入冰浴中, 加入0.5 mL碘化丙锭(50 mg/L)行DNA染色. 流式细胞仪检测IFN-α对细胞凋亡的影响[10]. 重复上述实验3次.
统计学处理 采用SPSS11.0统计软件进行统计分析, P<0.05为差别具有统计学意义.
SMMC-7721细胞应用IFN-α处理后, TP mRNA表达水平逐渐升高, 具有剂量依赖性. 用浓度5000与10 000 kU/L IFN-α处理细胞, TP mRNA表达水平显著升高, 与未用IFN-α处理组相比, 差别具有统计学意义(P<0.05, 图1).
应用IFN-α后, SMMC-7721细胞TP染色强度逐渐增加, TP阳性染色主要集中在细胞质中, 阳性染色细胞数目逐渐增多, 当IFN-α浓度为5000、10 000 kU/L时, TP染色强度及阳性染色细胞数均较未用IFN的细胞差别明显. IFN-α浓度达10 000 kU/L时, TP染色强度及阳性染色细胞数均达最高水平(图2).
5-FU作为多种恶性肿瘤特别是消化系肿瘤(包括肝癌)的主要化疗药物已有40多年历史, 但有效率仅15%. 卡培他滨是一个新型的氟尿嘧啶前体药, 已被美国FDA批准用于紫杉醇抵抗的乳腺癌的临床治疗[11], TP是其发挥作用的关键酶. 由于肿瘤具有异质性, 如何提高TP低表达或无表达的肿瘤对氟尿嘧啶前体药物的敏感性, 是进一步提高其疗效的关键.
目前提高肿瘤组织中TP表达水平的方法包括转染TP cDNA[12], 以提高肿瘤细胞的TP mRNA表达水平, 但受转染效率、表达载体及给药途径等的限制尚不能广泛应用于临床. 另外, 多种细胞因子如IL-1α、TNF-α、IFN-γ、IFN-α都能上调TP的表达或活性[4-6,13].
IFN-α作用于细胞表面I型干扰素受体后, 通过细胞内JAK-STAT信号通路[4], 活化TP基因转录起始位点存在的IFN-α激活反应元件(TP/ISRE)[14], 从而加速TP基因的转录. 本研究结果亦显示, 较高浓度IFN-α作用24 h能使SMMC-7721细胞TP mRNA表达水平升高3倍, TP染色强度及阳性染色细胞的数量在高浓度IFN-α作用的显著增加. 同时IFN-α还具有稳定TP mRNA的作用. TP mRNA分析表明, 在其mRNA转录末端第40个核苷酸处存在与稳定mRNA的顺式反应元件[15]同源的富含嘧啶核苷酸的序列(92%), IFN-α可能通过影响该嘧啶核苷酸富集序列而稳定TP mRNA.
有报道指出, TP能抑制缺氧[2]和顺铂[3]诱导的细胞凋亡. TP通过抑制Fas蛋白介导的途径抑制细胞凋亡的发生, 且TP的这一功能不受其催化活性的影响[16]. TP抵抗细胞损伤因素诱导的凋亡至少部分受PI3K/Akt信号途径调控[17]. 我们以前的研究表明, 与未转染的细胞相比, 转染TP cDNA后肝癌细胞凋亡被抑制近50%[10]. 本实验却观察到, 随着培养液中IFN-α浓度增加, SMMC-7721细胞TP mRNA表达水平显著增加, 但细胞凋亡百分比并未出现显著下降, 即IFN-α可能通过促进细胞凋亡的作用, 恰好抵消了TP mRNA表达上调后对细胞凋亡的抑制作用. 结合文献分析, IFN-α促进细胞凋亡的机制可能包括: (1)通过Fas/FasL途径起作用. IFN-α通过上调细胞Fas和/或Fas L的表达[18], 增强细胞对Fas诱导凋亡信号敏感性[19]. (2)自分泌TNF-α, 促进细胞凋亡[20].
卡培他滨等5-FU的前体药物依赖肿瘤组织中的TP酶发挥选择性抗肿瘤作用, 本研究结果表明, 应用一定剂量的IFN-α既能实现上调肝癌细胞TP的表达水平, 又通过其自身所具有的促进细胞凋亡的作用而抵消了TP表达上调后所致的抑制细胞凋亡的作用, 为IFN-α与5-FU前体药联合应用于临床治疗肝细胞癌提供了实验依据.
肝细胞癌是全球最常见的恶性肿瘤之一, 每年有50余万新发病例, 其中50%在中国. 目前化疗在肝细胞癌的综合治疗中仍有很大需求, 尤其是出现肺、骨等脏器的转移. 全身应用5-氟尿嘧啶对肝癌的有效率仅约15%.
郝纯毅, 主任医师, 北京肿瘤医院肿瘤外科.
对肿瘤细胞而言, 胸苷磷酸化酶(TP)是一把"双刃剑". 肿瘤细胞TP表达水平上调, 对5-氟尿嘧啶类前体化疗药物敏感性增加, 但TP表达上调后同时具有促进血管生成、抑制细胞凋亡的不良作用. 多种细胞因子能够上调肿瘤细胞TP表达.
深入研究IFN-α对TP"双刃剑"作用的影响, 为临床联合应用IFN-α与卡培他滨等5-氟尿嘧啶的前体药物治疗肝细胞癌提供更多的实验依据.
本研究选题较好, 设计合理, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Bronckaers A, Gago F, Balzarini J, Liekens S. The dual role of thymidine phosphorylase in cancer development and chemotherapy. Med Res Rev. 2009;29:903-953. [PubMed] [DOI] |
| 2. | Kitazono M, Takebayashi Y, Ishitsuka K, Takao S, Tani A, Furukawa T, Miyadera K, Yamada Y, Aikou T, Akiyama S. Prevention of hypoxia-induced apoptosis by the angiogenic factor thymidine phosphorylase. Biochem Biophys Res Commun. 1998;253:797-803. [PubMed] [DOI] |
| 3. | Ikeda R, Furukawa T, Mitsuo R, Noguchi T, Kitazono M, Okumura H, Sumizawa T, Haraguchi M, Che XF, Uchimiya H. Thymidine phosphorylase inhibits apoptosis induced by cisplatin. Biochem Biophys Res Commun. 2003;301:358-363. [PubMed] [DOI] |
| 4. | Yao Y, Kubota T, Sato K, Takeuchi H, Kitai R, Matsukawa S. Interferons upregulate thymidine phosphorylase expression via JAK-STAT-dependent transcriptional activation and mRNA stabilization in human glioblastoma cells. J Neurooncol. 2005;72:217-223. [PubMed] [DOI] |
| 5. | de Bruin M, Smid K, van der Ent MA, Fukushima M, Pinedo HM, Peters GJ. Upregulation of platelet derived endothelial cell growth factor/thymidine phosphorylase by interferon alpha. Nucleosides. Nucleotides Nucleic Acids. 2004;23:1367-1370. [PubMed] [DOI] |
| 6. | Xiao YS, Tang ZY, Fan J, Zhou J, Wu ZQ, Sun QM, Xue Q, Zhao Y, Liu YK, Ye SL. Interferon-alpha 2a up-regulated thymidine phosphorylase and enhanced antitumor effect of capecitabine on hepatocellular carcinoma in nude mice. J Cancer Res Clin Oncol. 2004;130:546-550. [PubMed] [DOI] |
| 7. | Herzer K, Hofmann TG, Teufel A, Schimanski CC, Moehler M, Kanzler S, Schulze-Bergkamen H, Galle PR. IFN-alpha-induced apoptosis in hepatocellular carcinoma involves promyelocytic leukemia protein and TRAIL independently of p53. Cancer Res. 2009;69:855-862. [PubMed] [DOI] |
| 8. | Murata M, Nabeshima S, Kikuchi K, Yamaji K, Furusyo N, Hayashi J. A comparison of the antitumor effects of interferon-alpha and beta on human hepatocellular carcinoma cell lines. Cytokine. 2006;33:121-128. [PubMed] [DOI] |
| 9. | Yano H, Ogasawara S, Momosaki S, Akiba J, Nishida N, Kojiro S, Ishizaki H, Kojiro M. Expression and activation of apoptosis-related molecules involved in interferon-alpha-mediated apoptosis in human liver cancer cells. Int J Oncol. 2005;26:1645-1652. [PubMed] |
| 10. | 肖 永胜, 汤 钊猷, 樊 嘉, 周 俭, 刘 银坤, 吴 志全, 邱 双健, 赵 燕, 陈 军. 转染胸苷磷酸化酶基因对肝癌细胞的双重影响. 中华实验外科杂志. 2004;21:1053-1055. |
| 11. | Blum JL, Jones SE, Buzdar AU, LoRusso PM, Kuter I, Vogel C, Osterwalder B, Burger HU, Brown CS, Griffin T. Multicenter phase II study of capecitabine in paclitaxel-refractory metastatic breast cancer. J Clin Oncol. 1999;17:485-493. [PubMed] |
| 12. | Evrard A, Cuq P, Ciccolini J, Vian L, Cano JP. Increased cytotoxicity and bystander effect of 5-fluorouracil and 5-deoxy-5-fluorouridine in human colorectal cancer cells transfected with thymidine phosphorylase. Br J Cancer. 1999;80:1726-1733. [PubMed] [DOI] |
| 13. | Eda H, Fujimoto K, Watanabe S, Ura M, Hino A, Tanaka Y, Wada K, Ishitsuka H. Cytokines induce thymidine phosphorylase expression in tumor cells and make them more susceptible to 5'-deoxy-5-fluorouridine. Cancer Chemother Pharmacol. 1993;32:333-338. [PubMed] [DOI] |
| 14. | Schwartz EL, Wan E, Wang FS, Baptiste N. Regulation of expression of thymidine phosphorylase/platelet-derived endothelial cell growth factor in human colon carcinoma cells. Cancer Res. 1998;58:1551-1557. [PubMed] |
| 15. | Tischer E, Mitchell R, Hartman T, Silva M, Gospodarowicz D, Fiddes JC, Abraham JA. The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing. J Biol Chem. 1991;266:11947-11954. [PubMed] |
| 16. | Mori S, Takao S, Ikeda R, Noma H, Mataki Y, Wang X, Akiyama S, Aikou T. Thymidine phosphorylase suppresses Fas-induced apoptotic signal transduction independent of its enzymatic activity. Biochem Biophys Res Commun. 2002;295:300-305. [PubMed] [DOI] |
| 17. | Jeung HC, Che XF, Haraguchi M, Zhao HY, Furukawa T, Gotanda T, Zheng CL, Tsuneyoshi K, Sumizawa T, Roh JK. Protection against DNA damage-induced apoptosis by the angiogenic factor thymidine phosphorylase. FEBS Lett. 2006;580:1294-1302. [PubMed] [DOI] |
| 18. | Kaser A, Nagata S, Tilg H. Interferon alpha augments activation-induced T cell death by upregulation of Fas (CD95/APO-1) and Fas ligand expression. Cytokine. 1999;11:736-743. [PubMed] [DOI] |
| 19. | Lee RK, Cai JP, Deyev V, Gill PS, Cabral L, Wood C, Agarwal RP, Xia W, Boise LH, Podack E. Azidothymidine and interferon-alpha induce apoptosis in herpesvirus-associated lymphomas. Cancer Res. 1999;59:5514-5520. [PubMed] |